
- •Семинар № 6 «Кондуктометрические методы анализа»
- •Кондуктометрия: сущность и классификация
- •Электрическая проводимость растворов
- •Ячейка для прямых кондуктометрических измерений
- •Метод прямой кондуктометрии
- •Метод кондуктометрического титрования
- •Кислотно-основное кондуктометрическое титрование Титрование сильной кислоты сильным основанием
- •Титрование слабой кислоты сильным основанием
- •Титрование смеси веществ
- •Осадительное кондуктометрическое титрование
- •Комплексонометрическое кондуктометрическое титрование
- •Окислительно-восстановительное кондуктометрическое титрование
- •Хронокондуктометрическое титрование
- •Высокочастотное титрование
- •Ячейка для проведения кондуктометрического титрования
- •Общая характеристика, достоинства и практическое применение кондуктометрического метода анализа
Титрование смеси веществ
На рисунке 10 приведена кривая кондуктометрического титрования смеси сильной и слабой кислот. Кривая имеет два излома, соответствующие двум точкам эквивалентности: первая показывает объем щелочи, пошедший на титрование сильной кислоты, а вторая дает общий объем щелочи, израсходованный на титрование обеих кислот. С увеличением константы диссоциации слабой кислоты первый излом будет становиться менее резким, а второй – более четким, и, наоборот, чем слабее кислота, тем резче будет первый излом, и более закругленным второй.
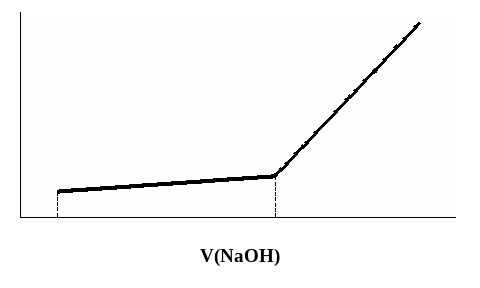
Рис. 10. Кривая кондуктометрического титрования смеси сильной и слабой кислот раствором NaOH
На рисунке 11 представлены кривые титрования смесей двух слабых кислот.
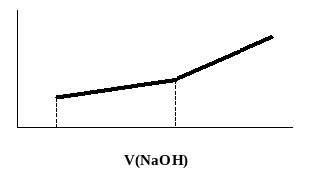
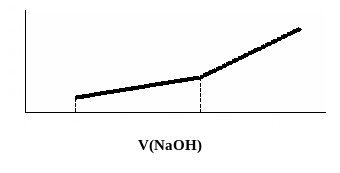
Рис. 11. Кривые кондуктометрического титрования смесей двух слабых кислот раствором NaOH
Осадительное кондуктометрическое титрование
Вид кривой кондуктометрического титрования по методу осаждения зависит от концентрации и подвижности ионов и растворимости образующегося соединения. Чем меньше произведение растворимости продукта реакции, тем резче выражен излом кривой титрования в ТЭ.
Результаты анализа 0,1 М растворов бывают вполне удовлетворительными, если у бинарного соединения ПР≤10-5. У более растворимых соединений ТЭ устанавливается с трудом, так как кривая титрования плавно закругляется. Излом на кривой титрования становится менее четким также с уменьшением концентрации раствора, и, например, при анализе 10-3 М растворов произведение растворимости продукта реакции должно быть уже не больше чем 10-9. Введение в анализируемый водный раствор органического растворителя понижает растворимость, поэтому излом на кривой титрования становится наиболее резким.
При осадительном титровании протекает реакция (в общем виде):
М1А1 + М2А2 = М1А2↓ + М2А1
М1 + А2 = М1А2↓
На рисунке 12 схематично показано изменение концентрации реагирующих частиц при титровании раствора нитрата бария (Ba(NO3)2) раствором сульфата натрия (Na2SO4).
При таком титровании протекает химическая реакция:
Ba2+ + 2NO3- + 2Na+ + SO42- = BaSO4↓ + 2Na+ + 2NO3-
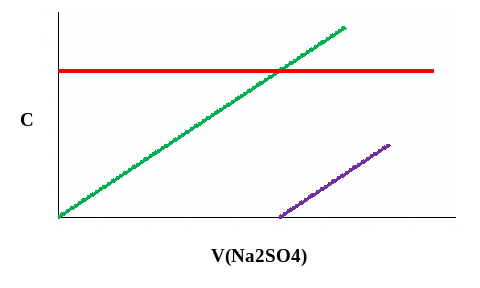
Рис. 12. Изменение концентрации ионов при титровании раствора Ba(NO3)2 раствором Na2SO4
До ТЭ электрическая проводимость будет несколько падать, так как вместо нитрата бария (λ0(Ba2+)=63,6 См·см2/моль эквивалента) в растворе появится эквивалентное количество нитрата натрия (λ0(Na+)=50,1 См·см2/моль эквивалента), то есть в растворе появятся катионы с меньшей величиной подвижности (ионы натрия вместо ионов бария). Первая же капля раствора сульфата натрия после ТЭ вызовет резкое увеличение электрической проводимости раствора благодаря возрастанию концентрации электролита в растворе (рис. 13). Электрическая проводимость перетитрованных растворов, естественно, также будет возрастать.
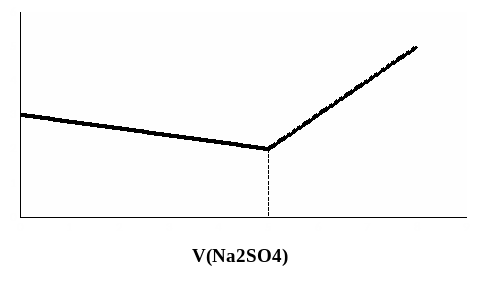
Рис. 13. Кривая кондуктометрического титрования раствора Ba(NO3)2 раствором Na2SO4
Влияние подвижности ионов проявляется в наклоне кривой титрования до ТЭ. После ТЭ электрическая проводимость раствора будет во всех случаях расти, так как увеличивается концентрация ионов в растворе (рис. 14).
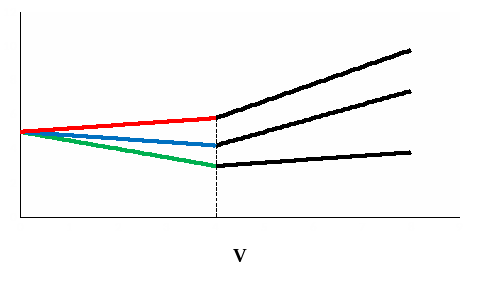
Рис. 14. Кривые кондуктометрического титрования по методу осаждения
Кондуктометрическое титрование по методу осаждения не лишено и обычных ошибок титрования, характерных для метода осаждения – ошибок за счет соосаждения или адсорбции, за счет немгновенной скорости установления равновесия между осадком и раствором и т.д.
