
- •Семинар № 6 «Кондуктометрические методы анализа»
- •Кондуктометрия: сущность и классификация
- •Электрическая проводимость растворов
- •Ячейка для прямых кондуктометрических измерений
- •Метод прямой кондуктометрии
- •Метод кондуктометрического титрования
- •Кислотно-основное кондуктометрическое титрование Титрование сильной кислоты сильным основанием
- •Титрование слабой кислоты сильным основанием
- •Титрование смеси веществ
- •Осадительное кондуктометрическое титрование
- •Комплексонометрическое кондуктометрическое титрование
- •Окислительно-восстановительное кондуктометрическое титрование
- •Хронокондуктометрическое титрование
- •Высокочастотное титрование
- •Ячейка для проведения кондуктометрического титрования
- •Общая характеристика, достоинства и практическое применение кондуктометрического метода анализа
Кислотно-основное кондуктометрическое титрование Титрование сильной кислоты сильным основанием
Для примера рассмотрим кондуктометрическое титрование раствора сильной кислоты (HCl) раствором сильного основания (NaOH). При таком титровании протекает химическая реакция
H+ + Cl- + (Na+ + OH-) = Na+ + Cl- + (H2O)
и в растворе в любой момент титрования присутствуют ионы Н+, Cl-, Na+, OH-, а электрическая проводимость раствора будет определяться их концентрациями и подвижностями.
На рисунке 6 приведена схема, отражающая изменение качественный характер изменения концентрации ионов при титровании, необходимая для уяснения хода кривой кондуктометрического титрования.

Рис. 6. Изменение концентрации ионов при титровании раствора HCl раствором NaOH
Концентрация хлорид-ионов в процессе титрования практически изменяться не будет, а концентрация ионов натрия будет монотонно возрастать. Концентрация ионов водорода будет уменьшаться от исходной величины (С0) практически до нуля в ТЭ, а концентрация гидроксид-ионов, практически равная нулю в точке эквивалентности, после ТЭ будет возрастать. Таким образом, изменение электрической проводимости до ТЭ будет определяться действием двух взаимно противоположных тенденций: понижающей за счет уменьшения концентрации ионов водорода и возрастающей за счет увеличения концентрации ионов натрия. Результирующая этих вкладов АВ (рис. 7) показывает резкое уменьшение электрической проводимости до ТЭ. Падение электропроводности вызывается уменьшением концентрации ионов водорода, имеющих при 250С подвижность 349,8 См·см2/моль эквивалента, что намного (в 7 раз) превышает подвижность иона натрия (50,1 См·см2/моль эквивалента).

Рис. 7. Кривая кондуктометрического титрования раствора HCl раствором NaOH
После ТЭ начинается резкий подъем электрической проводимости (ветвь ВС), так как в растворе будет нарастать концентрация ионов натрия и гидроксид-ионов (подвижность составляет 199,0 См·см2/моль эквивалента). Однако возрастание по ВС будет более пологим, чем уменьшение по АВ (несимметричность ветвей кривой титрования), так как подвижность гидроксид-иона почти в 2 раза меньше подвижности иона водорода.
Точка эквивалентности в кондуктометрическом титровании обычно находится путем графического построения. Как видно из рисунка 7, экспериментальные значения электрической проводимости раствора в непосредственной близости от ТЭ особого значения не имеют. Для построения кривой кондуктометрического титрования используются области недотитрованных и перетитрованных растворов. В некоторых случаях, например при титровании очень разбавленных растворов, обе ветви кривой титрования сглаживаются, и для определения ТЭ приходится использовать более сложные построения.
Титрование слабой кислоты сильным основанием
На рисунке 8 схематично показано изменение концентрации реагирующих частиц при титровании слабой кислоты (CH3COOH) сильным основанием (NaOH).
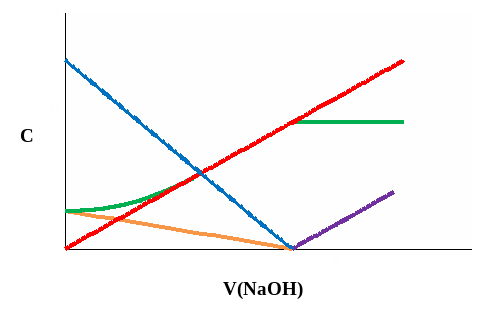
Рис. 8. Изменение концентрации ионов при титровании раствора CH3COOH раствором NaOH
При таком титровании протекает химическая реакция:
(CH3COOH) + Na+ + OH- = CH3COO- + Na+ + (H2O)
Концентрация недиссоциированных молекул уксусной кислоты монотонно падает практически до нуля. Концентрация ацетат-ионов, равная в начале титрования концентрации ионов водорода, в ходе титрования возрастает, а после ТЭ остается практически неизменной. Концентрация ионов водорода падает, а ионов натрия возрастает.
Удельная электрическая проводимость раствора до ТЭ (рис. 9, ветвь АВ) несколько возрастает, так как при титровании происходит увеличение концентрации ионов натрия и ацетат-ионов. Концентрация ионов водорода в растворе слабой уксусной кислоты и ее соли, получившейся при титровании, невелика и уменьшение равновесной концентрации ионов водорода в ходе титрования не вызывает столь резкого падения электрической проводимости раствора, какое наблюдалось при титровании сильной кислоты.
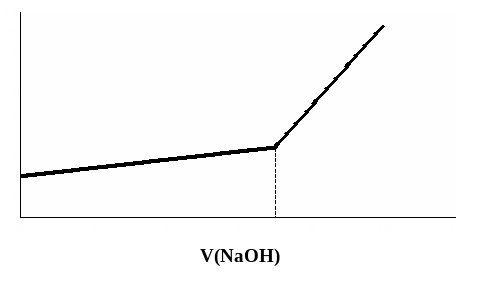
Рис. 9. Кривая кондуктометрического титрования раствора CH3COOH раствором NaOH
При титровании кислот средней силы на кривой АВ может возникнуть минимум электрической проводимости, отражающий суммарный эффект уменьшения концентрации ионов водорода и возрастания концентрации ионов натрия и ацетат-ионов. После ТЭ наблюдается резкий подъем электрической проводимости раствора, вызванный появлением в растворе гидроксид-ионов с высокой подвижностью (рис. 9, кривая ВС).
