
- •Семинар № 6 «Кондуктометрические методы анализа»
- •Кондуктометрия: сущность и классификация
- •Электрическая проводимость растворов
- •Ячейка для прямых кондуктометрических измерений
- •Метод прямой кондуктометрии
- •Метод кондуктометрического титрования
- •Кислотно-основное кондуктометрическое титрование Титрование сильной кислоты сильным основанием
- •Титрование слабой кислоты сильным основанием
- •Титрование смеси веществ
- •Осадительное кондуктометрическое титрование
- •Комплексонометрическое кондуктометрическое титрование
- •Окислительно-восстановительное кондуктометрическое титрование
- •Хронокондуктометрическое титрование
- •Высокочастотное титрование
- •Ячейка для проведения кондуктометрического титрования
- •Общая характеристика, достоинства и практическое применение кондуктометрического метода анализа
Семинар № 6 «Кондуктометрические методы анализа»
ПЛАН
1. Кондуктометрия: сущность и классификация 1
2. Электрическая проводимость растворов 2
3. Схема ячейки для кондуктометрических измерений. Кондуктометры 8
4. Метод прямой кондуктометрии 12
5. Метод кондуктометрического титрования 12
5.1. Кислотно-основное кондуктометрическое титрование 13
5.2. Осадительное кондуктометрическое титрование 18
5.3. Комплексонометрическое кондуктометрическое титрование 20
5.4. Окислительно-восстановительное кондуктометрическое титрование 22
6. Хронокондуктометрическое титрование 23
7. Высокочастотное титрование 23
8. Ячейка для проведения кондуктометрического титрования 24
9. Общая характеристика, достоинства и практическое применение кондуктометрического метода анализа 25
Кондуктометрия: сущность и классификация
Кондуктометрический метод анализа основан на измерении удельной электропроводности анализируемого раствора.
Различают прямую кондуктометрию и косвенную кондуктометрию (кондуктометрическое титрование). Методы прямой кондуктометрии основаны на том, что электрическая проводимость растворов растет с увеличением концентрации электролита, а в методах кондуктометрического титрования измеряют электрическую проводимость раствора после добавления небольших определенных порций раствора титранта. Кроме того, выделяют хронокондуктометрическое титрование (когда раствор титранта подается в анализируемый раствор непрерывно или небольшими одинаковыми порциями через определенные промежутки времени) и высокочастотное титрование. По типу реакции, протекающей при кондуктометрическом титровании, различают: 1) кислотно-основное, 2) осадительное, 3) комплексонометрическое и 4) окислительно-восстановительное кондуктометрическое титрование.
Электрическая проводимость растворов
Электрической проводимостью называют способность вещества проводить электрический ток под действием внешнего электрического поля. Ее единицей измерения является Ом-1 или сименс (См).
Перенос электричества в проводниках первого рода – металлах – осуществляется движением электронов по проводнику в направлении от отрицательного поля к положительному. В проводниках второго рода – растворах электролитов – перенос электричества осуществляется движением ионов. Анионы движутся к аноду, а катионы – к катоду.
Закон Ома остается справедливым и для растворов электролитов:
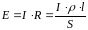 ,
,
где Е – разность потенциалов между электродами, В; I – сила тока, А; R – сопротивление, Ом; ρ – удельное сопротивление, Ом·см; l – расстояние между электродами, см; S – сечение (площадь поверхности), см2.
Величина, обратная
удельному сопротивлению электролита,
называется удельной
электрической проводимостью
(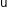 ):
):
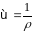
Удельная электрическая проводимость равна электрической проводимости 1 см3 раствора, находящегося между параллельными электродами площадью 1 см2 при расстоянии между ними 1 см, или, другими словами, – это электрическая проводимость столба раствора длиной 1 см и площадью поперечного сечения 1 см2. Она численно равна току (в А), проходящему через слой раствора с поперечным сечением, равным 1, под действием градиента потенциала 1 В на единицу длины. Ее единицей измерения является См/см.
Электропроводность разбавленных растворов электролитов зависит от числа ионов в растворе (то есть от концентрации), числа элементарных зарядов, переносимых каждым ионом (то есть от заряда иона), и от скорости движения одинаково заряженных ионов к катоду или аноду под действием электрического поля.
В разбавленных растворах удельная электрическая проводимость обычно растет с увеличением концентрации электролита, при некоторой достаточно высокой концентрации достигает максимума и затем уменьшается (рис. 1).
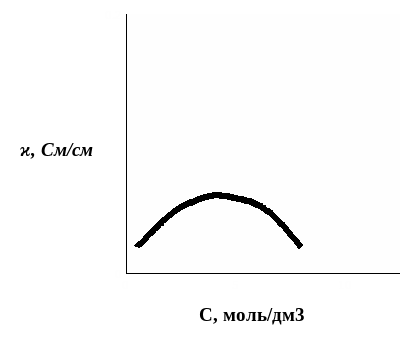

Рис. 1. Зависимость удельной электрической проводимости от концентрации раствора:
1 – раствор сильного электролита (например, HCl);
2 – раствор слабого электролита (например, CH3COOH)
Электрическая проводимость слабого электролита значительно ниже соответствующей величины для раствора сильного электролита. Возрастание электрической проводимости с ростом концентрации в растворах умеренно высоких концентраций происходит вследствие увеличения числа ионов с увеличением концентрации. Однако в концентрированных растворах возникают и другие эффекты, приводящие уже к уменьшению электрической проводимости. В концентрированных растворах возрастают силы межионного взаимодействия, вследствие чего происходит образование межионных ассоциатов или ионных пар, увеличивая вязкость раствора, и проявляются другие эффекты, снижающие скорость движения ионов и вызывающие уменьшение электрической проводимости. Как суммарный результат действия этих факторов, на кривой электрической проводимости возникает максимум. Для аналитических измерений обычно используется участок кривой с возрастающей удельной электрической проводимостью, то есть область разбавленных и умеренно концентрированных растворов.
Эквивалентной электрической проводимостью (λ) (подвижностью) называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Она равна произведению абсолютной скорости движения иона на константу Фарадея и имеет размерность См·см2/моль эквивалента. Очевидно, что площадь электродов такова, что между ними помещается раствор, содержащий 1 моль эквивалента вещества. Под эквивалентом здесь подразумевается частица с единичным зарядом, например, К+, Cl-, 1/2Mg2+, 1/3Al3+ и т.д.
Удельная и эквивалентная электрические проводимости связаны друг с другом соотношением:
 ,
,
где С – молярная концентрация эквивалента раствора, н.
В области сравнительно невысоких концентраций эквивалентная электрическая проводимость растворов электролитов обычно возрастает с уменьшением концентрации раствора и повышением температуры (рис. 2).

Рис. 2. Зависимость эквивалентной электрической проводимости от концентрации раствора:
1 – раствор сильного электролита;
2 – раствор слабого электролита
У полностью диссоциированных (так называемых сильных) электролитов в области разбавленных растворов (0,001 М и меньше) концентрационная зависимость проводимости выражается уравнением:
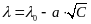 ,
,
где λ0 – предельная эквивалентная электрическая проводимость сильного электролита при бесконечном разбавлении, а – константа. Эта зависимость представлена на рисунке 2 (прямая 1).
С уменьшением концентрации электролита эквивалентная электрическая проводимость возрастает и в области бесконечно больших разбавлений стремится к предельному значению λ0, характеризующему электрическую проводимость гипотетического бесконечно разбавленного раствора.
Константа а данного уравнения нашла истолкование в теории Дебая-Хюккеля, развитая Онзагером. Уменьшение эквивалентной электрической проводимости теория Дебая-Онзагера объясняет эффектами электрофоретического и релаксационного торможения. Оба эффекта связаны с существованием вокруг иона ионной атмосферы из противоположно заряженных ионов. Электрофоретический эффект вызывается тем, что центральный ион под действием электрического поля движется в одном направлении, а ионная атмосфера, имеющая противоположный заряд, – в противоположном и тормозит движение иона. Релаксационное торможение обусловлено процессами разрушения и формирования ионной атмосферы при движении иона.
Концентрационная зависимость эквивалентной электрической проводимости в этой теории подчиняется уравнению:
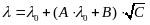 ,
,
где А – коэффициент, характеризующий электрофоретический эффект, а В – релаксационный. Величины А и В определяющиеся температурой, вязкостью и диэлектрической проницаемостью растворителя и вычисляющиеся теоретически.
Предельная эквивалентная электрическая проводимость λ0 может быть представлена суммой предельных электрических проводимостей, или предельных подвижностей ионов:
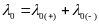 ,
,
где
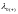 и
и
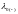 – предельные эквивалентные электрические
проводимости, или предельные подвижности
соответственно катиона и аниона.
– предельные эквивалентные электрические
проводимости, или предельные подвижности
соответственно катиона и аниона.
Данное уравнение выражает закон аддитивности электрической проводимости растворов электролитов при бесконечном разбавлении, установленный Ф. Кольраушем в 1879 г. еще до появления теории электролитической диссоциации. Также его называют законом независимого движения ионов.
Числовые значения
подвижностей ионов находятся в пределах
от 30 до 70 См·см2/моль
эквивалента и лишь у ионов Н+
и ОН-
они существенно превышают таковые
(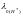 =350
См·см2/моль
эквивалента, а
=350
См·см2/моль
эквивалента, а
 =199
См·см2/моль
эквивалента), что связано с особым
(эстафетным) механизмом перемещения
этих ионов в электрическом поле, сущность
которого заключается в следующем.
=199
См·см2/моль
эквивалента), что связано с особым
(эстафетным) механизмом перемещения
этих ионов в электрическом поле, сущность
которого заключается в следующем.
Ион водорода Н+ в растворе находится в виде иона гидроксония Н3О+, который обменивается протонами с соседними молекулами воды. При наложении электрического поля переход протона от иона гидроксония к молекуле воды будет проходить преимущественно в направлении поля, как это можно представить схемой:
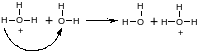
Наряду с обычной миграцией ионов гидроксония, как и других ионов, электричество будет переноситься протонами по эстафетному механизму, что и приводит к более высокой подвижности ионов гидроксония по сравнению с подвижностью других ионов. Аналогичным образом объясняется высокая подвижность гидроксид-ионов. Интересно отметить, что в ацетоне, нитробензоле и других растворителях, не содержащих гидроксид-ионов, подвижность ионов водорода примерно такая же, что и у других однозарядных ионов.
В таблице 1 приведены величины предельных подвижностей ионов при 250С.
Таблица 1
Эквивалентная электропроводность ионов при бесконечном разбавлении и 250С, См·см2/моль эквивалента
Катион |
|
Анион |
|
H+ |
349,8 |
OH- |
199,0 |
K+ |
73,5 |
1/2SO42- |
80,0 |
NH4+ |
73,5 |
Br- |
78,1 |
1/2Pb2+ |
69,5 |
I- |
76,8 |
1/3Fe3+ |
68,0 |
Cl- |
76,4 |
1/2Ba2+ |
63,9 |
NO3- |
71,4 |
Ag+ |
61,9 |
1/2CO32- |
69,8 |
1/2Ca2+ |
59,5 |
ClO4- |
67,3 |
Na+ |
50,1 |
HCO3- |
44,5 |
Концентрационная зависимость электрической проводимости слабых электролитов имеет более сложный характер, чем у сильных электролитов (рис. 2 – кривая 2). Это объясняется тем, что на электрическую проводимость слабых электролитов влияют не только электрофоретический и релаксационный эффекты, как это наблюдается у сильных электролитов, но и увеличение степени диссоциации электролита с разбавлением раствора, вызывающее в области разбавленных растворов более быстрое, чем у сильных электролитов, увеличение электрической проводимости. Данные по электрической проводимости растворов слабых электролитов часто используют для расчета констант диссоциации.
Электрическая проводимость неводных растворов имеет ряд особенностей. Существенное влияние на электрическую проводимость оказывает диэлектрическая проницаемость растворителя (ε). Концентрационная зависимость электрической проводимости в растворах с высокой диэлектрической проницаемостью аналогична соответствующей для водных растворов. На кривой электрической проводимости растворов с малой диэлектрической проницаемостью растворителя – хинолине, пиридине и т.д. – образуются минимумы и максимумы, что объясняется, главным образом, сложным характером взаимодействия ионов с растворителем и между собой. Одним из наиболее широко применяемых неводных растворителей в аналитической химии является диоксан, имеющий низкую диэлектрическую проницаемость (~ 2) и смешивающийся с водой в любых соотношениях.
Электрическая проводимость растворов увеличивается при повышении температуры, поэтому измерения рекомендуется проводить в термостатированной ячейке. В водных растворах повышение составляет 2-2,5 % (Васильев) или 1-2 % (Золотов) на один градус. Температурную зависимость предельной подвижности ионов часто выражают уравнением:
 ,
,
где α – эмпирический коэффициент, зависящий от природы ионов и растворителя.
Схема ячейки для кондуктометрических измерений. Кондуктометры
Принципиальная схема для проведения кондуктометрических измерений представлена на рисунке 3. Это обычный мостик Уитстона, питаемый переменным током от генератора 2.

Рис. 3. Мост Уитстона:
1 – индикатор тока, 2 – источник переменного тока
Постоянный ток нежелателен, так как вызывает электролиз раствора. В то же время применение моста переменного тока приводит к появлению так называемого реактивного сопротивления вследствие конченой величины емкости измерительной ячейки Rx в цепи, что особенно заметно при работе с растворами, имеющими большое сопротивление. По этой причине, кстати, нельзя свести к нулю силу тока в диагонали моста гв. Сопротивление Rм известно (магазин сопротивлений). Положение передвижного контакта в подбирается таким образом, чтобы нуль-инструмент 1 не показывал ток (или ток был минимальным). Тогда сопротивление ячейки Rx можно рассчитать. Для питания моста обычно используется ток частотой примерно 1000 Гц, вырабатываемый звуковыми генераторами. В качестве эталонного сопротивления включают магазины сопротивлений. Нуль-инструментом может быть телефон, гальванометр или осциллограф.
В настоящее время промышленность выпускает комплектные приборы для определения электрической проводимости растворов – мосты переменного тока и кондуктометры. Наиболее известные из выпускаемых лабораторных кондуктометров: «АНИОН», «МАРК», «ЭКСПЕРТ» (Россия), «ЕС» фирмы HANNA и кондуктометры «inoLab Cond» фирмы WTW (Германия), кондуктометры фирмы Mettler Toledo (Швейцария), а также различные портативные кондуктометры.
Конструкции измерительных ячеек весьма разнообразны. В методе прямой кондуктометрии применяют обычно ячейки с жестко закрепленными в них электродами (рис. 4), а в методах кондуктометрического титрования наряду с ячейками этого типа могут быть использованы так называемые погружные электроды (рис. 5), позволяющие проводить титрование в любых сосудах, в которых можно разместить электроды.
