- •Періодичної системи елементів. Частина 1. Нітроген Методичні вказівки та інструкція
- •6.051301 „Хімічна технологія”,
- •6.051701 „Харчова технологія та інженерія”
- •1. Теоретичний вступ
- •Загальна характеристика р-елементів y групи
- •1.2. Поширення Нітрогену у природі, одержання та властивості азоту
- •1.3. Сполуки Нітрогену з від’ємними ступенями окиснення
- •1.4. Сполуки Нітрогену з позитивними ступенями окиснення
- •2. Правила техніки безпеки
- •3. Лабораторні досліди
- •8. Виявлення іонів амонію.
- •10. Гідроліз солей амонію.
- •11. Термічна дисоціація амонію хлориду.
- •12. Відновні властивості аміаку.
- •13. Добування нітрогену (іі) оксиду.
- •14. Окисні властивості нітрит-іону.
- •15. Окисні властивості нітратної кислоти та її солей.
- •16. Термічне розкладання натрію нітрату.
- •17. Горіння речовин у розплавленому натрію нітраті.
- •18. Термічне розкладання нітратів плюмбуму і купруму.
- •4. Науково-дослідна робота
- •5. Запитання для самоконтролю
- •6. Вимоги до звіту
- •7. Список літератури
- •Періодичної системи елементів. Частина 1. Нітроген Методичні вказівки та інструкція
- •6.051301 „Хімічна технологія”,
- •6.051701 „Харчова технологія та інженерія”
16. Термічне розкладання натрію нітрату.
У суху пробірку насипте 1 г натрію нітрату. Закріпіть пробірку в штативі і прожарюйте над полум'ям пальника. Тліючою скибкою підтвердіть виділення кисню. Після припинення виділення газу, пробірку охолодіть. Добуту сіль розчиніть у воді. До розчину додайте декілька крапель калію йодиду, 4 мл розбавленого розчину ацетатної кислоти та 2 мл розчину крохмалю. Напишіть результати спостережень та відповідні рівняння реакцій.
17. Горіння речовин у розплавленому натрію нітраті.
(Дослід проводити у витяжній шафі !)
У пробірку з термостійкого скла насипте 5 г натрію нітрату. Пробірку закріпіть вертикально у штативі. Знизу під нею помістіть азбестову пластинку або поставте чашку з піском. Пробірку повільно нагрійте до повного розтоплення солі. Після цього у розтоп внесіть тліючу вуглинку, а коли вона займеться - дрібку сірки. Напишіть результати спостережень та рівняння реакцій.
18. Термічне розкладання нітратів плюмбуму і купруму.
(Дослід проводити у витяжній шафі !)
У суху пробірку помістіть декілька кристаликів плюмбуму (ІІ) нітрату і прожарюйте над полум'ям пальника. Спостерігайте за зміною кристаликів солі, забарвленням газу, що виділяється, і спалахуванням внесеної в пробірку тліючої скибки.
Аналогічно розкладіть сіль купруму (ІІ) нітрату і спостерігайте за змінами, які відбуваються в пробірці. Напишіть рівняння відповідних реакцій.
4. Науково-дослідна робота
Горіння аміаку в атмосфері кисню.
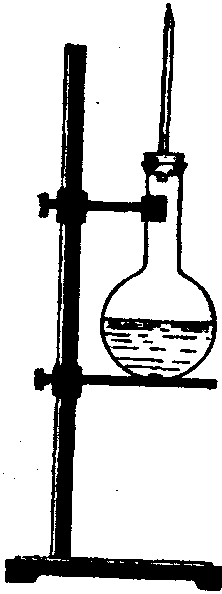
Для проведення досліду складіть прилад, зображений на рис 1. На кільце штатива покладіть азбестову пластинку, поставте на неї круглодонну колбу місткістю 250 мл і закріпіть її у штативі. Колбу до половини заповніть концентрованим розчином аміаку. Закрийте її корком з прямою газовідвідною трубкою завдовжки 10 см, що закінчується коротким капіляром. Потім відріжте шматочок скляної трубки діаметром близько 4 мм і 8 см завдовжки. До цієї трубки підберіть корок потрібного розміру, в якому просверліть отвори: один у центрі розміром, що дорівнює діаметру га- |
Рис.2. Прилад для дослідження горіння аміаку в кисні. |
зовідвідної трубки, а другий - збоку від першого, в який вставте зігнуту під прямим кутом скляну трубку. З'єднайте цю трубку гумовим шлангом з газометром, заповненим киснем. Скляну трубку щільно вставте у бічний отвір корка, а газовідвідну - у центральний отвір на таку висоту, щоб капіляр був нижче від верху широкої трубки на 2 см (на рис.1 не показано). Розчин у колбі повільно нагрівайте. Коли він почне кипіти, аміак, що виділяється, спробуйте запалити спочатку без кисню, а потім під час пропускання кисню.
5. Запитання для самоконтролю
1. Як змінюються кислотно-основні і окисно-відновні властивості сполук Нітрогену при зміні його ступеня окиснення від -3 до +5.
2. Напишіть рівняння реакцій одержання: аміаку, гідразину, гідроксиламіну, азидної кислоти.
3. Напишіть формули найважливіших оксигеновмісних сполук Нітрогену, назвіть їх і охарактеризуйте хімічні властивості.
4. Напишіть рівняння реакцій взаємодії концентрованого, розбавленого і дуже розбавленого розчинів нітратної кислоти з магнієм, цинком, міддю.
5. Скільки потрібно взяти 60%-го розчину амонію хлориду і 40%-го розчину кальцію гідроксиду, щоб добути 2 кг 10 %-го розчину аміаку?
6. Які сполуки і чому застосовують як нітрогеновмісні добрива в сільському господарстві?
7. Під час взаємодії концентрованої нітратної кислоти з металами, сіркою, вуглецем утворюється тільки нітрогену (ІІ) оксид, а не інші оксиди нітрогену. Чим це пояснюють?