
- •Періодичної системи елементів. Частина 1. Нітроген Методичні вказівки та інструкція
- •6.051301 „Хімічна технологія”,
- •6.051701 „Харчова технологія та інженерія”
- •1. Теоретичний вступ
- •Загальна характеристика р-елементів y групи
- •1.2. Поширення Нітрогену у природі, одержання та властивості азоту
- •1.3. Сполуки Нітрогену з від’ємними ступенями окиснення
- •1.4. Сполуки Нітрогену з позитивними ступенями окиснення
- •2. Правила техніки безпеки
- •3. Лабораторні досліди
- •8. Виявлення іонів амонію.
- •10. Гідроліз солей амонію.
- •11. Термічна дисоціація амонію хлориду.
- •12. Відновні властивості аміаку.
- •13. Добування нітрогену (іі) оксиду.
- •14. Окисні властивості нітрит-іону.
- •15. Окисні властивості нітратної кислоти та її солей.
- •16. Термічне розкладання натрію нітрату.
- •17. Горіння речовин у розплавленому натрію нітраті.
- •18. Термічне розкладання нітратів плюмбуму і купруму.
- •4. Науково-дослідна робота
- •5. Запитання для самоконтролю
- •6. Вимоги до звіту
- •7. Список літератури
- •Періодичної системи елементів. Частина 1. Нітроген Методичні вказівки та інструкція
- •6.051301 „Хімічна технологія”,
- •6.051701 „Харчова технологія та інженерія”
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ „ЛЬВІВСЬКА ПОЛІТЕХНІКА”
р – ЕЛЕМЕНТИ V групи
Періодичної системи елементів. Частина 1. Нітроген Методичні вказівки та інструкція
до лабораторної роботи з курсу
„Загальна та неорганічна хімія”
для студентів базових напрямків
6.051301 „Хімічна технологія”,
6.051701 „Харчова технологія та інженерія”
Затверджено
на засіданні кафедри
хімії і технології
неорганічних речовин.
Протокол №17 від 24.05.2007 р.
Львів – 2007
р – Елементи V групи періодичної системи елементів. Частина 1. Нітроген: Методичні вказівки та інструкція до лабораторної роботи з курсу „Загальна та неорганічна хімія” для студентів базових напрямків 6.051301 „Хімічна технологія”, 6.051701 „Харчова технологія та інженерія” / Укл.: В.Т.Яворський, Р.Р.Оленич, Г.І.Зозуля, Р.Л.Буклів. – Львів: Видавництво Національного університету “Львівська політехніка”, 2007.– 20 с.
Укладачі Яворський В.Т., д-р техн. наук, проф.,
Оленич Р.Р., канд. хім. наук, доц.,
Зозуля Г.І., канд. техн. наук, доц.
Буклів Р.Л., канд. техн. наук, доц.
Відповідальний за випуск Яворський В.Т., д-р техн. наук, проф.
Рецензент Калимон Я.А., д-р техн. наук, проф.
Мета роботи - ознайомлення студентів з властивостями p-елементів Y групи та найважливіших сполук Нітрогену. Під час виконання лабораторного практикуму студенти вивчають основні способи одержання азоту та сполук Нітрогену, а також їх фізичні та хімічні властивості.
1. Теоретичний вступ
Загальна характеристика р-елементів y групи
До р-елементів Y групи належать: N (Нітроген), Р (Фосфор), As (Арсен), Sb (Стибій) і Bi (Бісмут).
Атоми цих елементів на зовнішньому енергетичному рівні мають по 5 електронів (електронна конфігурація зовнішніх енергетичних рівнів атомів - ns2nр3), які в нормальному стані розміщені на енергетичних підрівнях так:
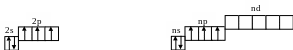
N P,As,Sb,Bi
В нормальному стані р-елементи Y групи мають валентність 3. У атома елемента другого періоду (Нітрогену) відсутній d-підрівень, тому, на відміну від інших р-елементів Y групи, Нітроген не може мати валентність 5. Для Фосфору, Арсену, Стибію і Бісмуту, завдяки наявності зовнішніх d-орбіталей, можливе розпарування s-електронів, тому число неспарених електронів може збільшуватися до п’яти.
Можливі ступені окиснення р-елементів Y групи наведені в табл.1.
Таблиця 1
Елемент |
Ступені окиснення* |
N P As Sb Bi |
-3 -2 -1 0 +1 +2 +3 +4 +5 -3 (-2) 0 +1 +3 (+4) +5 -3 0 +3 +5 (-3) 0 +3 +5 - 0 +3 (+5) |
*Характерні ступені окиснення елементів підкреслено, нехарактерні взято в дужки
Здатність до утворення сполук зі ступенем окиснення +5 від Нітрогену до Бісмуту послаблюється, стабілізується нижчий позитивний ступінь окиснення +3. Для Бісмуту ступінь окиснення +5 є нехарактерним внаслідок підвищеної стійкості 6s2-електронної конфігурації за рахунок збільшення енергетичної різниці s- і p-підрівнів. Стійкість сполук з мінімальним ступенем окиснення -3 також зменшується від Нітрогену до Бісмуту. Для Бісмуту мінімальний ступінь окиснення – 0, оскільки бісмут – метал.
В табл.2 наведено деякі властивості р-елементів Y групи та простих речовин.
Таблиця 2
Елемент |
Валентні електрони |
Радіус атома, нм |
Енергія іонізації, еВ |
Відносна електро-негатив-ність |
Темпера-тура топ- лення,0С |
N P As Sb Bi |
2s22p3 3s23p33d0 4s24p34d0 5s25p35d0 6s26p36d0 |
0,071 0,130 0,148 0,161 0,182 |
14,53 10,48 9,81 8,64 7,30 |
3,1 2,2 2,1 1,8 1,7 |
-210 +44 сублімація +630 +271 |
Зі збільшенням протонного числа від Нітрогену до Бісмуту значно та закономірно зростають радіуси атомів, зменшуються значення енергії іонізації та електронегативності, тому неметалічні властивості послаблюються від азоту до стибію. Азот і фосфор – типові неметали. Металічні властивості починають виявлятися в арсену, стибій приблизно однаковою мірою виявляє як металічні, так і неметалічні властивості. Бісмут виявляє металічні властивості.
Властивості азоту та сполук Нітрогену виявляють ряд індивідуальних особливостей, тому надалі розглядатимуться окремо.
