
- •Метод кислотно-основного титрования.
- •Как готовят рабочий раствор?
- •Стандартизация рабочих растворов
- •Методы фиксации точки эквивалентности
- •Индикаторы. Интервал перехода. Выбор индикатора. Pt
- •Выбор индикатора
- •Б) Титрование слабой кислоты сильным основанием.
- •Классификация кислотно-основных индикаторов.
5. Метод кислотно-основного титрования. Рабочие и стандартные растворы, требования к ним. Стандартизация рабочих растворов. Методы фиксации точки эквивалентности. Индикаторы. Интервал перехода окраски индикатора. Показатель титрования индикатора. Выбор индикатора. Кривые титрования. Определение хлороводородной и фосфорной кислот.
Метод кислотно-основного титрования.
В основе данного метода лежит реакция нейтрализации.
Н+ + ОН-=Н2О
Нужно учитывать существование свободного протона в веществе. Этим методом определяют кислоты, основания, некоторые гидролизующиеся соли. В качестве титрантов используют растворы сильных кислот и сильных оснований. Прямым титрованием определяют сильные кислоты, сильные основания, слабые электролиты. Прямое титрование гидролизующихся солей возможно, если они образованы достаточно слабыми кислотами и основаниями. Титрование многоосновных кислот по ступеням возможно, если константы диссоциации для различных ступений различаются менее, чем в 10 000.
РАБОЧИЕ И СТАНДАРТНЫЕ РАСТВОРЫ РАССМОТРЕНЫ В ВОПРОСЕ 3
Как готовят рабочий раствор?
По таблице, зная плотность, находим массовую долю. Вычисляем молярную концентрацию эквивалента раствора:
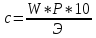
Вычисляем концентрированный объём. В бутыль наливают 0.5 л воды, добавляют нужный объём вещества, доливают до плечиков бутыли дистиллированную воду. Перемешивают.
Стандартизация рабочих растворов
-
При стандартизации раствора сначала пишут уравнение реакции
-
Хлороводородную кислоту стандартизируют карбонатом натрия(стандартным раствором), титруют до угольной кислоты, в качестве индикатора используют метиловый оранжевый. В колбе для титрования 10 мл стандартного раствора карбоната натрия, 20 мл дистиллированной воды, 1 капля метилового оранжевого. В бюретке-хлороводородная кислота. Титруют до появления золотисто-оранжевой окраски. В конце стандартизации находят концентрацию.
-
Гидроксид натрия стандартизируют раствором хлороводородной кислоты. В качестве индикатора используют фенолфталеин. В колбе для титрования 10 мл хлороводородной кислоты стандартизированной и 2 капли фенолфталеина, в бюретке- рабочий раствор гидроксида натрия. Титруют до появления на 30 секунд бледно-розовой окраски. Титруют быстро. Находят молярную концентрацию.
Методы фиксации точки эквивалентности
-
С помощью индикаторов
Это вещества, изменяющие свой цвет вследствие протекания химических процессов. Кислотно-основные индикаторы, например, фенолфталеин, изменяют свой цвет в зависимости от pH раствора, в котором они находятся. Редокс-индикаторы изменяют свой цвет вслед за изменением потенциала системы, используются таким образом при окислительно-восстановительном титровании. Перед началом титрования в исследуемый раствор добавляют несколько капель индикатора и начинают по каплям добавлять титрант. Как только раствор вслед за индикатором изменяет свой цвет, титрование прекращают, этот момент приблизительно и есть точка эквивалентности.
Потенциометрия
В данном случае используют прибор для измерения электродного потенциала раствора. При достижении точки эквивалентности потенциал рабочего электрода резко изменяется.
С помощью pH-метров
pH-метр по сути своей также является потенциметром, в котором используется электрод, потенциал которого зависит от содержания в растворе ионов H+, это пример использования ионоселективного электрода. Таким образом можно следить за изменением pH в течение всего процесса титрования. При достижении точки эквивалентности pH резко изменяется. Данный способ более точный по сравнению с титрованием с использованием кислотно-основных индикаторов, и может быть легко автоматизирован.
Проводимость
Проводимость раствора электролитов зависит от находящихся в нем ионов. Во время титрования проводимость часто значительно изменяется (Например, при кислотно-основном титровании, ионы H+ и OH− взаимодействуют, образуя нейтральную молекулу H2O, что вызывает изменение проводимости раствора). Общая проводимость раствора зависит и от других присутствующих ионов (например, противоинов), которые вносят в неё различный вклад. Он, в свою очередь, зависит отподвижности каждого иона и от общей концентрации ионов (ионной силы). В связи с этим предсказать изменение проводимости гораздо сложнее, нежели измерить её.
Изменение цвета
При протекании некоторых реакций происходит изменение цвета и без добавления индикатора. Чаще всего это наблюдается при окислительно-восстановительном титровании, когда исходные вещества и продукты реакции имеют разные цвета в разных степенях окисления.
Осаждение
Классическим примером такой реакции является образование крайне нерастворимого хлористого серебра AgCl из ионов Ag+ и Cl−. Удивительно, но это не позволяет точно определить момент окончания титрования, поэтому осадительное титрование чаще всего используют в качестве обратного титрования.
Изотермическое калориметрическое титрование
Используется изотермический титровальный калориметр, который по величине тепла, которое выделила или поглотила реагирующая система, определяет точку эквивалентности. Данный способ важен в биохимическом титровании, например, для определения того, как ферментный субстрат связывается с ферментом.
Термометрическая титриметрия
Термометрическая титриметрия — чрезвычайно гибкая техника. Она отличается от калориметрической титриметрии тем, что теплота реакции, о которой свидетельствует падение или рост температуры, не используется для определения количества содержащегося в исследуемом образце раствора вещества. Напротив, точка эквивалентности определяется на основе области, в которой происходит изменение температуры. В зависимости от того, является реакция между титрантом и исследуемым веществом экзотермической или эндотермической, температура в течение процесса титрования будет, соответственно, возрастать или падать. Когда все исследуемое вещество прореагировало с титрантом, изменение области, в которой происходит рост или падение температуры, позволяет определить точку эквивалентности и изгиб на кривой температуры. Точно точку эквивалентности можно определить, взяв вторую производную кривой температуры: четкий пик будет указывать на точку эквивалентности.
Спектроскопия
Точку эквивалентности можно определить, измеряя абсорбцию света раствором во время титровании, если известен спектр продукта, титранта или исследуемого вещества. Относительное содержание продукта реакции и исследуемого вещества позволяют определить точку эквивалентности. При этом присутствие свободного титранта (указывающее на завершение реакции) можно обнаружить при очень малых величинах.
Амперометрия
Метод, позволяющий определить точку эквивалентности по величине тока при заданном потенциале. Величина тока вследствие реакции окисления/восстановления исследуемого вещества или продукта у рабочего электрода зависит от их концентрации в растворе. Точке эквивалентности соответствует изменение величины тока. Данный метод наиболее полезен, когда необходимо уменьшить расход титранта, например, при титровании галидов ионом Ag+.
Когда точка эквивалентности совпадает с точкой нейтральности?
В основе кислотно-основного титрования лежит реакция нейтрализации между кислотой и основанием. В результате реакции нейтрализации образуется соль и вода. Реакция нейтрализации протекает при комнатной температуре практически мгновенно. Кислотно-основное титрование применяется для определения кислот, оснований, а также многих солей слабых кислот: карбонатов, боратов, сульфитов, и т. д. При помощи данного метода можно титровать смеси различных кислот или оснований, определяя содержание каждого компонента в отдельности. При титровании кислоты основанием или наоборот, происходит постепенное изменение кислотности среды, которое выражается водородным показателем рН. Вода представляет собой слабый электролит, который диссоциирует согласно уравнению. Н2О Н+ + ОН- Произведение концентрации ионов водорода на концентрацию ионов гидроксила есть величина постоянная, и называется ионное произведение воды. (1) В нейтральной среде концентрации водородных ионов и гидроксид-ионов равны и составляют 10-7м/л. Ионное произведение воды остаётся постоянным при добавлении в воду кислоты или основания. При добавлении кислоты увеличивается концентрация ионов водорода, что приводит к сдвигу равновесия диссоциации воды влево, в результате чего концентрация гидроксид-ионов уменьшается. Например, если
[H+] = 10-3м. /л. , то [OH-] = 10-11 м. /л. Ионное произведение воды останется постоянным. 10-3 10-11 = 10-14. Если увеличить концентрацию щёлочи, то концентрация гидроксид-ионов увеличится, а концентрация ионов водорода уменьшится, ионное произведение воды также останется постоянным. Например, [OH-] = 10-2, [H+] = 10-12 10-12 10-2 = 10-14. Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода. рН = - lg [H+]. (2) Исходя из уравнения (1) можно заключить, что в нейтральной среде рН = 7. pН = - lg 10-7 = 7. В кислой среде рН < 7, в щелочной рН > 7. Аналогично выводится формула для рОН из уравнения (1). pОН = - lg [OH-] = 14 – pH. (3) В ходе кислотно-основного титования с каждой порцией приливаемого титранта изменяется рН раствора. В точке эквивалентности рН достигает определённого значения. В этот момент времени титрование необходимо прекратить и измерить объём титранта, пошедший на титрование. Для определения рН в точке эквивалентности строят кривую титрования – график зависимости рН раствора от объёма прибавляемого титранта. Кривую титрования можно построить экспериментально, измеряя рН в различные моменты титрования, или рассчитать теоретически, используя формулы (2) или (3).
