
- •Состояние ионов в растворе. Концентрации: общая и равновесная. Активность, коэффициент активности. Ионная сила раствора. Константы равновесия. Факторы, влияющие на равновесие.
- •Состояние ионов в растворе.
- •Концентрация: общая и равновесная
- •Активность, коэффициент активности
- •Ионная сила раствора
- •Константа равновесия
- •Факторы, влияющие на равновесие.
-
Ионная сила раствора
Коэффициент активности ионов зависит не только от концентрации данного электролита в растворе, но и от концентрации посторонних ионов, присутствующих в этом растворе. Мерой электрического взаимодействия между всеми ионами в растворе является так называемая ионная сила, величина которой зависит от концентрации и зарядов всех ионов, присутствующих в растворе.
Ионная сила раствора равна полусумме произведений концентраций ионов на квадраты их зарядов:

С увеличением ионной силы раствора коэффициент активности уменьшается. Однако, достигнув определенного минимального значения, коэффициент активности при дальнейшем увеличении ионной силы возрастает.
-
Константа равновесия
Константа равновесия, выражается через активности реагирующих частиц
 ,
(1)
,
(1)
называется термодинамической константой равновесия. Как для идеальных, так и для неидеальных систем она зависит только от температуры, давления и природы растворителя. При постоянных температуре и давлении константа равновесия сохраняет постоянство и не зависит от концентрации участников реакции. Активность связана с концентрацией вещесва (с) соотношением


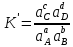
Эти велечины называются концентрационными (стехиометрическими) константами равновесия. При этом величина К называется реальной, а К` - условной константой равновесия.
Для реальных систем, в которых имеют место как электрические, так и химические взаимодействия, значения концентрационных констант зависят от многих факторов.
Значение
К зависит от температуры, давления и
природы растворителя (влияют на величину
 ),
а также от ионной силы раствора (влияет
на величины
),
а также от ионной силы раствора (влияет
на величины
 ,
а
,
а
 ,
кроме того – и от глубины протекания
конкурирующих реакций (влияет на величины
,
кроме того – и от глубины протекания
конкурирующих реакций (влияет на величины
 ).
Таким образом, реальные константы
характеризуют положение равновесия с
учетом влияния электростатических
взаимодействий, а условные константы
– с учетом суммарного влияния
электростатических и химических
взаимодействий. Из всех трех типов
констант равновесия термодинамические
константы
).
Таким образом, реальные константы
характеризуют положение равновесия с
учетом влияния электростатических
взаимодействий, а условные константы
– с учетом суммарного влияния
электростатических и химических
взаимодействий. Из всех трех типов
констант равновесия термодинамические
константы
 зависят от наименьшего
числа факторов и, следовательно, являются
наиболее фкндаментальными характеристиками
равновесия. Поэтому именно термодинамические
константы чаще всего приводятся в
справочниках. Однако для химика-аналитика
наибольшее значение имеют как раз
концентрационные константы, поскольку
именно они определяют поведение реальных
химических систем в тех или иных условиях.
Концентрационные константы можно
вычислить из термодинамических по
формулам, предварительно рассчитав все
необходимые величины коэффициентов
зависят от наименьшего
числа факторов и, следовательно, являются
наиболее фкндаментальными характеристиками
равновесия. Поэтому именно термодинамические
константы чаще всего приводятся в
справочниках. Однако для химика-аналитика
наибольшее значение имеют как раз
концентрационные константы, поскольку
именно они определяют поведение реальных
химических систем в тех или иных условиях.
Концентрационные константы можно
вычислить из термодинамических по
формулам, предварительно рассчитав все
необходимые величины коэффициентов
 и
и
 .
При выполнении таких расчетов необходимо
иметь в виду следующие обстоятельства.
.
При выполнении таких расчетов необходимо
иметь в виду следующие обстоятельства.
-
Если влиянием конкурирующих реакций можно пренебречь, то все
 и
и
 .
Необходим учет только электростатических
взаимодействий (расчет коэффициентов
.
Необходим учет только электростатических
взаимодействий (расчет коэффициентов
 .
. -
Если к тому же можно пренебречь и электростатическими взаимодействиями (например, в очень разбавленных растворах), то и все
 и
и
 .
В этих случаях можно пользоваться
табличными значениями термодинамических
констант.
.
В этих случаях можно пользоваться
табличными значениями термодинамических
констант. -
Влияние электростатических взаимодействий сказывается, как правило, намного слабее, чем химических. Различие в величинах
 и
и
 очень редко когда превышает 1-2 порядка,
в то время как
очень редко когда превышает 1-2 порядка,
в то время как
 могут отличаться от
могут отличаться от
 на 10 и более порядков. Поэтому влиянием
электростатических взаимодействий
часто пренебрегают, полагая
на 10 и более порядков. Поэтому влиянием
электростатических взаимодействий
часто пренебрегают, полагая
 и, ограничиваясь расчетами только
и, ограничиваясь расчетами только
 -коэффициентов
(если это необходимо).
-коэффициентов
(если это необходимо).
Термодинамическая константа равновесия, определяемая уравнением (1), не зависит от концентрации раствора или наличия в нем каких-либо растворенных веществ.
