
- •Состояние ионов в растворе. Концентрации: общая и равновесная. Активность, коэффициент активности. Ионная сила раствора. Константы равновесия. Факторы, влияющие на равновесие.
- •Состояние ионов в растворе.
- •Концентрация: общая и равновесная
- •Активность, коэффициент активности
- •Ионная сила раствора
- •Константа равновесия
- •Факторы, влияющие на равновесие.
-
Активность, коэффициент активности
Коэффицент
активности
 характеризует неидеальность реальных
растворов, т. е. Отклонение свойств
реальных растворов от свойств идеальных.
характеризует неидеальность реальных
растворов, т. е. Отклонение свойств
реальных растворов от свойств идеальных.
Учет электростатических взаимодействий. Коэффициенты активности
Электростатическое взаимодействия приводят к отклонениям в поведении системы от идеального. Учесть влияние электростатических факторов можно с помощью приема, называемого методом активностей. Сущность его состоит в том, что вместо концентраций реагирующих частиц [A] используют величины, называемые активностями аА. Численные значения активностей выбирают таким образом, чтобы форма функциональной зависимости для свободной энергии сохранялась и для реальных растворов:

Таким образом, активность – это та концентрация, которую имел бы компонент воображаемого идеального раствора, обладающего теми же термодинамическими свойствами, что и данный реальный раствор. Она имеет размерность концентрации (моль/л).
Применив выражение к реакции
аА+bB cC+dD
cC+dD
и проведя преобразования, получаем
 .
.
Это отношение, является выражением закона действия масс. Однако, оно применимо к любым химическим системам – как идеальным, так и реальным. В общем случае формулировка закона действия масс гласит: в состоянии химического равновесия отношение произведений активностей продуктов реакции к произведению активностей сходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре, давлении и в данном растворителе.
Отношение активности частицы к ее равновесной концентрации

называется
коэффициентом активности. Коэффициенты
активности ионов в растворах электролитов
могут служить мерой электростатических
взаимодействий в системе. Для идеальных
растворов электростатические
взаимодействия пренебрежимо малы,
активности арвны равновесным концентрациям
и
 =1.
=1.
Существуют различные методы определения и расчета коэффициентов активности. Поскольку электростатические взаимодействия особенно сильны в растворах электролитов, то основное внимание мы уделим расчетам коэффициентов активности ионов. Они зависят от величины I, называемой ионной силой и вычисляемой по уравнению

где
zi
– заряд иона Ai;
 – сумма всех ионов, присутвующих в
растворе.
– сумма всех ионов, присутвующих в
растворе.
Таким образом, ионная сила учитывает электростатическое влияние всех ионов в растворе. Она имеет размерность концентрации и для растворов сильных 1-1-зарядных электролитов численное ей равна.
Коэффициент активности индивидуальных ионов можно оценить по приближенной формуле Дебая-Хюккеля
 (I
(I )
)
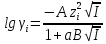 (I=0,0-0,1
М)
(I=0,0-0,1
М)
где
А
и В
– константы, зависящие от температуры
и диэлектрической проницаемости
раствворителя; а – эмпирическая
константа, учитывающая размеры ионов
и характеризующая среднее расстояние
сближения сольватированных ионов в
предположении, что они являются жесткими
сферами. Значение а можно приближено
считать постоянным, не зависящим от
природы иона и равным ~ 3 .
Поэтому для ориентировочных расчетов
размерами ионов можно принебречь и
пользоваться усредненными значениями
.
Поэтому для ориентировочных расчетов
размерами ионов можно принебречь и
пользоваться усредненными значениями
 ,
для инов одного заряда.
,
для инов одного заряда.
В
разбавленных растворах (I коэффициенты активности ионов меньше
единицы и уменьшаются с ростом ионной
силы: при I
коэффициенты активности ионов меньше
единицы и уменьшаются с ростом ионной
силы: при I величина
величина
 .
Растворы с очень низкой ионной слой (I
.
Растворы с очень низкой ионной слой (I можно считать идеальными.
можно считать идеальными.
При
более высоких ионных силах коэффициенты
активности начинают зависеть от природы
ионов, а затем и от общего состава
раствора. В этих случаях для нахождения
коэффициентов активности следует
пользоваться конкретными справочными
данными. В очень концентрированных
растворах (I коэффициенты активности ионов могут
быть больше единицы. Одна из причин
этого явления состоит в связывании
значительного количества растворителя
в результате сольватации ионов и, таким
образом, в увеличении кажущейся
концентрации ионов. При I=0,1-0,5
M
во многих случаях хорошие результаты
дают расчеты по уравнению Дэвиса:
коэффициенты активности ионов могут
быть больше единицы. Одна из причин
этого явления состоит в связывании
значительного количества растворителя
в результате сольватации ионов и, таким
образом, в увеличении кажущейся
концентрации ионов. При I=0,1-0,5
M
во многих случаях хорошие результаты
дают расчеты по уравнению Дэвиса:
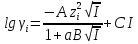 ,
,
где а и С – константы (подбирают эмпирически для каждого конкретного электролита).
Экспериментально определить коэффициенты активности индивидуальных ионов невозможно, так как нельзя получить раствор, содержащий ионы только одного сорта. Опытным путем можно измерить лишь средний коэффициент активности ионов электролита, который связан с коэффициентами активности составляющих его ионов.
Для более высоких значений ионой силы необходимо использовать уравнение, которое с учетом zi=0 превращается в
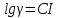
Константа
С
в этом случае называется солевым
коэффициентом. Она зависит от
диэлектрической проницаемости
неэлектролита
 Для веществ с низкой диэлектрической
проницаемостью (газы, сахара, белки) С>0
и
Для веществ с низкой диэлектрической
проницаемостью (газы, сахара, белки) С>0
и
 Для таких веществ наблюдается эффект
«высасывания», т. е. Уменьшения их
растворимости в воде в присутствии
электролитов. Для веществ с высокой
диэлектрической проницаемостью
(например, для НCN
Для таких веществ наблюдается эффект
«высасывания», т. е. Уменьшения их
растворимости в воде в присутствии
электролитов. Для веществ с высокой
диэлектрической проницаемостью
(например, для НCN
 С<0
и
С<0
и

Качественный анализ имеет дело преимущественно с разбавленными растворами, часто являющимися пересыщенными тем или иным веществом с весьма малой растворимостью. В подобных случаях возможно применять закон действия масс с достаточной точностью, принимая действующую массу реагирующего вещества равной общей его концентрации. Если же с такой предпосылкой подходить к более концентрированным растворам сильных электролитов (т. е. таких, которые ионизируют на 50% и более), то будет допущена заметная ошибка; в этом случае между действующей массой а (или активностью) реагирующего вещества и его общей концентрацией с (выражаемой в молях на литр) устанавливается следующее соотношение:
Эти
коэффициенты активности не являются
постоянными величинами. В случае
бесконечно разбавленных растворов
величина
 приближается к единице и тогда активность
а становится равной концентрации с. С
увеличением концентрации иона величина
приближается к единице и тогда активность
а становится равной концентрации с. С
увеличением концентрации иона величина
 уменьшается, проходя иногда через
минимум. Коэффициент активности иона
какого-либо электролита зависит от
валентности и свойств данного иона, а
также от концентрации и природы других
присутствующих в растворе ионов.
уменьшается, проходя иногда через
минимум. Коэффициент активности иона
какого-либо электролита зависит от
валентности и свойств данного иона, а
также от концентрации и природы других
присутствующих в растворе ионов.
Влияние присутствия посторонних ионов на коэффициенты активности сильных электролитов может быть иллюстрирован следующими примерами. В концентрированном растворе хлорида щелочного металла хлористый водород обнаруживает большую концентрацию активного водорода, чем тот же хлористый водород в чистой воде.
В случае слабых электролитов нет необходимости пользоваться фактором активности.
