
- •Состояние ионов в растворе. Концентрации: общая и равновесная. Активность, коэффициент активности. Ионная сила раствора. Константы равновесия. Факторы, влияющие на равновесие.
- •Состояние ионов в растворе.
- •Концентрация: общая и равновесная
- •Активность, коэффициент активности
- •Ионная сила раствора
- •Константа равновесия
- •Факторы, влияющие на равновесие.
-
Состояние ионов в растворе. Концентрации: общая и равновесная. Активность, коэффициент активности. Ионная сила раствора. Константы равновесия. Факторы, влияющие на равновесие.
-
Состояние ионов в растворе.
Влияние среды на состояние ионов в растворах
Среда оказывает глубокое влияние на состояние вещества в растворе. В зависимости от свойств среды в растворах могут образовываться различные ионы одних и тех же элементов.
Ниже приведены примеры влияния среды на состояние некоторых ионов:
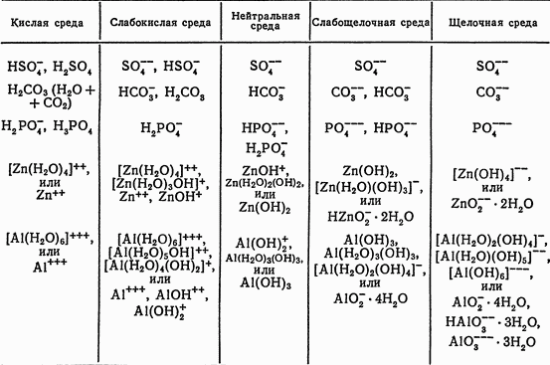
Ряд элементов в высшей степени окисления не существует в водных растворах в виде простых ионов (1 и т. п.), а образует сложные ионы 2 и т. д. Ионы типа 3 как самостоятельные частицы, не распадающиеся на 4 и пр.
Сольваты. Большинство реакций, используемых в химическом анализе, протекает в растворах. Ионы и молекулы растворенных веществ соединяются с молекулами растворителя, образуя продукты присоединения, которые называют сольватами. Процессы, сопровождающиеся образованием сольватов, называют сольватацией, а частный случай сольватации — взаимодействие частиц растворенного вещества с молекулами воды — гидратацией. На этих понятиях основано физико-химическое учение Д. И. Менделеева о растворах.
Так как ионы в растворах реагируют с молекулами растворителя, то правильней следовало бы писать формулы ионов с молекулами растворителя, оказывающего существенное влияние на свойства растворенного вещества. Например:
В водной среде

В среде аммиака
![]()
В среде безводной уксусной кислоты
![]()
В среде безводной серной кислоты
![]()
В среде хлористоводородной кислоты
![]()
Однако обычно пользуются более упрощенными формулами.
Здесь принято обозначать положительные или отрицательные заряды реально существующих ионов знаками плюс (+) и минус (—); степень окисления — римскими цифрами.
-
Концентрация: общая и равновесная
Каждую химическую реакцию можно характеризовать с двух точек зрения: термодинамической и кинетической. С точки зрения термодинамики реакция характеризиуется состоянием равновесия, когда в системе при данной температуре и постоянсвте других внешних условий устанавливаются неизменные во времени авновесные концентрации участников реакции. Кинетика характеризует скорость протекания химической реакции, скорость ее приблежения к состоянию равновесия. Большинство реакций аналитической химии протекает в растворе с большой скоростью и быстро приходит к состоянию химического равновесия.
Когда процессы взаимодействия раствренных веществ с растворителем и между собой придут в состояние равновесия, в растворе установятся равновесные концентрации.
При постоянных температуре и давлении равновесне концентрации не изменяются во времени сколь угодно долго. Равновесная концентрация вещества зависит от его общей или исходной концентрации и расхода вещества на протекание химической реакции вещества в растворе обычно обозначается как с0, а равновесная – как с, нередко в качестве символа равновесной концентрации используют также квадратные скобки [], в которые заключают формлу вещества. В растворе устанавливается равновесие между всеми формами существования вещества. Сумма всех равновесных форм будет равна общей концентрации вещества в растворе.
Концентрация растворенного вещества может быть выражена в разных единицах: количеством вещества (моль) в 1 л раствора (моль/л), числом граммов вещества в 1 л раствора (г/л), числом граммов вещества в 100 г раствора (массовая доля или процентное содержание) и т. д. В СИ моль является основной единицей количества вещества.
Общую (аналитическую, валовую) концентрацию вещества X в растворе обозначают как с°(Х), которая представляет собой молярную концентрацию растворенного вещества независимо от того, какие превращения оно претерпело при растворении (диссоциация, гидролиз и т.д.).
