
- •Фотосенсибилизированные эффекты на клеточных системах. Фотодинамическая терапия.
- •Антимикробная фдт.
- •Материалы и методы:
- •Ход работы:
- •Исследование сравнительной эффективности действия различных фотосенсибилизаторов на бактерии методом биолюминесценции.
- •Исследование эффективности действия фотосенсибилизаторов на клетки дрожжей по их выживаемости:
Задача большого практикума по биофизике для студентов 4-го курса.
Исследование фотодинамического действия сенсибилизаторов разных типов на микроорганизмы.
Фотодинамические процессы, в которых задействованы фотосенсибилизаторы и клеточные структуры, имеющие размеры порядка нанометра, представляют значительный интерес как с точки зрения фундаментальных исследований их механизмов, так и в связи с их прикладной ролью в медицине, где они используются для лечения опухолевых и микробных заболеваний.
Для достижения наибольшей эффективности терапевтического дейстия препаратов-фотосенсибилизаторов, активируемых светом, необходимо решение таких задач нанобиотехнологии, как:
- адресная доставка, что обеспечивается избирательностью взаимодействия фотосенсибилизатора и структур-адресатов,
- флуоресцентная визуализация мишеней фотодинамического действия, связавших фотосенсибилизатор, для диагностики и оптимизации последующего локального светового воздействия.
В связи с этим, необходимы разработка и синтез наночастиц фотосенсибилизатора с заданными спектральными и физико-химическими свойствами.
Для запуска фотодинамических реакций необходимы свет, хромофор- фотосенсибилизатор и кислород.
При поглощении света молекула фотосенсибилизатора переходит сначала в короткоживущее синглетное, а затем, путем интеркомбинационной конверсии, в более долгоживущее триплетное возбужденное состояние.
Реакции возбужденных молекул сенсибилизатора с окружающими молекулами делят на два типа - I тип, в котором образуются свободнорадикальные интермедиаты, и II тип, в котором образуется 1О2 (Рис. 1).
Реакции I типа инициируются переносов атома водорода от субстрата RН к фотосенсибилизатору в триплетном состоянии (3S) с образованием радикала субстрата (R۟) ۠и радикала сенсибилизатора (SH۟۟ ۟), депротонирование которого дает анион-радикал (S۟۟ -). Взаимодействие радикала субстрата с кислородом приводит к образованию пероксидного радикала (RОО۟۟ -۟), последующие реакции которого с другими молекулами субстрата генерируют новые радикалы R۟۟ и гидроперекиси (RООН). При окислении фотосенсибилизатора S۟۟ ־ - второго участника первичной радикальной пары – образуются основное состояние сенсибилизатора Sо, который может вновь участвовать в фотоинициации радикальных процессов, и супероксидный анион радикал О2۟۟ -. Помимо наличия собственного окислительного потенциала, главная опасность О2.- для живых систем заключается в генерации им других АФК: в результате реакций дисмутации О2۟۟ - превращается в перекись водорода, что в реакциях Хабера-Вайса может привести к образованию высоко реакционного гидроксильного радикала ОН, инициирующего свободнорадикальное перекисное окисление путем отрыва атома водорода от субстрата (константа скорости реакции ~109 М-1с- 1).
O2 + e- О2۟۟.-
О2۟۟.-+ О2۟۟ - + 2H+ H2O2 + O2
О2۟۟.-+ H2O2 O2 + OH- + ОН۟۟
Таким образом, в результате реакций радикалов с кислородом генерируется сложная смесь активных форм кислорода (АФК) - О2۟۟ -, Н2О2 и ОН۟۟۟, вызывающих окислительную деструкцию биомолекул.
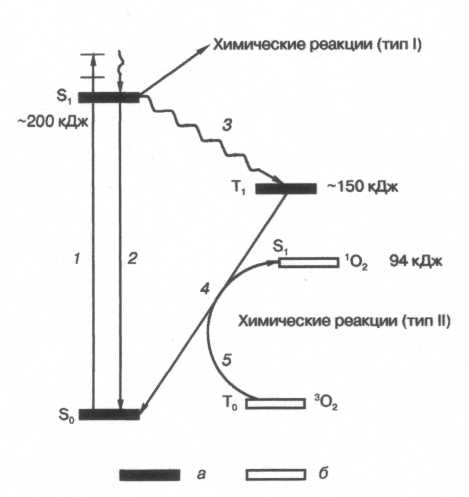
Рис. 1. Схема электронных переходов возбужденных сенсибилизаторов и образования синглетного кислорода. 1 - поглощение, 2 - флуоресценция, 3 - внутрисистемная конверсия, 4 - фосфоресценция, 5 - переход триплетного кислорода 3O2 в синглетный кислород 1O2. Уровни энергии сенсибилизатора (а) и кислорода (б).
В реакциях II типа на начальной стадии происходит перенос энергии от возбужденного триплетного фотосенсибилизатора на молекулярный кислород, находящийся в основном триплетном состоянии, с образованием его синглетного возбужденного состояния 1О2, способного непосредственно реагировать с субстратом (RН), переводя его в гидроперекись (RООН). Для протекания фотосенсибилизированных реакций II типа необходимо, чтобы время жизни триплетного возбужденного состояния фотосенсибилизатора T было 500 нс, а его энергия - не меньше, чем энергия образования первого синглетного состояния кислорода (94 кДж/моль).
Именно реакции фотосенсибилизации обусловливают повреждение биологически важных макромолекул – белков, липидов, нуклеиновых кислот - при действии длинноволнового ультрафиолетового (дУФ) (320-400 нм) и видимого света (400-700 нм), где эти соединения не имеют поглощения. Эффективность деструктивного действия дУФ и видимого света существенно повышается при нарушениях клеточного метаболизма, сопровождающихся накоплением эндогенных фотосенсибилизаторов, а также в присутствии экзогенных сенсибилизаторов и фотоактивных ксенобиотиков.
Ряд внутриклеточных сенсибилизаторов - НАД(Ф)Н, флавины, кетоны и хиноны, индуцируют протекание радикальных реакций I типа. Так, флавины в триплетном возбужденном состоянии обладают более высоким редокс-потенциалом (1,7 эВ у рибофлавина) по сравнению с аминокислотами, липидами и нуклеотидами, и индуцируют протекание окислительных процессов за счет переноса электрона (или атома водорода) от субстрата с образованием восстановленных флавосемихинонных радикалов.
В то же время порфирины преимущественно запускают реакции II типа с образованием 1О2.
Ниже рассматриваются механизмы фотодинамических реакций с участием нуклеиновых кислот, белков и липидов.
Липиды. В липипдах наиболее чувствительными к фотосенсибилизированному окислению являются ненасыщенные жирные кислоты (НЖК) и холестерин. Эти соединения могут быть окислены как по механизму фотодинамических реакций I типа, так и II типа, причем в обоих случаях основными промежуточными продуктами являются гидроперекиси, а конечными – альдегиды, кетоны и др. В реакциях, имеющих чисто радикальную природу (I тип), не образуется 5α-ООН-холестерин, поэтому этот продукт используется как доказательство участия 1О2 в фотосенсибилизированных реакциях в биологических мембранах. Альдегиды и кетоны могут взаимодействовать с NH2 - и тиольными группами мембранных белков, приводя к их инактивации и/или функциональным изменениям.
Протекание цепных свободнорадикальных реакций ограничивается наличием антиоксидантов типа α-токоферола, способных ингибировать эти реакции, конкурируя с НЖК (RН) за восстановление ее пероксидного радикала (RОО.).
Сенсибилизированное фотоокисление липидов вызывает структурные изменения в мембранах, что приводит к резкому снижению барьерных свойств липидных бислоев, дезинтеграции митохондриальных, лизосомальных и плазматических мембран, следствием чего является снижение уровня АТФ, закисление содержимого клеток, активация протеаз и лизис клеток.
Нуклеиновые кислоты. Квантовый выход образования фотоповреждений ДНК, которые индуцируются дУФ-ом и видимым светом, очень мал и летальные эффекты имеют место только при высоких интенсивностях и дозах облучения - на 4-6 порядков больших при переходе от 290 к 330 нм и еще на порядок при дальнейшем увеличении длины волны.
дУФ индуцирует образование в ДНК повреждений, характерных для ионизирующей радиации, - разрывов цепи ДНК и сшивок ДНК-белок.
Наибольшее значение для протекания вызванных дУФ-ом сенсибилизированных реакций в клетках имеет поглощение света НАД(Ф)Н и генерация им в фотовозбужденном состоянии супероксидного анион радикала О2۟-, индуцирующего образование гидроксильного радикала ОН۟, который атакует сахарофосфатный остов ДНК, образуя однонитевые разрывы:
дУФ (340 нм) → НАДН→ НАДН* + О2 → НАД+ + О2۟- →
→ Н2О2 → ОН۟ → однонитевые разрывы ДНК
Некоторые экзогенные сенсибилизаторы (например, акридины, метиленовый синий) имеют положительный заряд и поэтому образуют комплексы с ДНК, что увеличивает вероятность сесибилизации по I (радикальному) типу в соответствии с вышеописанным механизмом.
При фотосенсибилизации видимым светом с участием синглетного кислорода (II тип реакций) фотоокислению подвергаются главным образом пуриновые основания - гуанин и гуанинсодержащие нуклеотиды. Главный биологический эффект, индуцированный продуктами фотосенсибилизированного окисления гуаниновых оснований в ДНК, - мутагенез. Мутагенные эффекты при образовании продуктов окисления гуанина связаны, в основном, с G → T трансверсиями. Фотодеградация гуаниновых оснований в ДНК также может приводить к одноцепочечным разрывам. Продукты окислительного повреждения ДНК ингибируют репликацию ДНК.
Наряду с рассмотренными выше фотореакциями, которые опосредуются АФК, в ДНК под действием дУФ-облучения протекает независимая от кислорода реакция димеризации тиминовых оснований. Однако, в отличие от соответствующей реакции на кУФ и сУФ, происходящей при прямом поглощении света пиримидиновыми основаниями ДНК, дУФ-индуцированная димеризация запускается соединениями кетонной природы в результате триплет-триплетной миграции энергии с возбужденного фотосенсибилизатора на тиминовые основания ДНК.
Белки. Из аминокислот, входящих в состав белков, в сенсибилизированных реакциях эффективно фотоокисляются тирозин, триптофан, метионин, гистидин и цистеин. Гистидин подвергается окислению в основном по механизму типа II. Поэтому его часто используют в качестве специфического акцептора 1О2 .
Наиболее подвержены фотоокислению периферические аминокислотные остатки белков. Наряду с прямыми первичными реакциями окисления аминокислотных остатков белков, имеют место и вторичные АФК-индуцированные реакции - модификация белков продуктами перекисного окисления липидов. Окислительная модификация приводит к изменениям конформации, спектров белков, их способности связывать кофакторы, неэнзиматической фрагментации и протеолитической деградации, а в некоторых случаях к агрегации за счет формирования межмолекулярных дисульфидных сшивок. Результатом фотохимических модификаций является инактивация ферментов и ингибирование систем трансмембранного транспорта ионов, сахаров и аминокислот.
Фотосенсибилизированные эффекты на клеточных системах. Фотодинамическая терапия.
Большинство природных хромофоров, имеющих полосы поглощения в видимом диапазоне спектра, в зависимости от их химической структуры можно отнести к трем большим группам: циклические или линейные тетрапирролы, полиены и ароматические соединения. Для представителей всех трех классов характерно наличие системы сопряженных двойных связей. Первичная фотохимическая реакция возбужденных молекул хромофоров может заключаться в фотоизомеризации (родопсин, фитохром), передаче электрона (флавины) или передаче энергии возбуждения (порфирины).
Основным кандидатом на роль эндогенных сенсибилизаторов на видимом свету являются порфириновые соединения. Свободные (безметальные) фотодинамически активные эндогенные порфирины являются предшественниками на путях синтеза функционально активных металлопорфиринов (гема, хлорофилла), их внутриклеточная концентрация может возрастать при нарушениях регуляции метаболизма. Энергии триплетного уровня порфиринов достаточно для образования первого возбужденного синглетного состояния кислорода, и сенсибилизируемые ими реакции преимущественно протекают по типу II.
Как было показано выше, повреждения, индуцируемые в клетках дУФ и видимым светом, могут затрагивать практически все клеточные структуры. Это обусловлено принципиальным отличием между деструктивным действием на биологические системы излучения коротковолнового и длинноволнового диапазонов: преобладанием прямых фотохимических реакций при поглощении биомолекулами кУФ и сУФ квантов и протеканием фотосенсибилизированных окислительных реакций на дУФ и видимом свету. Однако, в связи с ограниченным диффузионным радиусом и временем жизни активных форм кислорода, а также наличием антиоксидантных систем, эффективность фотосенсибилизированных деструктивных процессов в норме не высока и определяется, главным образом, концентрацией и внутриклеточной локализацией фотосенсибилизатора, а именно, его близостью к критическим клеточным мишеням, повреждение которых может существенно повлиять на жизнеспособность клетки
Процессы фотосенсибилизации активно изучаются в последнее время не только в связи с необходимостью выяснения механизмов ее повреждающего действия на живые организмы, но и в целях медицинского использования этого явления при лечении ряда заболеваний, таких как раковые опухоли, заболевания кожи, а также микробные поражения.
К объектам антимикробной ФДТ принято относить вирусы, бактерии, грибы и простейшие. Поскольку множественный окислительный характер повреждений различных субклеточных структур препятствует развитию устойчивости к препаратам ФДТ, этот метод рассматривается как альтернативный способ борьбы со штаммами возбудителей заболеваний, устойчивыми к действию традиционных лекарственных препаратов. Фотодинамическая инактивация патогенных микроорганизмов может также использоваться в целях стерилизации и обеззараживания.
Таким образом, сфера применения фотодинамических воздействий быстро расширяется.
Природа используемого фотосенсибилизатора определяется типом клеток, которые необходимо инактивировать, селективностью накопления сенсибилизатора, возможными способами его доставки к чувствительным клеточным мишеням, концентрацией кислорода вблизи места локализации и другими параметрами. Наиболее подробно изучены и активно используются в практике следующие группы фотосенсибилизаторов:
фурокумарины, поглощающие в дУФ-области, применяются в основном при лечении кожных заболеваний - псориаза и витилиго;
фенотиазины, поглощающие в красной области спектра, используются для обеззараживания крови;
порфирины и их аналоги, хлорины и фталоцианины, имеющие тенденцию к сдвигу поглощения в длинноволновую область, где возрастает пропускание тканей, эффективны при фототерапии опухолей.
Фенотиазины - это семейство катионных (метиленовый синий) или нейтральных (метиленовый фиолетовый) фотосенсибилизаторов с выраженной антивирусной активностью. Однако, наличие положительного заряда препятствует проникновению фенотиазинов в клетки и делает невозможным фотоинактивацию внутриклеточных вирусов. В этих целях используются нейтральные фенотиазины и их галогенопроизводные. Индуцируемые фенотиазинами реакции имеют двойную природу, соотношение вклада фотосенсибилизированных процессов I и II типа в суммарный эффект фотоинактивации близко к 1:1. Главными внутриклеточными мишенями инактивации являются нуклеиновые кислоты, в которых образуются фотоаддукты и подвергаются окислению гуанозиновые основания.
Порфирины и их аналоги имеют двоякое применение в фотомедицине. Флуоресцентные свойства этих соединений используются для демаркации границ опухолей, а за счет протекания фотодинамических реакций II типа с участием 1О2 происходит инактивация опухолевых клеток. Опосредованная порфиринами фотосенсибилизация легла в основу не только метода фотодинамической терапии опухолей. Порфирины используются также в качестве фотоактивных гербицидов, инсектицидов, антимикробных препаратов.
Поглощение и флуоресценция порфиринов обусловлены наличием замкнутой системы двойных связей. Отличительным признаком порфиринового ядра, характерным для всех порфиринов независимо от природы боковых цепей, является резкий максимум поглощения вблизи 400 нм (полоса Соре), (1-2).105 М-1см-1. Менее интенсивные максимумы поглощения обычно располагаются в видимой области спектра, однако, длинноволновая полоса поглощения порфириновых фотосенсибилизаторов второго поколения сдвинута в инфракрасную область.
Большинство порфиринов при облучении подвергается фотовыцветанию - фотодеградации, сопровождающейся уменьшением интенсивности поглощения и флуоресценции и образованием фотопродуктов.
Квантовый выход генерации 1О2 (Ф), один из важнейших параметров при оценке потенциальной фототоксичности порфиринов и возможности их применения в ФДТ, колеблется от 0,34-0,38 (фталоцианины), 0,56 (протопорфирин IX) до 0,85 (фотофрин), 0,91 (Zn-протопорфирин). К параметрам, оказывающим большое влияние на Ф и фототоксичность порфиринов, относится степень аггрегации молекул фотосенсибилизатора: эффективно генерируют 1О2 только мономерные формы.
Время жизни 1О2 в гидрофобном окружении (20-25 мкс в углеводородной фазе, 7 мкс в мемранах) значительно выше, чем в водной среде (3-4 мкс). Поэтому наибольший эффект фотодинамической инактивации наблюдается при локализации критической мишени и сенсибилизатора в гидрофобной зоне. Необходимость тесной ассоциации порфиринового фотосенсибилизатора с мишенью следует из малого диффузионного радиуса 1О2 (менее 50 нм во внутриклеточной среде), что обусловлено высокими константами его тушения клеточными компонентами. По тем же причинам инактивация клеток опосредуется теми молекулами фотосенсибилизатора, которые находятся в плазматической мембране или во внутриклеточном пространстве, поскольку генерация синглетного кислорода вне клетки приводит к быстрому его тушению компонентами среды.
Гидрофобные порфирины эффективно поглощаются клетками и локализуются в первую очередь в области липидного бислоя в плазматических мембранах. После длительной инкубации они могут быть обнаружены и в других клеточных мембранах (митохондриальных, лизосомальных, ядерных). Фотобиологические эффекты гидрофобных порфиринов обусловлены нарушением барьеров проницаемости и потерей функциональной активности мембранных органелл в результате окисления ненасыщенных жирнокислотных остатков липидов и холестерола синглетным кислородом. Дезинтеграция плазматических мембран приводит к лизису клеток, митохондриальных мембран - снижению уровня АТФ, высвобождению проапоптических факторов (цитохрома С) и апоптозу. Следствиями разрыва лизосом и высвобождения их ферментов являются подкисление цитоплазмы и гибель клетки путем некроза.
