- •Введение
- •2.2. Индивидуальные задания (билеты)
- •4. Блок информации
- •Аналитические возможности функциональных групп и типы реакций, используемые для их идентификации
- •4.1. Идентификация спиртового гидроксила
- •4.1.1. Реакция образования сложных эфиров
- •4.1.2. Реакции окисления
- •4.1.3. Реакции образования комплексных соединений (многоатомные спирты)
- •4.2. Идентификация фенольного гидроксила
- •4.2.1. Реакция с железа (III) хлоридом
- •4.2.2. Реакции окисления (индофеноловая проба)
- •4.2.3. Реакции конденсации с альдегидами
- •4.2.4. Сочетание с солями диазония
- •4.2.5. Реакции замещения (с бромной водой и азотной кислотой)
- •4.3. Идентификация альдегидной группы
- •4.3.1. Окислительно- восстановительные реакции
- •Черный осадок
- •4.3.2. Реакции конденсации
- •4.4. Идентификация кето-группы
- •4.5. Идентификация гидроксиацетильной группы
- •4.6. Идентификация карбоксильной группы
- •4.7. Идентификация сложноэфирной группы
- •4.7.1. Реакция кислотного или щелочного гидролиза
- •4.7.2. Гидроксамовая проба
- •4.7.3. Обнаружение лактонов
- •4.8. Идентификация простой эфирной группы
- •4.9. Идентификация первичной ароматической аминогруппы
- •4.9.1. Реакция образования азокрасителя
- •4.9.2. Реакции окисления
- •4.9.3. Реакции конденсации с альдегидами
- •4.10. Идентификация первичной алифатической аминогруппы
- •4.10.1. Нингидриновая проба
- •4.11. Идентификация вторичной аминогруппы
- •4.12. Идентификация третичной аминогруппы
- •Реактив Майера
- •4.13. Идентификация амидной и n-замещенной амидной группы
- •4.13.1. Щелочной гидролиз
- •4.14. Идентификация имидной группы
- •4.14.1. Щелочной гидролиз
- •4.14.2. Реакция образования комплексных солей с металлами
- •4.15. Идентификация гидразидной группы
- •4.16. Идентификация ароматической нитрогруппы
- •4.16.1. Реакция восстановления
- •4.16.2. Реакции образования солей псевдонитрокислоты (аци-соли)
- •4.17. Идентификация сульфгидрильной группы
- •4.18. Идентификация сульфамидной группы
- •4.18.1. Реакция образования солей с ионами тяжелых металлов
- •4.18.2. Реакция минерализации
- •4.19. Идентификация серы, включенной в гетероцикл
- •4.20. Идентификация галогенуглеродной группы
- •4.20.1. Идентификация ковалентно связанного йода
- •4.20.2. Реакция восстановительной минерализации цинковой пылью в щелочной среде
- •4.21. Идентификация соединений, содержащих двойную связь
- •4.22 Идентификация анионов органических кислот
- •4.22.1. Определение ацетат-иона
- •4.22.1.1. Лекарственные вещества, содержащие ацетат-ион:
- •4.22.1.2. Реакция образования уксусноэтилового эфира
- •4.22.1.3. Реакция образования комплексной соли железа (III)
- •4.24 Идентификация производных нитрофурана
- •Реакции подлинности производных 5-нитрофурана
- •4.25 Идентификация производных пурина
- •5.25 Идентификация производных Тропана
- •5. План занятия
- •6. Самостоятельная работа студентов (120 мин)
- •9.2. Тестовые задания
- •Объекты исследований
- •2. Самостоятельная внеаудиторная работа по подготовке к занятию
- •2.1. Задания для самоподготовки
- •2.2. Индивидуальные задания (билеты)
- •3. Литература
- •4. Блок информации
- •4.1. Спектрофотометрия в ультрафиолетовой и видимой областях спектра
- •4.2. Спектрофотометрия в ик-области спектра
- •5. План занятия
- •5.1. Определение исходного уровня подготовки студентов к занятию и его корректировка преподавателем путем проверки домашнего письменного задания и проведения опроса (30 мин).
- •6. Самостоятельная работа студентов (90 мин)
- •7. Перечень практических умений и навыков
- •10.2. Пример выполнения самостоятельного задания по
- •Вариант №____
- •11. Задания для самостоятельного выполнения
- •11.1. Варианты индивидуальных заданий для студентов по спектроскопии в уф- и видимой областях Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант № 8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •11.2. Задания для самостоятельного выполнения
- •Вариант №1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •Вариант № 5
- •Вариант № 6
- •Вариант № 7
- •Вариант № 8
- •Вариант № 9
- •Вариант № 10
- •Вариант № 11
- •Вариант № 12
- •Вариант № 13
- •Вариант № 14
- •Вариант № 15
- •Вариант № 16
- •Характеристические полосы поглощения некоторых групп атомов [6, 7]
- •Качественный анализ органических лекарственных средств
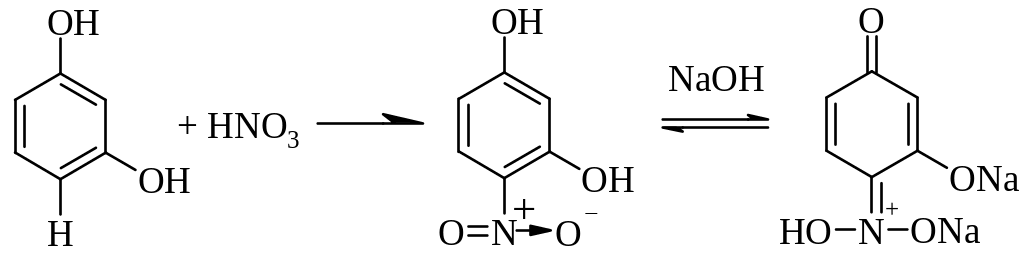
4.2.5. Реакции замещения (с бромной водой и азотной кислотой)
Реакции основаны на способности фенолов бромироваться и нитроваться за счет замещения подвижного атома водорода в орто- и пара-положениях. Бромпроизводные выпадают в осадок белого цвета, а нитропроизводные окрашены в желтый цвет.
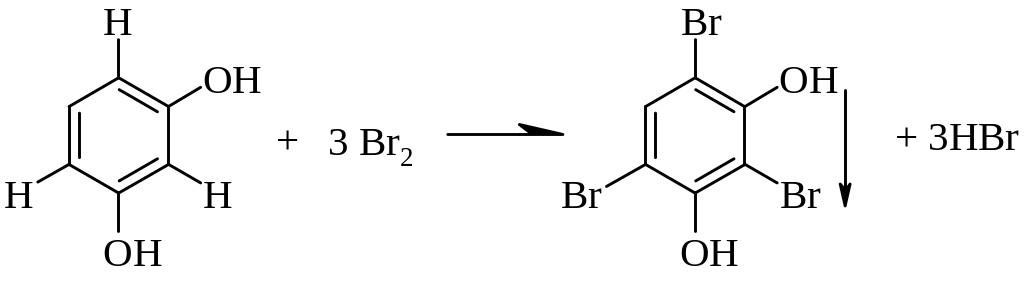
Резорцин белый осадок
Методика: 0,05 г вещества растворяют в 1 мл воды или спирта этилового 95%, прибавляют несколько капель бромной воды и 2-3 капли кислоты серной разведенной. Образуется белый осадок [3.8].
желтое окрашивание
Методика: К 1 мл раствора вещества (фенол, резорцин, тимол, хинозол), приготовленного как указано в предыдущей методике, прибавляют 1-2 мл кислоты азотной разведенной. Постепенно появляется желтое окрашивание [3.9].
4.3. Идентификация альдегидной группы
А льдегиды
– это органические вещества, содержащие
альдегидную группу:
льдегиды
– это органические вещества, содержащие
альдегидную группу:
Альдегиды проявляют восстановительные свойства, следовательно, окисляются до кислот под влиянием сильных и слабых окислителей. В щелочной среде происходит восстановление металлов (Mn+7; Cu+2; Cr+6; Ag+ и др.).
Кроме того, альдегидам свойственны реакции конденсации, присоединения и полимеризации.
Лекарственные вещества, содержащие альдегидную группу:
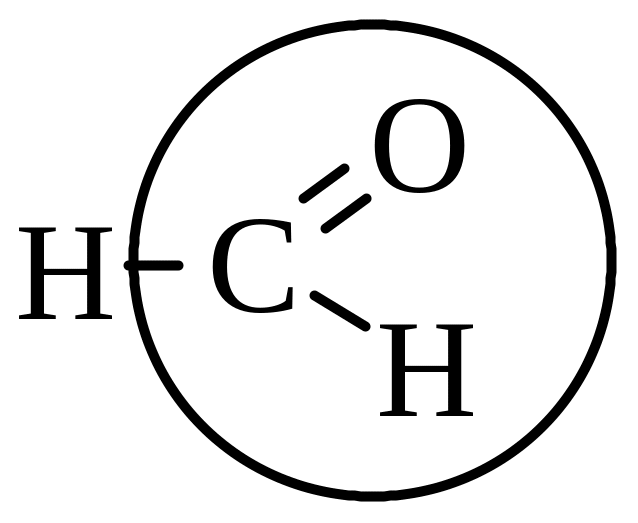
а) Формальдегид |
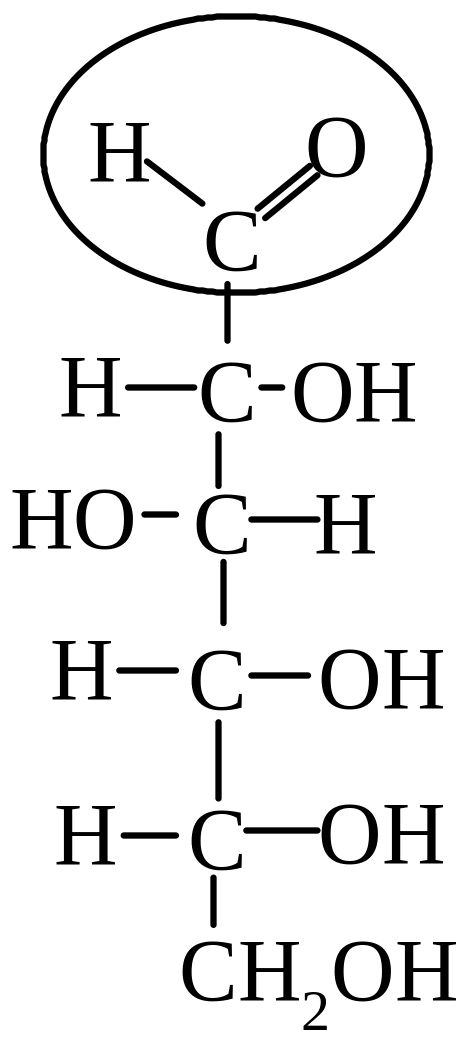
б) Глюкоза |
|
|
4.3.1. Окислительно- восстановительные реакции
Альдегиды легко окисляются до кислот и их солей (если реакции протекают в щелочной среде). Если в качестве окислителей используются комплексные соли тяжелых металлов (Ag, Cu, Hg), то в результате реакции выпадает осадок металла (серебра, ртути) или оксида металла (оксид меди (I)):
а) реакция с аммиачным раствором серебра нитрата
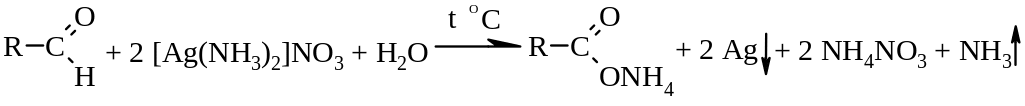
Методика: К 2 мл раствора серебра нитрата прибавляют 10-12 капель раствора аммиака и 2-3 капли раствора вещества (раствор формальдегида, хлоралгидрата, метенамина (гексаметилентетрамина), глюкозы), нагревают на водяной бане с температурой 50 – 60оС; выделяется металлическое серебро в виде зеркала или серого осадка [3.4, 3.7].
б) реакция с реактивом Фелинга
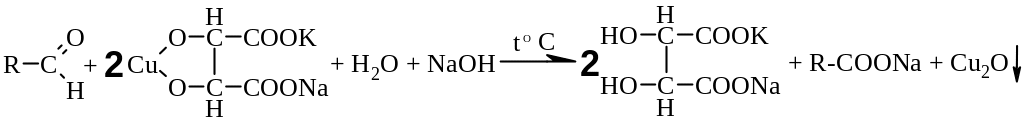
красный осадок
Методика: К 1 мл раствора альдегида (раствор формальдегида, хлоралгидрат, метенамин, глюкоза), содержащего 0,01-0,02 г вещества, прибавляют 2 мл реактива Фелинга, нагревают до кипения. Выделяется кирпично-красный осадок оксида меди (I) [3.6].
в) реакция с реактивом Несслера
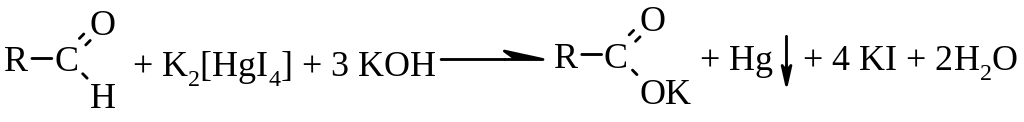
Черный осадок
Методика: К 2-3 каплям раствора альдегида (раствор формальдегида, 3% раствора метенамина, 10% раствора глюкозы) прибавляют 2-3 капли реактива Несслера и нагревают. Выделяется серовато-черный осадок металлической ртути [3.4].
4.3.2. Реакции конденсации
Альдегиды в среде кислоты серной концентрированной конденсируются с фенолами (см. методику 4.2.3), образуются окрашенные хиноны. Ниже приводится уравнение химической реакции с салициловой кислотой. Появляется красное окрашивание (арилметановый краситель):
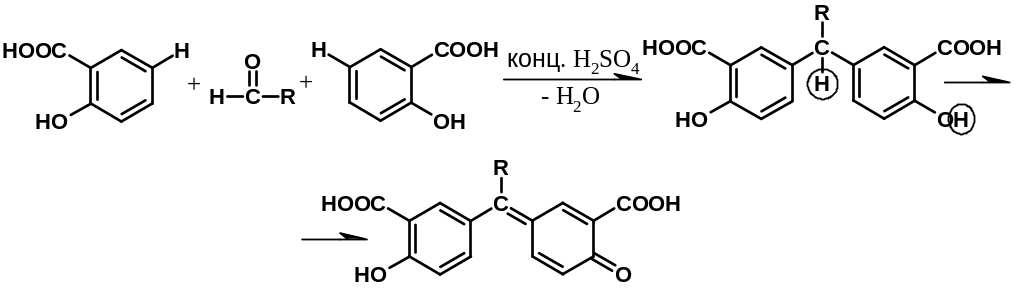
Кроме фенолов с альдегидами конденсируются первичные ароматические амины (образуются основания Шиффа) и гидразины (в виде осадка или окрашенного продукта). Тип реакции – нуклеофильное присоединение:
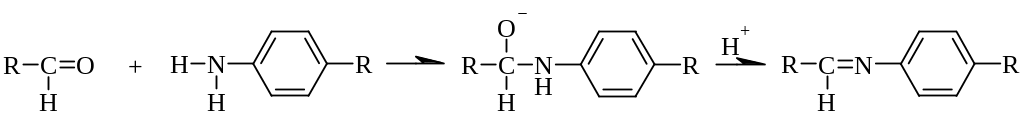
Методика: см. раздел 4.9.3.
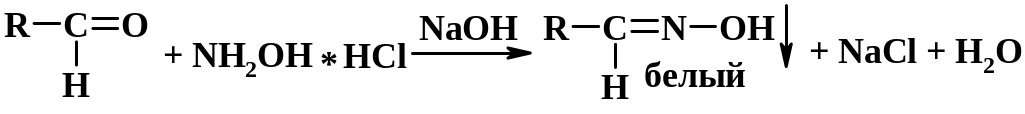
Методика: К 1 мл раствора альдегида прибавляют 1 мл щелочного раствора гидроксиламина гидрохлорида. Постепенно выпадает осадок оксима [3.9].