- •Введение
- •2.2. Индивидуальные задания (билеты)
- •4. Блок информации
- •Аналитические возможности функциональных групп и типы реакций, используемые для их идентификации
- •4.1. Идентификация спиртового гидроксила
- •4.1.1. Реакция образования сложных эфиров
- •4.1.2. Реакции окисления
- •4.1.3. Реакции образования комплексных соединений (многоатомные спирты)
- •4.2. Идентификация фенольного гидроксила
- •4.2.1. Реакция с железа (III) хлоридом
- •4.2.2. Реакции окисления (индофеноловая проба)
- •4.2.3. Реакции конденсации с альдегидами
- •4.2.4. Сочетание с солями диазония
- •4.2.5. Реакции замещения (с бромной водой и азотной кислотой)
- •4.3. Идентификация альдегидной группы
- •4.3.1. Окислительно- восстановительные реакции
- •Черный осадок
- •4.3.2. Реакции конденсации
- •4.4. Идентификация кето-группы
- •4.5. Идентификация гидроксиацетильной группы
- •4.6. Идентификация карбоксильной группы
- •4.7. Идентификация сложноэфирной группы
- •4.7.1. Реакция кислотного или щелочного гидролиза
- •4.7.2. Гидроксамовая проба
- •4.7.3. Обнаружение лактонов
- •4.8. Идентификация простой эфирной группы
- •4.9. Идентификация первичной ароматической аминогруппы
- •4.9.1. Реакция образования азокрасителя
- •4.9.2. Реакции окисления
- •4.9.3. Реакции конденсации с альдегидами
- •4.10. Идентификация первичной алифатической аминогруппы
- •4.10.1. Нингидриновая проба
- •4.11. Идентификация вторичной аминогруппы
- •4.12. Идентификация третичной аминогруппы
- •Реактив Майера
- •4.13. Идентификация амидной и n-замещенной амидной группы
- •4.13.1. Щелочной гидролиз
- •4.14. Идентификация имидной группы
- •4.14.1. Щелочной гидролиз
- •4.14.2. Реакция образования комплексных солей с металлами
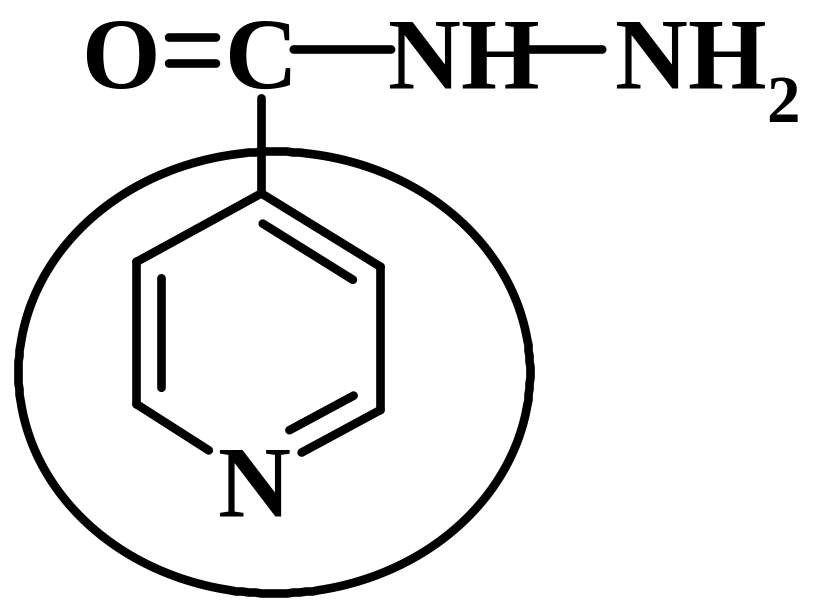
- •4.15. Идентификация гидразидной группы
- •4.16. Идентификация ароматической нитрогруппы
- •4.16.1. Реакция восстановления
- •4.16.2. Реакции образования солей псевдонитрокислоты (аци-соли)
- •4.17. Идентификация сульфгидрильной группы
- •4.18. Идентификация сульфамидной группы
- •4.18.1. Реакция образования солей с ионами тяжелых металлов
- •4.18.2. Реакция минерализации
- •4.19. Идентификация серы, включенной в гетероцикл
- •4.20. Идентификация галогенуглеродной группы
- •4.20.1. Идентификация ковалентно связанного йода
- •4.20.2. Реакция восстановительной минерализации цинковой пылью в щелочной среде
- •4.21. Идентификация соединений, содержащих двойную связь
- •4.22 Идентификация анионов органических кислот
- •4.22.1. Определение ацетат-иона
- •4.22.1.1. Лекарственные вещества, содержащие ацетат-ион:
- •4.22.1.2. Реакция образования уксусноэтилового эфира
- •4.22.1.3. Реакция образования комплексной соли железа (III)
- •4.24 Идентификация производных нитрофурана
- •Реакции подлинности производных 5-нитрофурана
- •4.25 Идентификация производных пурина
- •5.25 Идентификация производных Тропана
- •5. План занятия
- •6. Самостоятельная работа студентов (120 мин)
- •9.2. Тестовые задания
- •Объекты исследований
- •2. Самостоятельная внеаудиторная работа по подготовке к занятию
- •2.1. Задания для самоподготовки
- •2.2. Индивидуальные задания (билеты)
- •3. Литература
- •4. Блок информации
- •4.1. Спектрофотометрия в ультрафиолетовой и видимой областях спектра
- •4.2. Спектрофотометрия в ик-области спектра
- •5. План занятия
- •5.1. Определение исходного уровня подготовки студентов к занятию и его корректировка преподавателем путем проверки домашнего письменного задания и проведения опроса (30 мин).
- •6. Самостоятельная работа студентов (90 мин)
- •7. Перечень практических умений и навыков
- •10.2. Пример выполнения самостоятельного задания по
- •Вариант №____
- •11. Задания для самостоятельного выполнения
- •11.1. Варианты индивидуальных заданий для студентов по спектроскопии в уф- и видимой областях Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант № 8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •11.2. Задания для самостоятельного выполнения
- •Вариант №1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •Вариант № 5
- •Вариант № 6
- •Вариант № 7
- •Вариант № 8
- •Вариант № 9
- •Вариант № 10
- •Вариант № 11
- •Вариант № 12
- •Вариант № 13
- •Вариант № 14
- •Вариант № 15
- •Вариант № 16
- •Характеристические полосы поглощения некоторых групп атомов [6, 7]
- •Качественный анализ органических лекарственных средств
4.22 Идентификация анионов органических кислот
4.22.1. Определение ацетат-иона
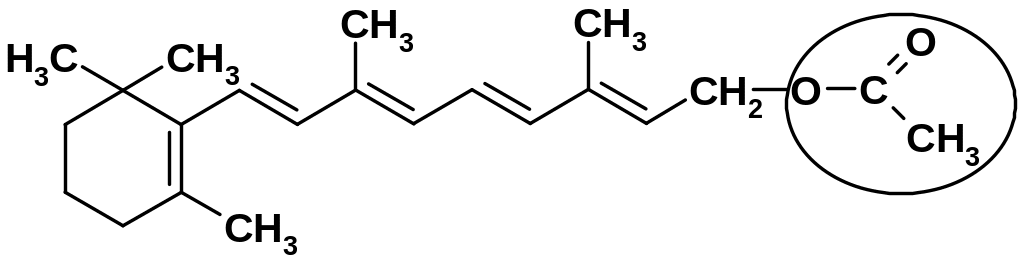
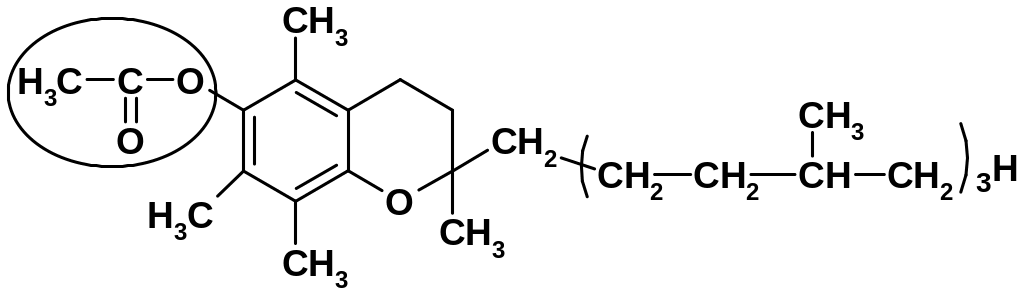
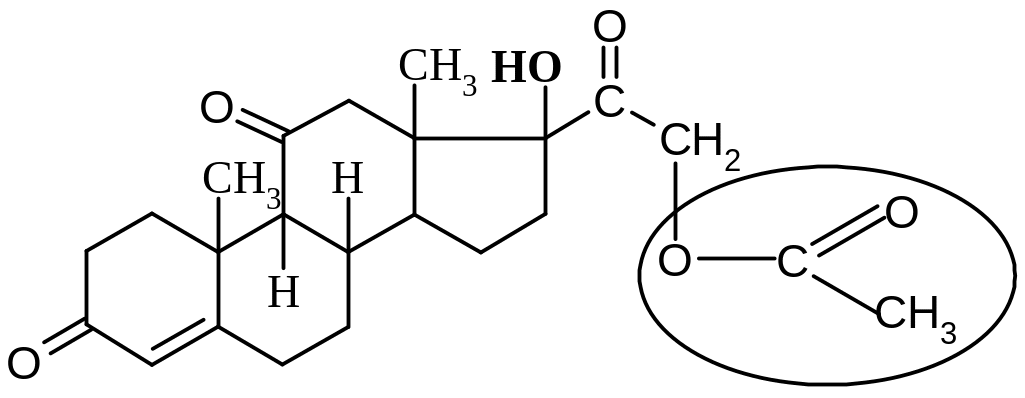
Лекарственные вещества, представляющие собой сложные эфиры спиртов и уксусной кислоты (ретинола ацетат, токоферола ацетат, кортизона ацетат и др.), при нагревании в щелочной или кислой среде гидролизуются с образованием спирта и уксусной кислоты или ацетата натрия:

или

4.22.1.1. Лекарственные вещества, содержащие ацетат-ион:
а) Калия ацетат |
в) Ретинола ацетат |
|
|
б) Токоферола ацетат |
г) Кортизона ацетат |
|
|
4.22.1.2. Реакция образования уксусноэтилового эфира
Ацетаты и уксусная кислота взаимодействуют с 95% спиртом этиловым в присутствии кислоты серной концентрированной с образованием этилацетата:
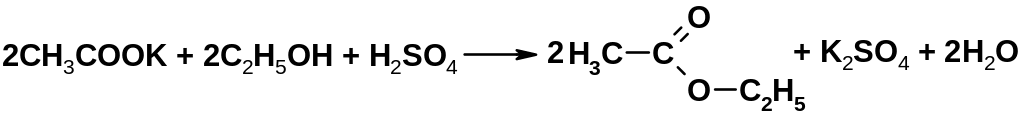
Методика: 2 мл раствора ацетата нагревают с равным количеством кислоты серной концентрированной и 0,5 мл 95% спирта этилового, ощущается запах этилацетата [3.2].
4.22.1.3. Реакция образования комплексной соли железа (III)
Ацетаты в нейтральной среде взаимодействуют с раствором железа (III) хлорида с образованием комплексной соли красного цвета:
9CH3COOK + 3FeCl3 + 2H2O → [(CH3COO)6·Fe3(OH)2]·CH3COO- + 9KCl + 2CH3COOH
Методика: К 2 мл нейтрального раствора ацетата прибавляют 0,2 мл раствора железа (III) хлорида; появляется красно-бурое окрашивание, исчезающее при прибавлении разведенных минеральных кислот [3.2].
4.22.2. Определение тартрат-иона
Лекарственные вещества – соли винной кислоты в нейтральной среде взаимодействуют с калия хлоридом с образованием белого осадка:

4.22.2.1. Лекарственные вещества, содержащие тартрат-ион:
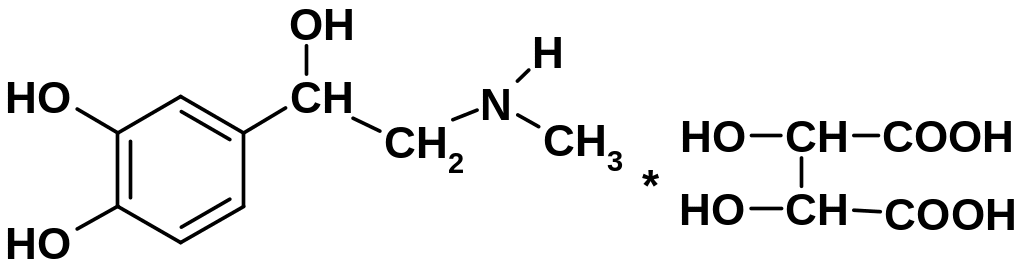
а) Эпинефрина битартрат (адреналина гидротартрат)
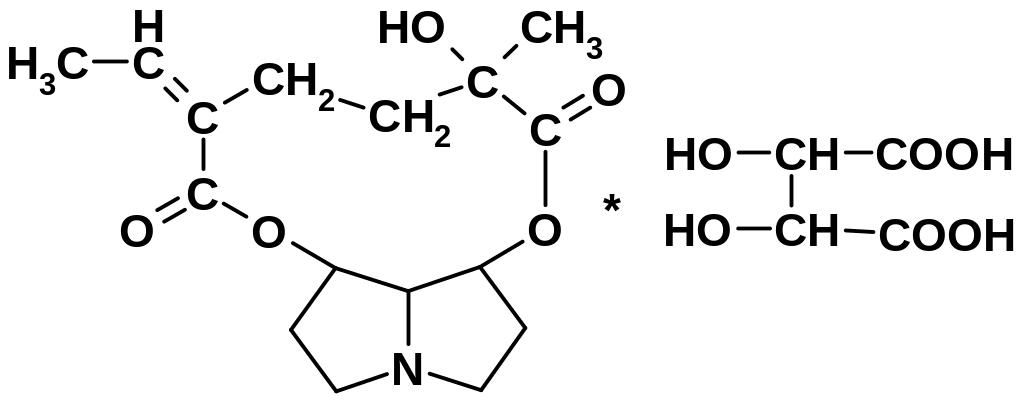
б) Платифиллина гидротартрат
4.22.2.2. Реакция образования тартрата калия
Методика: К 1 мл раствора тартрата прибавляют кристаллик калия хлорида, 0,5 мл 95% спирта этилового, образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах [3.2].
4.22.2.3. Реакция окисления
Тартраты в присутствии кислоты серной концентрированной и резорцина окисляются с образованием продукта, окрашенного в вишнево-красный цвет.
Методика: 0,25 мл раствора тартрата нагревают с 1мл кислоты серной концентрированной и несколькими кристалликами резорцина, через 15-30 секунд появляется вишнево-красное окрашивание [3.2].
4.22.3. Определение цитрат-иона
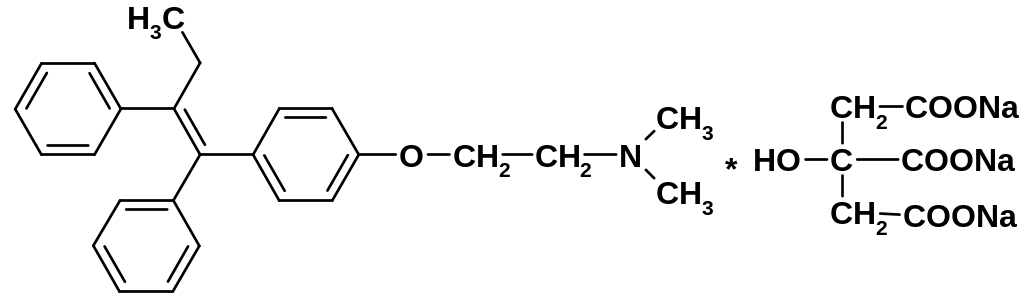
4.22.3.1. Лекарственные вещества, содержащие цитрат-ион:
а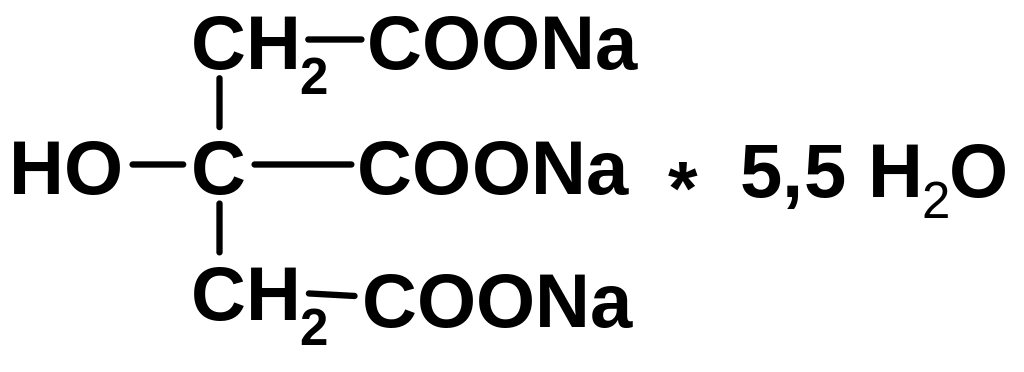 )
Натрия цитрат для инъекций
)
Натрия цитрат для инъекций
б) Тамоксифена цитрат
4.22.3.2. Реакция осаждения
Лекарственные вещества, содержащие цитрат-ион, при взаимодействии с кальция хлоридом и нагревании образуют белые осадки цитрата кальция:
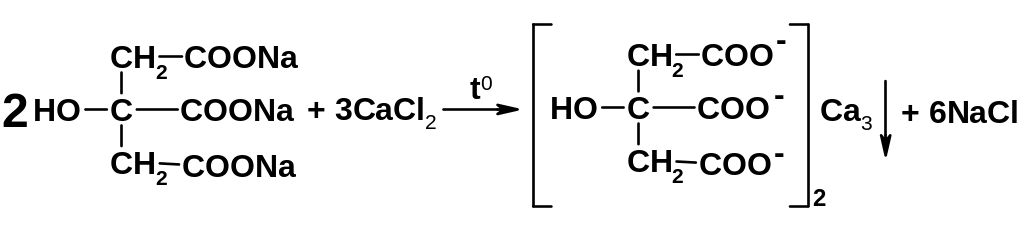
белый
Методика: К 1 мл нейтрального раствора цитрата прибавляют 1 мл раствора кальция хлорида; раствор остается прозрачным; при кипячении образуется белый осадок, растворимый в разведенной кислоте хлористоводородной [3.2].
4.22.3.3. Реакция с уксусным ангидридом
Методика: К 0,002 г лекарственного вещества прибавляют уксусного ангидрида и нагревают, через 20-40 секунд появляется красное окрашивание [3.2].
4.22.4. Определение бензоат-иона
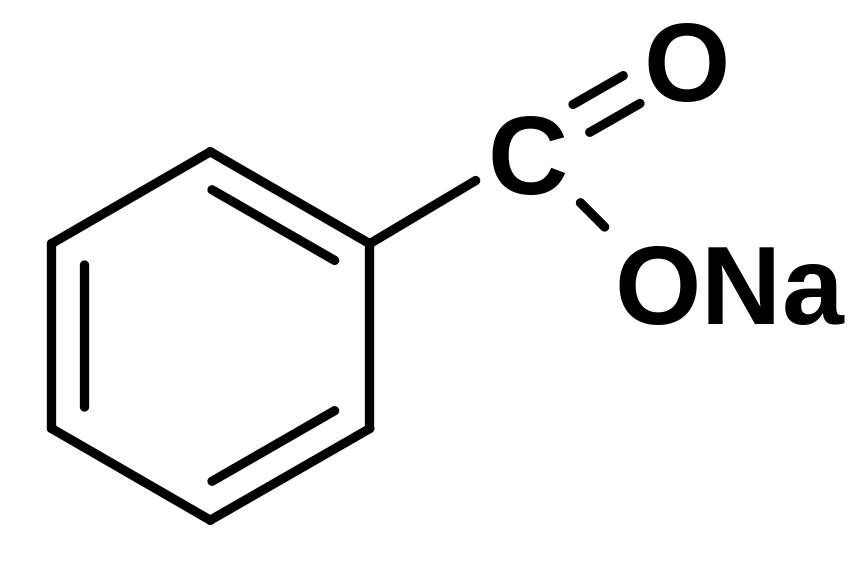
4.22.4.1. Лекарственные вещества, содержащие бензоат-ион:
а) Кислота бензойная б) Натрия бензоат
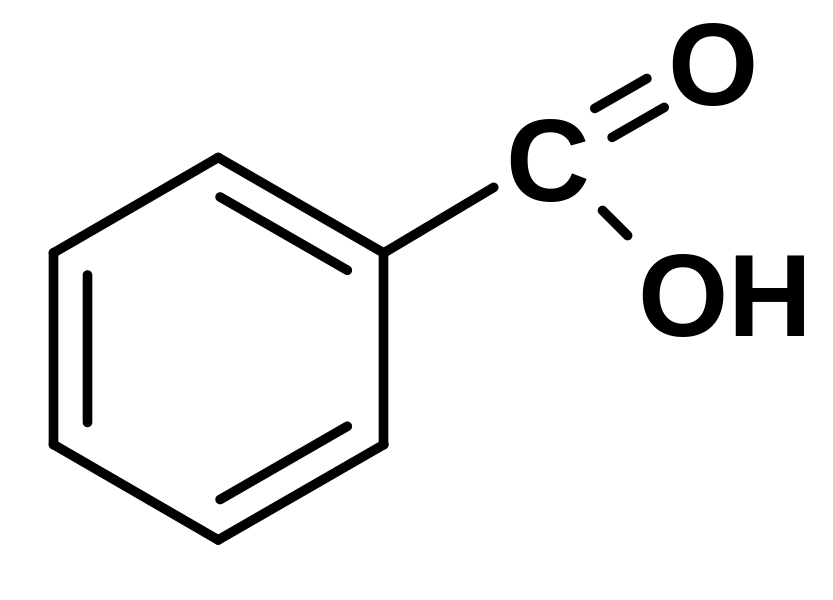
4.22.4.2. Реакция комплексообразования с железа (III) хлоридом
Лекарственные вещества, содержащие бензоат-ион, бензойную кислоту, образуют комплексную соль с раствором железа (III) хлорида:
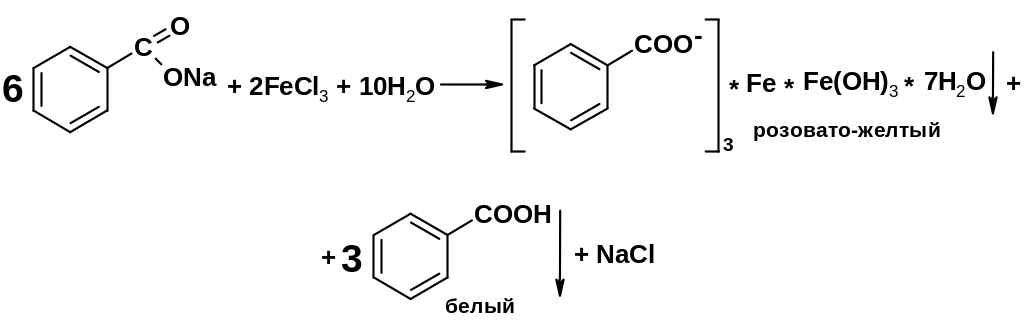
Методика: К 2 мл нейтрального раствора бензоата прибавляют 0,2 мл раствора железа (III) хлорида; образуется розовато-желтый осадок, растворимый в эфире [3.2].
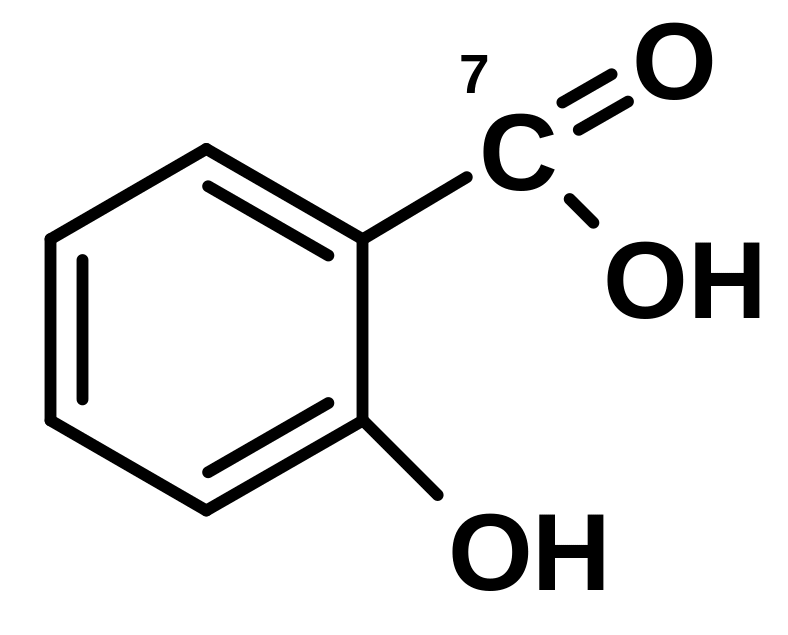
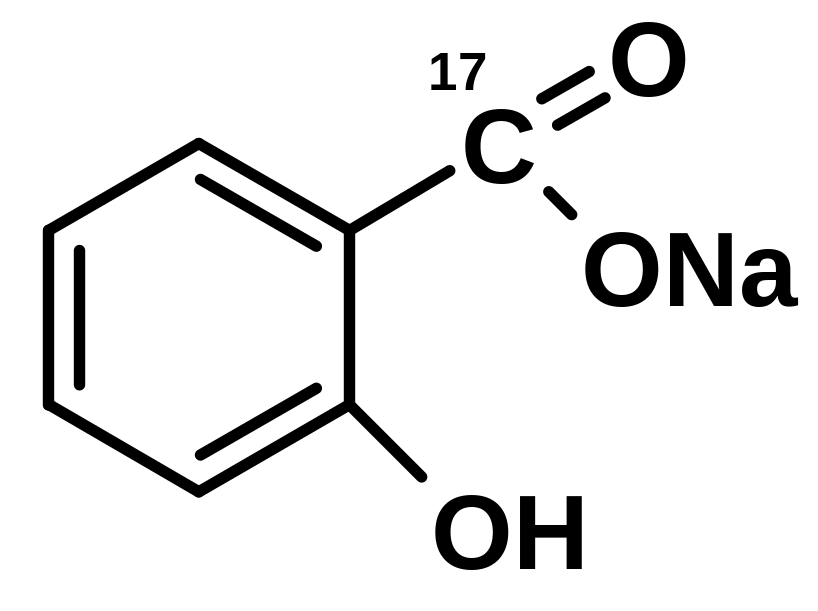
4.22.5. Определение салицилат-иона
Лекарственные вещества, содержащие салицилат-ион, салициловую кислоту образуют комплексную соль с раствором железа (III) хлоридом.
4.22.5.1. Лекарственные вещества, содержащие салицилат-ион:
а) Кислота салициловая |
б) Натрия салицилат |
|
|
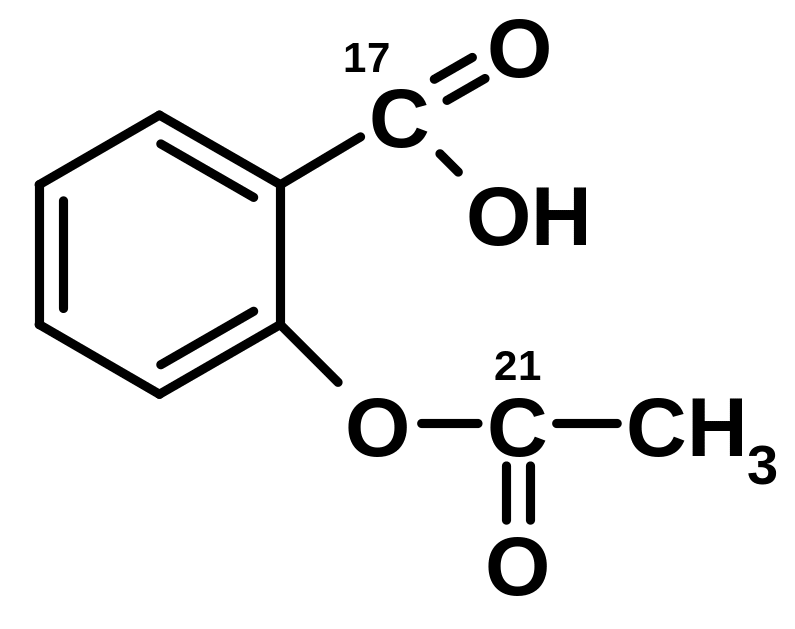
в) Кислота ацетилсалициловая |
г) Пара-аминосалицилат натрия |
|
|
4.22.5.2. Реакция комплексообразования с раствором железа (III) хлорида
При взаимодействии веществ, содержащих салицилат-ион, с раствором железа (III) хлорида образуется комплекс, окрашенный в сине-фиолетовый или красно-фиолетовый цвет:
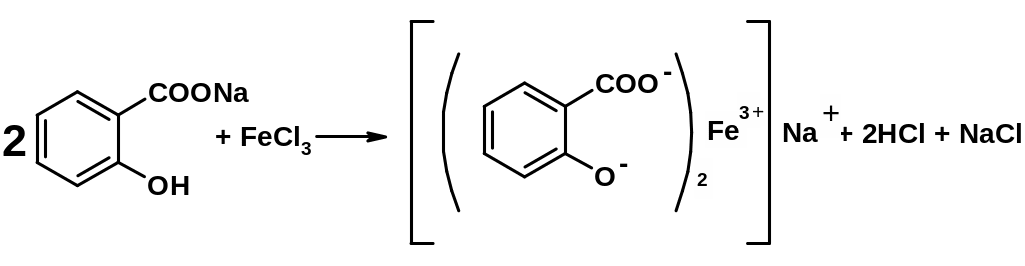
Методика: К 1 мл нейтрального раствора салицилата прибавляют 0,5 мл раствора железа (III) хлорида; образуется комплекс, окрашенный в сине-фиолетовый (рН 4) или красно-фиолетовый (рН > 4) цвет.
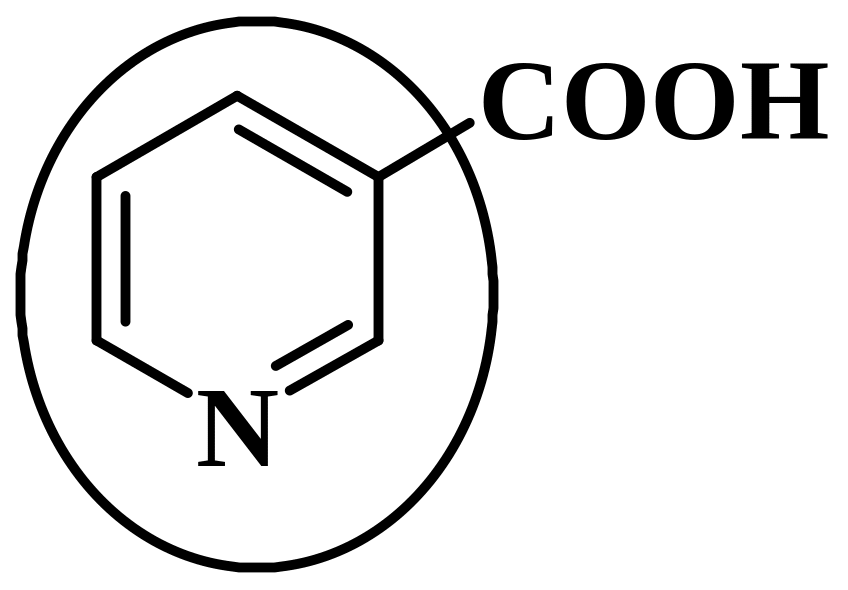
4.23 ИДЕНТИФИКАЦИЯ производных пиридина
Лекарственные вещества, содержащие пиридиновый цикл:
а) Кислота никотиновая
|
б) Изониазид |
|
|
Реакция идентификации производных пиридина со свободными α, α1-положениями основана на получении полиметиновых красителей. Пиридиновое кольцо, как известно, устойчиво к гидролитическому действию кислот и оснований; в то же время цикл четвертичных пиридиниевых солей легко расщепляется под влиянием щелочей. В качестве реагентов, образующих соль пиридиния, применяют обычно 2,4-динитрохлорбензол, бромродан, бромциан, хлорродан [3.8]. Затем при действии щелочи происходит размыкание пиридиниевого цикла и образуется производное глутаконового альдегида, т.е. полиметиновое основание, окрашивающее раствор в буро-красный цвет. Производные глутаконового альдегида – малоустойчивые соединения, которые в результате гидролиза превращаются в глутаконовый альдегид, существующий в двух таутомерных формах. Натриевая соль енольной формы глутаконового альдегида имеет желтую окраску.
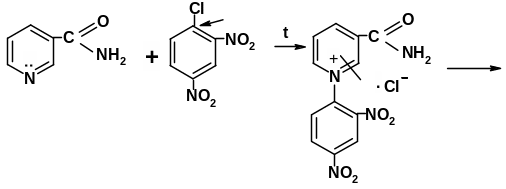
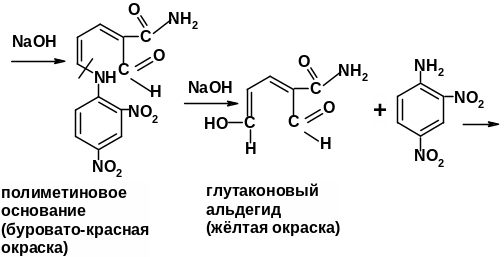
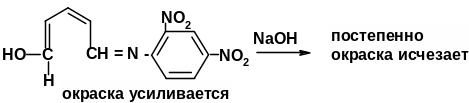
Методика: К 0,01-0,02 г лекарственного вещества (кислоты никотиновой, никотинамида, изониазида) прибавляют 0,05 г 2,4-динитрохлорбензола, 3 мл спирта этилового 95% и кипятят в течение 1 мин. После охлаждения добавляют 2 капли растора натрия гидроксида – появляется желто-бурое или буровато-красное окрашивание.
![]()
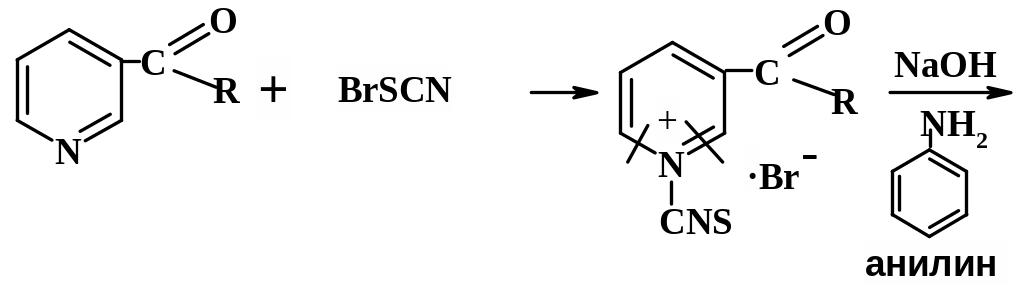

Методика: К 1 мл 1% раствора кислоты никотиновой прибавляют 1 мл раствора роданбромидного реактива, затем 0,02 г прокаина (новокаина), анилина или др. первичного ароматического амина и по каплям раствор гидроксида натрия до нейтральной реакции. Появляется желтое окрашивание.
Приготовление роданбромидного реактива: К 1 мл 0,1 м раствора бромата калия прибавляют 0,05 г калия бромида, 0,1 мл разведенной соляной кислоты и по каплям (до обесцвечивания) 0,1 м раствор роданида аммония [3.7].