
Комплексонометрия
Формула ЭДТА (трилона Б) – Na2C10H14N2O8·2H2O.
1. В каком объеме раствора содержится m г ЭДТА, если молярная концентрация раствора равна с моль/л?
Решение.
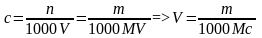 ,
,
где с – молярная концентрация раствора ЭДТА, моль/л; n – количество вещества ЭДТА в растворе, моль; m – физическая масса ЭДТА в растворе, г; 1000 мл/л – пересчетный коэффициент; V – искомый объем раствора, мл; M – молярная масса ЭДТА, г/моль.
2. На титрование V1 мл раствора вещества В израсходовано V2 мл с М раствора ЭДТА. Найти массово-объемную концентрацию вещества В (г/л) в исследуемом растворе.
Решение.
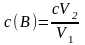 ,
,
где с(B) – молярная концентрация вещества В, моль/л; с – молярная концентрация раствора титранта, моль/л; V1 – объем исходного раствора вещества В, мл; V2 – объем раствора титранта, мл.
 ,
,
где ρ – искомая массово-объемная концентрацию вещества В в исследуемом растворе, г/л; M – молярная масса вещества В, г/моль.
3. К раствору вещества В добавили аммиачный буферный раствор и V1 мл с1 М раствора ЭДТА. Избыток ЭДТА оттитровали V2 мл с2 М раствором второго титранта. Найти массу вещества В в исследуемом растворе.
Решение.
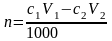 ,
,
где n – количество вещества В в растворе, моль; с1 – молярная концентрация раствора ЭДТА, моль/л; V1 – объем раствора ЭДТА, мл; с2 – молярная концентрация раствора второго титранта, моль/л; V2 – объем раствора второго титранта, мл; 1000 мл/л – пересчетный коэффициент.
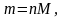
где m – искомая физическая масса вещества В в исследуемом растворе, г; M – молярная масса вещества В, г/моль.
4. Какую массу x-гидрата вещества В, содержащего ω% индифферентных примесей, следует взять для анализа, чтобы на титрование ее потребовалось V мл с М ЭДТА?
Решение.
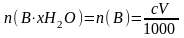 ,
,
где – количество вещества чистого x-гидрата В, моль; n(В) – количество вещества В, моль; с – молярная концентрация раствора ЭДТА, моль/л; V – объем раствора ЭДТА, мл; 1000 мл/л – пересчетный коэффициент.
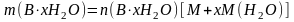 ,
,
где
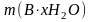 –
физическая масса чистого
x-гидрата
В,
г; M
–
молярная масса
вещества В,
г/моль; x
–
число молекул воды в формульной единице
гидрата; M
(H2O)
– молярная масса
воды,
г/моль.
–
физическая масса чистого
x-гидрата
В,
г; M
–
молярная масса
вещества В,
г/моль; x
–
число молекул воды в формульной единице
гидрата; M
(H2O)
– молярная масса
воды,
г/моль.
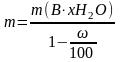 ,
,
где m – искомая физическая масса x-гидрата В, содержащего индифферентные примеси, г; ω – массовая доля индифферентных примесей, %; 100% – пересчетный коэффициент.
5. Какая масса А-ионов содержится в пробе, если после прибавления V1 мл с1 М раствора первого титранта избыток его был оттитрован V2 мл с2 М раствором ЭДТА?
Решение.
,
где n – количество вещества А-ионов в пробе, моль; с1 – молярная концентрация раствора ЭДТА, моль/л; V1 – объем раствора ЭДТА, мл; с2 – молярная концентрация раствора второго титранта, моль/л; V2 – объем раствора второго титранта, мл; 1000 мл/л – пересчетный коэффициент.
где m – искомая физическая масса А-ионов в пробе, г; M – молярная масса А-ионов, г/моль.
6. Растворением навески В·xH2O массой m г приготовили V мл раствора, к V0 мл которого прибавили V1 мл с1 М раствора ЭДТА. На титрование избытка ЭДТА израсходовали V2 мл с2 М раствора второго титранта. Вычислить массовую долю (%) вещества В в образце, определить число молекул воды x в формульной единице кристаллогидрата.
Решение.
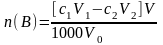 ,
,
где n(В) – количество вещества В в образце, моль; с1 – молярная концентрация раствора ЭДТА, моль/л; V1 – объем раствора ЭДТА, мл; с2 – молярная концентрация раствора второго титранта, моль/л; V2 – объем раствора второго титранта, мл; V – объем исходного раствора образца, мл; 1000 мл/л – пересчетный коэффициент; V0 – объем оттитрованного исходного раствора образца, мл.

где
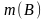 –
физическая масса вещества В
в образце,
г; M
–
молярная масса
вещества В,
г/моль.
–
физическая масса вещества В
в образце,
г; M
–
молярная масса
вещества В,
г/моль.
,
где ω – искомая массовая доля вещества В в образце, %; m – физическая масса навески, г.
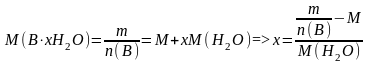 ,
,
где – молярная масса В·xH2O, г/моль; M (H2O) – молярная масса воды, г/моль; x – искомое число молекул воды в формульной единице кристаллогидрата.
7.
Из навески карбонатной породы, содержащей
соли двух металлов, массой m
г получили V
мл раствора. На титрование V0
мл этого раствора пошло V1
мл с1
М
раствора трилона Б. На титрование
 мл того же раствора после отделения
первого металла расходуется V2
мл с2
н.
раствора трилона Б. Найти массовые доли
оксидов обоих металлов в карбонатной
породе.
мл того же раствора после отделения
первого металла расходуется V2
мл с2
н.
раствора трилона Б. Найти массовые доли
оксидов обоих металлов в карбонатной
породе.
Решение.
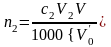 ,
,
где n2 – количество вещества оксида второго металла в навеске карбонатной породы, моль; с,2 – молярная концентрация раствора трилона Б во втором титровании, моль/л; V2 – объем раствора трилона Б во втором титровании, мл; V – объем раствора навески, мл; 1000 мл/л – пересчетный коэффициент; – объем раствора навески после отделения первого металла во втором титровании, мл.
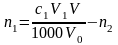 ,
,
где n1 – количество вещества оксида первого металла в навеске карбонатной породы, моль; с,1 – молярная концентрация раствора трилона Б в первом титровании, моль/л; V1 – объем раствора трилона Б в первом титровании, мл; V0 – объем раствора навески в первом титровании, мл.
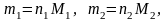
где m1 и m2 – физические массы оксидов первого и второго металлов соответственно в навеске, г; M1 и M2 – молярные массы оксидов первого и второго металлов соответственно, г/моль.
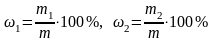 ,
,
где ω1 и ω2 – искомые массовые доли оксидов первого и второго металлов соответственно в карбонатной породе, %; m – физическая масса навески карбонатной породы, г.
8. На титрование пробы (V мл) анализируемого раствора, содержащего соли двух металлов, затрачено V1 мл с титром T г/мл. После полного осаждения катионов первого металла из такой же пробы раствора (V мл) избытком раствора осадителя и отфильтровывания осадка фильтрат оттитровали V2 мл такого же раствора ЭДТА. Написать уравнения всех проведенных при анализе реакций. Найти массу каждой соли (г) в пробе анализируемого раствора.
Решение.
 ,
,
где с – молярная концентрация раствора ЭДТА, ммоль/л; T – титр раствора ЭДТА, г/мл; M – молярная масса ЭДТА, г/моль.
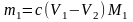 ,
,
где m1 – искомая физическая масса соли первого металла в пробе, моль; V1 – объем раствора ЭДТА в первом титровании, мл; V2 – объем раствора ЭДТА во втором титровании, мл; M1 – молярная масса соли первого металла, г/моль.
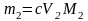 ,
,
где m1 – искомая физическая масса соли второго металла в пробе, моль; M2 – молярная масса соли второго металла, г/моль.
