
- •§ 1.1 Основные положения ст.Ф.
- •§ 1.2 Флуктуации и средние значения
- •§ 1.3 Основной постулат статистической физики
- •§ 1.4 Статистический вес (1.4.1) и энтропия (1.4.2)
- •§ 2.1 Состояние макросистемы и процесс
- •§ 2.2 Первое начало термодинамики. Химический потенциал и внутренние параметры
- •§ 2.3 Второе и третье начала термодинамики. Теплоёмкость
- •§ 3.1 Распределение Гиббса
- •§ 3.2 Квантовые статистики Ферми-Дирака и Бозе-Эйнштейна
- •§ 3.2.2. Статистика Бозе-Эйнштейна
- •§ 3.3 Плотность состояний
- •§ 4.1 Переход от квантовых распределений к классическому
- •§ 4.2 Критерий вырождения для квазисвободных частиц
- •§ 4.3 Распределение Максвелла – Больцмана
- •§ 4.4 Распределение Максвелла (р.М.)
- •§ 4.5 Формула Больцмана
§ 2.3 Второе и третье начала термодинамики. Теплоёмкость
По
Клаузиусу отношение
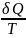 определяет
приращение энтропии dS.
определяет
приращение энтропии dS.
S
– функция
состояния системы;
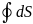 = 0.
= 0.
Условие δQ = 0 (адиабатический процесс) эквивалентно условию
S = const
Конечное изменение энтропии в равновесном, обратимом процессе
S = S2
– S1
=
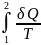 (2.3′)
(2.3′)
Соответственно
для кругового процесса:
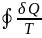 = 0.
= 0.
2.3.1Закон возрастания энтропии. Второй з-н термодинамики.
Если замкнутая система некоторое время находилась в неравновесном
состоянии, то вероятным ходом будет переход в состояние с большим статистическим весом, т.е. с большей энтропией.
Энтропия
замкнутой системы может либо оставаться
неизменной, либо монотонно возрастать,
достигая максимального равновесного
значения
(
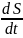
0).
0).
Символически
так:
S
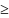 0, (2.3)
0, (2.3)
где равенство для равновесной системы.
Для целой системы, состоящей из подсистем при наличии флуктуаций
δS1 + δS2 = δS 0
Роль (2.3) очень велика. Он показывает направленность поведения системы.
Втрое начало в термодинамике эквивалентно утверждению о невозможности вечного двигателя второго рода: Невозможно создать устройство совершающее положительную работу без изменений в окружающих телах. Или: невозможен самопроизвольный переход теплоты от менее нагретого тела к более нагретому телу.
2.3.2. Теплоемкость
Величину
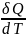 = C называют
теплоёмкостью. Она определяется как
количество теплоты, которое необходимо
сообщить системе, чтобы увеличить её
температуру на один градус.
= C называют
теплоёмкостью. Она определяется как
количество теплоты, которое необходимо
сообщить системе, чтобы увеличить её
температуру на один градус.
Различают:
( v=
Cv
и (
р=
Cр
и удельные
теплоёмкости: ср
=
v=
Cv
и (
р=
Cр
и удельные
теплоёмкости: ср
=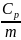 и
сv
=
и
сv
=
и молярные:
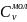 =
=
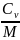 и
и
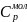 =
=
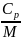 ,
где М – масса моля.
,
где М – масса моля.
Выражение (2.3′) можно записать
S =
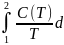 Т
Т
Теплоёмкость идеального газа
Для V = const
δA′ = pdV =0, dℇ =dQ
Для одноатомного газа
ℇ =
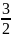 kNT
(
v=
Cv
kN
=
ν
R
=
R
kNT
(
v=
Cv
kN
=
ν
R
=
R
+ R =
- закон
Майера.
=
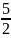 R
R
Отношение
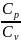 = γ
- постоянная
адиабаты
pV
γ
= const
= γ
- постоянная
адиабаты
pV
γ
= const
γ
=
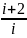 ,
где i
- число степеней свободы.
,
где i
- число степеней свободы.
2.3.3. Объединённая форма первого и второго начал термодинамики.
Если система не успевает приходить в равновесие
dS = dS1 + dS2 (*)
dS1 = и dS2 – приращение за счёт перехода к равновесности (dS2 0)
Тогда: S = S2 - S1
Подставляя dS из (*) в (2.2) получим:
dℇ
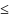 Т dS
-
pdV + μdN
(2.4)
Т dS
-
pdV + μdN
(2.4)
Здесь знак = относится к обратимым, а знак к необратимым процессам.
2.3.4. Третье начало (теорема Нернста)
Энтропия может быть установлена только с точностью до постоянной.
SСист.
=
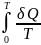 +
S0
+
S0
Нернст и затем Планк, исходя из опыта, показали, что
SСист. → 0, когда T→ 0 (2.5)
Док-во основано на том, что в основном состоянии (с наименьшей энергией) Ω =1 и S =0.
2.3.5. Условия равновесия контактирующих систем
Пусть имеем две системы, которые рассматриваем как подсистемы равновесной системы. В силу аддитивности:
ℇ = ℇ1 + ℇ2 = const
V = V1 + V2 = const
N = N1 + N2 = const
Таже: S = Smax
Эти величины могут флуктуировать, но dℇ1 = - dℇ2
Анализ показывает, что условием теплового равновесия является
Т1 = Т2 (2.6)
для всех частей макросистемы.
В более общем случае термодинамического равновесия требуется, чтобы
р1 = р2 и μ1 = μ2
т.е. равенство давлений и термодинамических потенциалов контактирующих тел.
Гл. 3 ФУНКЦИИ РАСПРЕДЕЛЕНИЯ В РАВНОВЕСНЫХ СИСТЕМАХ
Нахождение таких функций - основная задача статистики.
