
- •Кислородсодержащие органические соединения спирты
- •Физические свойства спиртов
- •1. Кислотно-основные свойства
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •5. Дегидратация спиртов
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •6. Реакции окисления
- •7. Каталитическое дегидрирование
- •Физические свойства фенола и циклогексанола
- •Альдегиды и кетоны
- •Названия некоторых альдегидов
- •Названия некоторых кетонов
- •Физические свойства некоторых альдегидов и кетонов
- •Карбоновые кислоты
- •Названия некоторых карбоновых кислот
- •Физические свойства некоторых одноосновных карбоновых кислот
- •Азотсодержащие органические соединения
- •Физические свойства некоторых аминов
- •– Образование сложных эфиров (этерификация):
- •Азотсодержащие гетероциклические соединения
- •Нуклеиновые кислоты
Азотсодержащие органические соединения
А М И Н Ы
Амины – органические производные аммиака, которые можно рассматривать как продукты замены атомов водорода аммиака на углеводородные радикалы.
В
зависимости от числа замещенных на
радикалы атомов водорода аммиака
различают первичные (R–NН2),
вторичные (R–NН–R′)
и третичные
(
 )
амины.
)
амины.
Это создает дополнительные возможности для изомерии. Вспомним, что углеводород бутан имеет 2 изомера, производящиеся от него спирты – 4, аминов же с формулой С4Н11N имеется 8.
Названия первичных аминов строят из названий углеводородов или радикалов, добавляя к ним окончание –амин. Названия вторичных и третичных аминов чаще всего образуют по принципам рациональной номенклатуры, перечисляя имеющиеся в соединении радикалы. Для примера приведем названия упоминавшихся выше изомерных аминов состава С4Н11N.
Первичные амины:
СН3–CH2–CH2–CH2–NH2 н-бутиламин, бутанамин-1
СН3–СН(СН3)–СН2–NН2 изобутиламин, 2-метилпропанамин-1
СН3–СН2–СН(NН2)–СН3 втор-бутиламин, бутанамин-2
(СН3)3С–NН2 трет-бутиламин, 2-метилпропанамин-2
Вторичные амины:
СН3–СН2–СН2–NН–СН3 метилпропиламин, N-метилпропанамин-1
СН3–СН(СН3)–NН–СН3 изопропилметиламин, N-метилпропанамин-2
СН3–СН2–NH–СН2–СН3 диэтиламин, N-этилэтанамин
Третичный амин:
СН3–СН2–N(СН3)2 диметилэтиламин, N,N-диметилэтанамин
Физические свойства
Простейшие алифатические амины (метиламин, диметиламин, триметиламин, этиламин) – газообразные вещества, амины с бóльшим числом атомов углерода – жидкости, а начиная с С15Н25NН2 – твердые вещества. Запах низших аминов напоминает запах аммиака. Первые представители ряда хорошо растворимы в воде, по мере роста углеродного скелета растворимость в воде уменьшается. Физические свойства некоторых аминов приведены в табл. 8.
Таблица 8
Физические свойства некоторых аминов
Амин |
Формула |
Т. пл., С |
Т. кип., С |
Относительная плотность |
Метиламин |
СН3NН2 |
– |
–7,6 |
0,769 (при –79С) |
Диметиламин |
(СН3)2NН |
– |
+7 |
0,680 (при 0С) |
Триметиламин |
(СН3)3N |
–117 |
+3,5 |
0,671 (при 0С) |
Этиламин |
С2Н5NН2 |
– |
16,6 |
0,706 (при 0С) |
Диэтиламин |
(С2Н5)2NH |
–50 |
56 |
0,711 |
Пропиламин |
С3Н7NН2 |
– |
49 |
0,714 |
Бутиламин |
С4Н9NH2 |
– |
78 |
0,742 |
Гексиламин |
С6Н13NH2 |
–19 |
130 |
0,763 |
Анилин |
С6Н5NH2 |
–6 |
184 |
1,027 |
Метиланилин |
С6Н5NНСН3 |
– |
196 |
0,989 |
Диметиланилин |
С6Н5N(СН3)2 |
+2,5 |
194 |
0,956 |
Дифениламин |
(С6Н5)2NН |
+54 |
302 |
1,158 |
Способы получения
Способы получения аминов весьма разнообразны, но главными являются алкилирование аммиака (реакция Гофмана) и восстановление нитросоединений. Первая из этих реакций применяется главным образом для получения аминов жирного и жирноароматического рядов, вторая служит основным путем синтеза ароматических аминов.
1. Алкилирование аммиака. При этом происходит постепенное замещение атомов водорода аммиака на углеводородные радикалы с образованием смеси аминов всех степеней замещения (в виде солей), например:
NH3
+ C2H5Br
C2H5N+H3
Br–
![]() C2H5NH2
+ NH4Br
C2H5NH2
+ NH4Br
C2H5NH2
![]() (C2H5)2N+H2
Br–
(C2H5)2NH
+ NH4Br
(C2H5)2N+H2
Br–
(C2H5)2NH
+ NH4Br
(C2H5)2NH (C2H5)3N+H Br– (C2H5)3N + NH4Br
(C2H5)3N (C2H5)4N+H Br–
Эта реакция – один из классических примеров нуклеофильного замещения: вследствие поляризации связи С–Br на атоме углерода возникает положительный заряд, на который и направляется атака аммиака, проявляющего нуклеофильные свойства вследствие наличия неподеленной электронной пары у атома азота.
При алкилировании аммиака по Гофману образуется смесь солей первичных, вторичных, третичных аминов и четвертичных аммониевых оснований. Поэтому реакция Гофмана не очень удобна для получения первичных аминов. Чаще ее применяют для получения вторичных и третичных аминов, например монометил- и диметиланилинов из анилина. В качестве более дешевого алкилирующего средства при промышленном проведении этой реакции вместо галогенпроизводных используют метиловый спирт. Реакция идет при нагревании под давлением:
![]()
Для получения первичных аминов алкилируют не сам аммиак, а некоторые его производные.
2. Восстановление ароматических нитросоединений. Эта реакция впервые осуществлена Н. Н. Зининым (1842 г.). Действуя на нитробензол сульфидом аммония, он получил анилин:
С6Н5NO2 + 3(NH4)2S C6H5NH2 + 6NH3 + 3S + 2H2O
Для превращения нитросоединений в амины могут быть использованы и другие восстановители – олово, цинк, железо в кислой среде, хлорид олова (II), водород в присутствии катализаторов. Восстановление можно осуществить и электрохимически.
Наибольшее значение в технике получило восстановление нитробензола в анилин действием железа в присутствии соляной кислоты. Суммарное уравнение процесса:
4С6Н5NO2
+ 9Fe + 4H2O
![]() 4C6H5NH2
+ 3Fe3O4
4C6H5NH2
+ 3Fe3O4
В лабораторных условиях восстановление нитросоединений до аминов часто проводят оловом и соляной кислотой:
C6H5NO2 + 3Sn + 7HCl C6H5NH2HCl + 3SnCl2 + 2H2O
Амины – органические основания
Являясь органическими производными аммиака, амины сохраняют главные его химические особенности. В частности, подобно аммиаку, амины проявляют свойства оснований. Это обнаруживается по щелочной реакции их водных растворов:
NH3 + H2O ⇄ NH4+ + OH–; RNH2 + H2O ⇄ RNH3+ + OH–
По мере роста углеводородного остатка растворимость аминов в воде уменьшается. Поэтому высшие амины уже не дают щелочной реакции. Однако и они сохраняют свойства оснований: способны образовывать с кислотами соли. Причина основных свойств аминов – неподеленная электронная пара атома азота, за счет которой атом азота аммиака или аминов может присоединять ион водорода с образованием солей аммония или алкиламмония:

метиламин хлорид метиламмония
Природа радикала, с которым связана аминогруппа, оказывает влияние на основные свойства аммиака. Чем больше атомов углерода в радикале, тем слабее основные свойства аминов. Ароматические амины являются гораздо более слабыми основаниями, чем амины жирного ряда. Это объясняется тем, что неподеленная электронная пара аминного азота взаимодействует с подвижными -электронами ароматического ядра. Распределение электронной плотности в анилине можно условно выразить так:
 или
или

Аминогруппа в свою очередь оказывает влияние на ароматическое ядро: как электронодонорный заместитель она повышает электронную плотность в ядре, облегчая тем самым реакции электрофильного замещения. Анилин легко бромируется, образуя уже при действии бромной воды триброманилин:
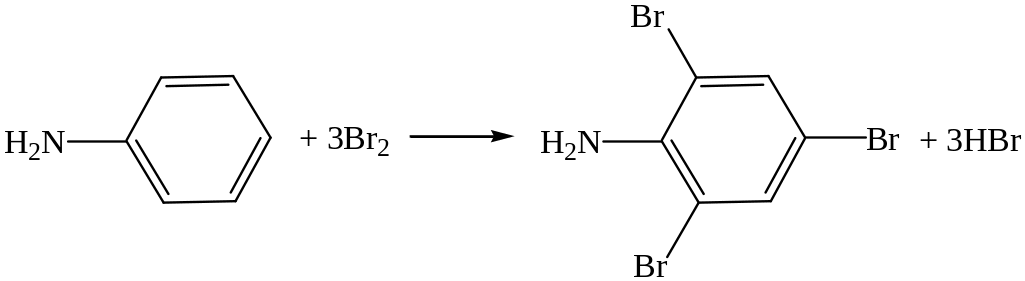
Анилин легко окисляется. Поэтому при хранении он обычно темнеет, хотя в совершенно чистом виде бесцветен. При действии хлорной извести СаСl(ClO) на водный раствор анилина (растворимость его в воде 3,6%) в результате окисления появляется интенсивное фиолетовое окрашивание. Эта реакция служит качественной пробой на анилин.
Анилин применяют для получения красителей, лекарственных препаратов, вулканизаторов и стабилизаторов для резины, пластмасс и др.
Другие химические свойства аминов
Неподеленная электронная пара атома азота не только обусловливает основность аминов, но и определяет многие другие их свойства. Реакции аминов чаще всего начинаются со взаимодействия свободной электронной пары с электрофильными реагентами, т. е. веществами, реакционный центр которых имеет положительный заряд (недостаток электронов). Некоторые реакции на этом и заканчиваются, в других вслед за присоединением следует стадия отщепления. Важнейшие из реакций аминов следующие.
Присоединение алкилгалогенидов. Образующиеся соли аммония устойчивы, и реакция на этом завершается:
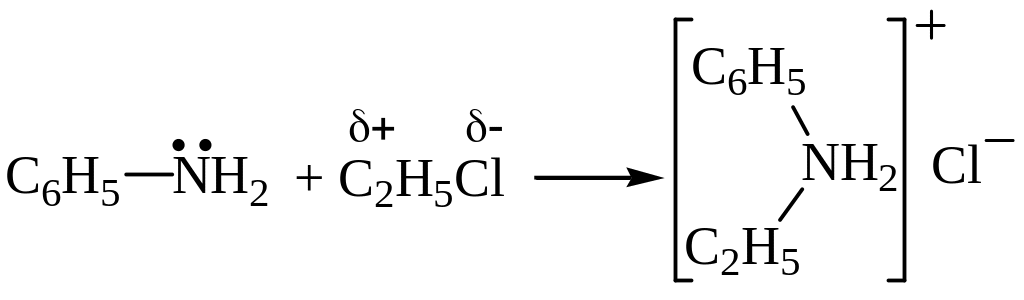
хлорид этилфениламмония
(СН3)3N: + СН3I [(CH3)4N]+I–
иодид тетраметиламмония
Действуя на образовавшиеся соли основаниями, можно выделить в свободном виде соответствующие амины и четырехзамещенные аммониевые основания:
[С6Н5–NH2–С2Н5]+Сl– + КОН C6H5–NH–С2Н5 + Н2О + КСl
этиланилин
[(CH3)4N]+I– + AgOH [(СН3)4N]+OH– + AgI
гидроксид тетраметиламмония
Проведя последовательно обе реакции, получают из первичного амина – вторичный, из вторичного – третичный, из третичного– четвертичное аммониевое основание. Результатом является введение к атому азота нового углеводородного остатка вместо атома водорода, т. е. алкилирование амина.
Ацилирование. При взаимодействии аминов с хлорангидридами, ангидридами или сложными эфирами образуются амиды кислот. Процесс начинается так же, как и алкилирование, со взаимодействия неподеленной электронной пары атома азота с электрофильным центром реагента:

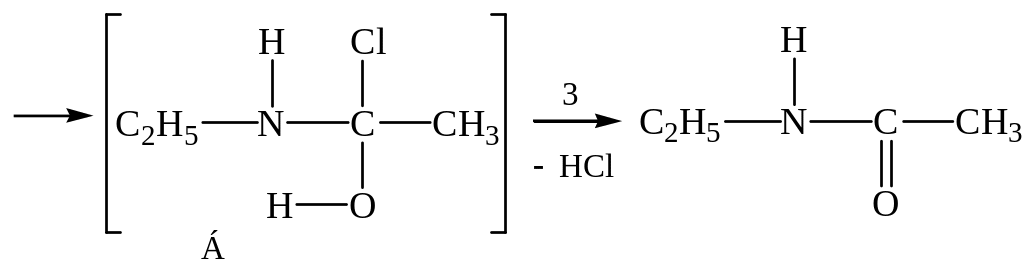
этиламид уксусной кислоты
Продукт присоединения образуется в результате взаимодействия неподеленной электронной пары азота с карбонильным углеродом, на котором вследствие поляризации связи С=О имеется частичный положительный заряд. При этом электронная пара азота переходит в совместное владение с карбонильным углеродом. Но последний уже до реакции имел заполненный октет на внешней электронной оболочке и принять еще пару электронов не может. Поэтому одновременно с установлением связи между азотом и карбонильным углеродом подвижная электронная пара -связи С=О оттесняется на атом кислорода, который приобретает таким образом отрицательный заряд (стадия 1). В создавшейся структуре (промежуточный продукт А) на близком расстоянии друг от друга находятся положительно заряженный (азот) и отрицательный (кислород) центры. Естественное стремление к нейтрализации осуществляется путем перехода иона водорода от азота к кислороду, обладающему к тому же большей электроотрицательностью (стадия 2). Однако соединения, подобные промежуточному продукту Б, которые имеют у одного атома углерода гидроксильную группу и галоген, неустойчивы. Стабилизация происходит в результате отщепления хлороводорода (стадия 3). Окончательным результатом реакции является введение к азоту ацильной группы вместо атома водорода, т. е. ацилирование амина.
Реакции с альдегидами и кетонами. Эти реакции тоже идут через промежуточные продукты присоединения (показаны в квадратных скобках). Стабилизация осуществляется разными путями для первичных и вторичных аминов (третичные амины в реакцию не вступают).
Из первичных аминов и альдегидов (кетоны вступают в эту реакцию труднее) с отщеплением воды образуются так называемые основания Шиффа (имины, азометины):


основание Шиффа
Из вторичных аминов и кетонов образуются енамины, например:


Продукт присоединения содержит здесь только один атом водорода у азота; при стабилизации промежуточного продукта этот атом переходит к кислороду, а в образовании воды участвует подвижный водород, стоящий у -углеродного атома.
Реакции с азотистой кислотой. Практически для проведения этих реакций берут соль азотистой кислоты и сильную минеральную кислоту.
Несмотря на общность механизма для первичных, вторичных, третичных, жирных и ароматических аминов, конечные продукты оказываются разными.
Первичные ароматические амины превращаются при действии азотистой кислоты в соли диазония (в данном пособии они не рассматриваются). Первичные алифатические амины дезаминируются с выделением азота и образованием спиртов или непредельных углеводородов. Вторичные амины (алифатические и ароматические) при действии азотистой кислоты дают N-нитрозамины:
R2HN: + НО–N=О R2N–N=O + Н2О
Третичные амины жирного ряда с азотистой кислотой образуют лишь непрочные соли.
Примеры решения задач
Задача 14. Напишите общие уравнения реакций восстановления нитросоединений в амины а) в кислой среде; б) в щелочной среде; в) в газовой фазе.
Решение. а). Восстановление нитросоединений в растворе удобно проводить водородом в момент выделения, который является сильным восстановителем. В кислой среде для этого используют цинк или железо:
RNO2 + 3Zn + 7HCl RNH3Cl + 3ZnCl2 + 2H2O
RNO2 + 7H+ + 6e RNH3+ + 2H2O Zn Zn2+ + 2e |
1 3 |
Образующийся амин реагирует с избытком соляной кислоты, образуя соль аммониевого типа RNH3Cl.
б). В щелочной среде для получения водорода в момент выделения используют алюминий:
RNO2 + 2Al + 2NaOH + 4H2O RNH2 + 2Na[Al(OH)4]
RNO2 + 4H2O + 6e RNH3+ + 6OH– Al + 4OH– [Al(OH)4]– + 3e |
1 2 |
в). В газовой фазе восстановление проводят водородом при 250–350С на никелевом или медном катализаторе:
RNO2 + 3H2 RNH2 + 2H2O.
А М И Н О К И С Л О Т Ы
Аминокислоты – соединения, содержащие в молекуле амино- и карбоксильную группы.
-Аминокислоты, т. е. аминокислоты, имеющие в молекуле аминогруппу у второго атома углерода (в -положении), играют роль структурных элементов в белках. Природные аминокислоты отличаются друг от друга строением боковых групп (радикалов). Найденные в белках аминокислоты принято делить на две категории:
1. Постоянно встречающиеся – 18 аминокислот, амиды аспарагиновой и глутаминовой кислот (аспарагин и глутамин):


EMBED
ChemDraw.Document.6.0
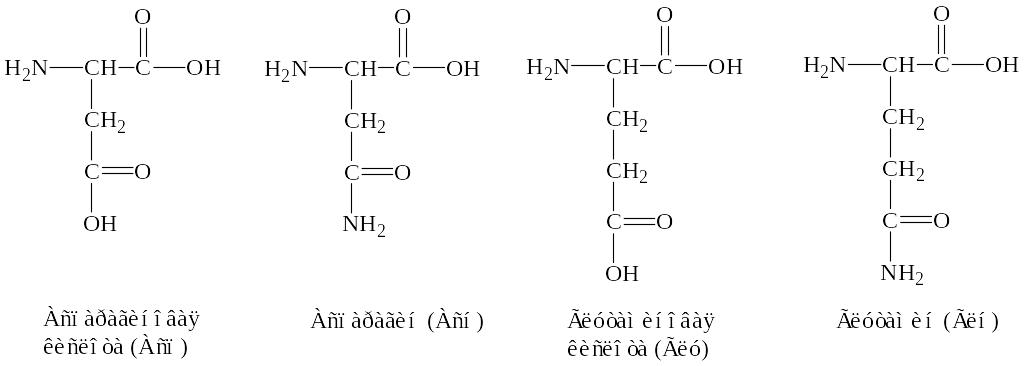


2. Иногда встречающиеся: орнитин, -аминоизомасляная, -карбоксиглутаминовая кислоты и ряд других производных постоянно встречающихся аминокислот:

По химическому составу аминокислоты классифицируют на следующие группы.
1). Моноаминомонокарбоновые – глицин, аланин, серин, цистеин, лейцин, изолейцин, валин, метионин.
2). Моноаминодикарбоновые – аспарагиновая и глутаминовая кислоты.
3). Диаминомонокарбоновые – лизин, орнитин.
4). Ароматические – фенилаланин, тирозин.
5). Гетероциклические – триптофан, гистидин.
По природе радикала аминокислоты делят на:
1). Неполярные (гидрофобные) – аланин, лейцин, изолейцин, валин, пролин, триптофан, метионин, фенилаланин.
2). Полярные, но незаряженные – серин, цистеин, тирозин, треонин, аспарагин, глутамин, глицин.
3). С отрицательными (кислыми) радикалами – аспарагиновая и глутаминовая кислоты.
4). С положительными (основными) радикалами – лизин, орнитин, аргинин, гистидин.
Химические свойства аминокислот
1. Амфотерность. В водных растворах молекулы аминокислот находятся в виде биполярных ионов, проявляющих как кислотные, так и основные свойства:

2. Образование пептидов:
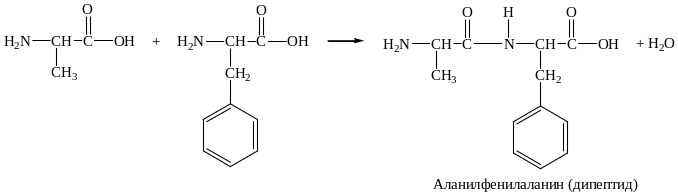
3. Реакции по карбоксильной группе
– Реакции солеобразования – взаимодействие с металлами, основными оксидами, щелочами:
2 H2N–СН2–СООН + Mg (Н2N–СН2–СОО)2Мg + Н2;
H2N–СН2–СООН + NаОН H2N–СН2–СООNа + Н2О;
2 H2N–СН2–СООН + CuО (Н2N–СН2–СОО)2Сu + Н2О.
