
- •Кислородсодержащие органические соединения спирты
- •Физические свойства спиртов
- •1. Кислотно-основные свойства
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •5. Дегидратация спиртов
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •6. Реакции окисления
- •7. Каталитическое дегидрирование
- •Физические свойства фенола и циклогексанола
- •Альдегиды и кетоны
- •Названия некоторых альдегидов
- •Названия некоторых кетонов
- •Физические свойства некоторых альдегидов и кетонов
- •Карбоновые кислоты
- •Названия некоторых карбоновых кислот
- •Физические свойства некоторых одноосновных карбоновых кислот
- •Азотсодержащие органические соединения
- •Физические свойства некоторых аминов
- •– Образование сложных эфиров (этерификация):
- •Азотсодержащие гетероциклические соединения
- •Нуклеиновые кислоты
Физические свойства некоторых одноосновных карбоновых кислот
Кислота |
Формула |
Т. пл., С |
Т. кип., С |
Относительная плотность |
Константа диссоциации в воде при 25С, Ка10–5 |
Муравьиная |
НСООН |
+8,4 |
100,7 |
1,22 |
17,7 |
Уксусная |
СН3СООН |
+16,6 |
118,1 |
1,049 |
1,75 |
Пропионовая |
С2Н5СООН |
–22,0 |
141,1 |
0,99 (при 15С) |
1,3 |
Масляная |
С3Н7СООН |
–7,9 |
163,5 |
0,96 |
1,5 |
Изомасляная |
(СН3)2СНСООН |
–47,0 |
154,5 |
0,95 |
1,4 |
Валериановая |
С4Н9СООН |
–34,5 |
187,0 |
0,94 |
1,6 |
Капроновая |
С5Н11СООН |
–3,9 |
205,8 |
0,92 |
1,32 |
Энантовая |
С6Н13СООН |
–7,5 |
223,5 |
0,918 |
1,28 |
Пальмитиновая |
С15Н31СООН |
+64,0 |
390 (разл.) |
0,84 (при 80С) |
– |
Стеариновая |
С17Н35СООН |
+69,4 |
360 (разл.) |
0,84 (при 80С) |
– |
Циклопентанкарбоновая |
С5Н9СООН |
–4 |
215 |
1,05 |
– |
Циклогексанкарбоновая |
С6Н11СООН |
+31 |
232 |
1,03 (при 34С) |
– |
Бензойная |
С6Н5СООН |
122,0 |
249,0 |
– |
6,5 |
Фенилуксусная |
С6Н5СН2СООН |
76,7 |
265 |
– |
5,6 |
Водородные связи в кислотах отличаются большей прочностью, чем в спиртах, так как связь О–Н в молекулах кислот более поляризована. Ассоциация молекул может быть линейной, но более характерна циклическая – димерная ассоциация. В таких димерах межъядерное расстояние между двумя атомами кислорода равно 0,27 нм (как и в ассоциированных спиртах); атомы водорода удалены от атомов кислорода на разные расстояния:
 линейная
ассоциация
линейная
ассоциация
 димерная
ассоциация
димерная
ассоциация
Не только в твердом и жидком состояниях, но даже в газообразном состоянии и в растворах в углеводородах, большая часть кислот находится в ассоциированном состоянии в виде димеров. Только при высоких температурах димеры распадаются на мономеры.
Из табл. 7 видно, что с увеличением углеводородного радикала температуры кипения плавно возрастают. Температуры плавления в общем также возрастают, но наблюдается своеобразное чередование: каждая кислота с четным числом углеродных атомов в молекуле плавится при более высокой температуре, чем два ее соседа с нечетным числом атомов углерода. Кислоты с нормальной цепью имеют более высокие температуры кипения, чем их изомеры с разветвленной цепью. С увеличением углеводородного радикала плотность кислот уменьшается. Плотность циклических кислот больше, чем ациклических.
Низшие кислоты обладают острым кислым запахом, средние (С4–С8) имеют неприятный прогорклый запах. Высшие жирные (от С8) и ароматические кислоты запаха не имеют.
Низшие кислоты хорошо растворяются в воде. С увеличением углеводородного остатка растворимость в воде уменьшается. Углеводородный остаток гидрофобен (отталкивает воду, как и углеводороды). Высшие жирные кислоты, начиная от С9, в воде практически нерастворимы. Однако все кислоты растворяются в водных растворах щелочей, образуя соли. Высшие кислоты, как и углеводороды, хорошо растворимы в эфире и бензоле.
Кристаллы высших жирных кислот (например, стеариновой) обладают скользкостью (жирные на ощупь).
Строение карбоксильной группы. Химические свойства
Карбоксильная группа формально представляет собой сочетание групп =С=О и –ОН. Вследствие близкого расположения этих групп они оказывают друг на друга сильное влияние, поэтому карбоновые кислоты отличаются по свойствам как от альдегидов, так и от спиртов.
Гидроксильная группа кислот легче отщепляет ион Н+, чем гидроксильная группа спиртов. Причиной усиления кислотности является влияние полярной карбонильной группы. Карбонильный атом С, несущий положительный заряд, стремится погасить дефицит электронов, притягивая неподеленную электронную пару гидроксильного атома О. Последняя взаимодействует с -связью С=О (р--сопряжение):
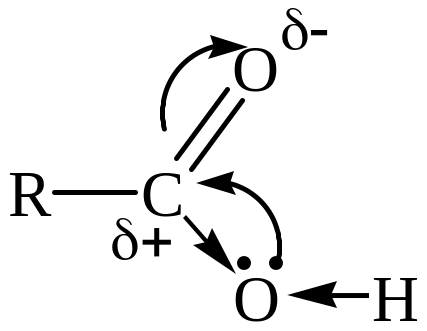
Вследствие этого связь углерод – гидроксильный кислород упрочняется, а связь О–Н поляризуется. Поэтому для данных соединений характерны кислотные свойства и не характерны основные.
Карбоновые кислоты диссоциируют с образованием карбоксилат-иона и иона водорода; в водном растворе существует равновесие:
RCOOH ⇄ RCOO– + H+
Константа равновесия является константой кислотности Ка («a» –от англ. acid – кислота); служит для сравнения силы кислот (см. табл. 7):
![]()
Водные растворы кислот изменяют окраску индикаторов. Хотя кислотные свойства у карбоновых кислот выражены сильнее, чем у спиртов и воды, по сравнению с сильными минеральными кислотами – это слабые кислоты (исключением является муравьиная кислота – кислота средней силы).
На силу кислот оказывает влияние радикал, связанный с карбоксильной группой: чем он больше, тем слабее кислота. Самой сильной из карбоновых кислот является муравьиная. Это можно понять, приняв во внимание, что алкильные группы, обладая электроноотталкивающими свойствами, уменьшают заряд на атоме углерода карбоксильной группы и тем самым – его влияние на группу ОН. Введение в радикал, особенно в -положение, электронопритягивающих групп усиливает кислотные свойства. Наличие двойной связи в ,-положении значительно повышает силу карбоновых кислот, облегчает образование карбоксилат-иона. Ароматические кислоты сильнее алифатических; так, бензойная кислота С6Н5СООН сильнее уксусной.
Для кислот наиболее типичны реакции, связанные с кислотными свойствами, т. е. реакции, которые сопровождаются разрывом связи кислород–водород, а также реакции замещения гидроксильной группы. Для остальной части молекулы возможны реакции, обусловленные ее структурой – наличием кратной связи, ароматического кольца, других функциональных групп.
Рассмотрим важнейшие реакции кислот.
1. Образование солей. Карбоновые кислоты легко реагируют с основаниями, основными оксидами, активными металлами. При этом атом водорода карбоксильной группы замещается металлом и образуются соли:
RCOOH + NaOH RCOONa + Н2О; 2RCOOH + Mg (RCOO)2Mg + Н2
Соли карбоновых кислот легко гидролизуются, как и вообще соли слабых кислот. Поэтому водные растворы солей щелочных металлов имеют щелочную реакцию:
СН3СОО– + Н2О ⇄ СН3СООН + ОН–
Минеральные кислоты, как более сильные, вытесняют карбоновые кислоты из их солей:
СН3СООNa + НСl СН3СООН + NaСl
Карбоновые кислоты, за исключением муравьиной кислоты, устойчивы к действию концентрированных минеральных кислот.
2. Образование функциональных производных. При замещении гидроксильной группы различными группами можно получать функциональные производные кислот – ангидриды, галогенангидриды, сложные эфиры, амиды:
 ангидрид
уксусной кислоты
ангидрид
уксусной кислоты

хлорангидрид уксусной кислоты
Сложные эфиры получают реакцией этерификации, которая протекает при нагревании в присутствии концентрированной серной кислоты, являющейся катализатором и смещающей равновесие реакции в сторону продуктов за счет водоотнимающих свойств:

Механизм реакции следующий:

Для этих соединений характерно, что при гидролизе из них вновь образуются кислоты.
3. Галогенирование (реакция Зелинского – Гелля – Фольгарда). В присутствии брома и небольших количеств красного фосфора образуются -бромзамещенные кислоты:
СН3–СН2–СООН
+ Br2
![]() CH3–CHBr–COOH
+ HBr
CH3–CHBr–COOH
+ HBr
пропионовая кислота -бромпропионовая кислота
Наиболее важные представители
Муравьиная кислота НСООН. Впервые была выделена в XVII в. из красных лесных муравьев. Содержится также в соке жгучей крапивы. Безводная муравьиная кислота – бесцветная жидкость с острым запахом и жгучим вкусом, вызывающая ожоги на коже. В промышленности ее получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия с последующей обработкой образовавшегося формиата натрия разбавленной серной кислотой:
![]()
Технический продукт после перегонки представляет собой 85%-ую муравьиную кислоту (азеотропная смесь, т. кип. 107°С).
Муравьиная кислота отличается рядом особенностей. Под влиянием водоотнимающих веществ (концентрированная H2SO4) муравьиная кислота разлагается. Эту реакцию используют для получения чистого оксида углерода (II):
НСООН
![]() СО + Н2О
СО + Н2О
В присутствии некоторых мелкораздробленных металлов, главным образом группы платины, муравьиная кислота разлагается с выделением оксида углерода (IV):
НСООН
![]() СО2
+ Н2
СО2
+ Н2
Наличие в молекуле муравьиной кислоты альдегидной группы обусловливает ее восстанавливающие свойства. В частности, она дает реакцию серебряного зеркала:
Н–СО–ОН
+ 2[Ag(NH3)2]OH
![]() HO–CO–OH
+ 2Ag
+ 4NH3
+ H2O
HO–CO–OH
+ 2Ag
+ 4NH3
+ H2O
угольная кислота
НО–СО–ОН Н2О + СО2
Муравьиную кислоту применяют в текстильной промышленности в качестве протравы при крашении тканей, в кожевенной промышленности (дубление кож). Большие количества муравьиной кислоты в настоящее время используют для консервирования кормов.
Уксусная кислота СН3СООН широко распространена в природе – содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в зеленых листьях), образуется при брожении, гниении, скисании вина, пива, содержится в кислом молоке и сыре. Образуется при окислении многих органических веществ. Безводная уксусная кислота плавится при +16,6°С, кристаллы ее прозрачны как лед, поэтому ее назвали ледяной уксусной кислотой. Впервые была получена в таком виде в конце XVIII в. русским ученым Т. Е. Ловицем. Обычная техническая уксусная кислота имеет концентрацию 70–80%.
Уксусная кислота может быть получена любым из общих способов получения кислот. В промышленности ее производят следующими способами.
1. Каталитическое окисление ацетальдегида кислородом воздуха:
СН3–СНО
+ О2
![]() СН3–СООН
СН3–СООН
2. Уксуснокислое брожение жидкостей, содержащих этиловый спирт. Этот способ относится к биохимическим (микробиологическим) процессам. Под влиянием «уксусного грибка», зародыши которого всегда присутствуют в воздухе, содержащие спирт жидкости «скисают», образуя натуральный уксус. Процесс сложен, но суммарно уравнение реакции можно записать так:
СН3–СН2–ОН
+ О2
![]() СН3СООН
+ Н2О
СН3СООН
+ Н2О
Натуральный уксус содержит около 5% уксусной кислоты. Из него путем фракционной перегонки приготовляют уксусную эссенцию (70–80%-я кислота), используемую в пищевой промышленности для консервирования овощей, грибов, рыбы.
3. Из углеводородов нефти. По одному из способов кислоту производят прямым окислением бутана:
СН3–СН2–СН2–СН3
![]() 2СН3–СООН
2СН3–СООН
Уксусная кислота устойчива к окислителям и к концентрированным минеральным кислотам. Смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота – хороший растворитель многих органических веществ.
Уксусную кислоту широко используют в химической промышленности для различных синтезов. Большие количества кислоты расходуют для получения эфиров – этилацетата, пропилацетата, ацетата целлюлозы, для получения уксусного ангидрида, монохлоруксусной кислоты. Ацетаты алюминия, хрома, железа применяют при крашении тканей в качестве протрав, соли меди – для борьбы с огородными, полевыми и лесными вредителями (парижская зелень), соли свинца – свинцовый сахар (CH3COO)2Рb3H2O и свинцовый уксус (СН3СОО)2РbРb(ОН)2 – для изготовления свинцовых белил, свинцовой примочки в медицине.
Особое место среди жирных кислот занимают высокомолекулярные кислоты – пальмитиновая CH3(CH2)14COOH и стеариновая CH3(CH2)16COOH. Глицериды этих кислот являются главной составной частью природных жиров и масел.
Примеры решения задач
Задача 11. При окислении (без разрыва С–С-связи) предельного одноатомного спирта получена кислота с выходом 80%. При действии на эту кислоту избытка цинка выделилось 4,48 л водорода (н.у.). Какая кислота и в каком количестве была получена? Сколько граммов и какого спирта потребовалось, если известно, что при дегидратации спирта образуется 2-метилпропен?
Решение. Запишем уравнения реакций:
RCH2OH + 2[O] RCOOH + H2O,
2RCOOH + Zn (RCOO)2Zn + H2,
RCH2OH (CH3)2C=CH2 + H2O.
2-метилпропен может быть получен при дегидратации 2-метилпропанола-1 (первичного спирта) или 2-метилпропанола-2 (третичного спирта). Так как, по условию, спирт окислен в кислоту без разрыва связи С–С, тобыл взят первичный спирт – 2-метилпропанол-1, при окислении которого образовалась 2-метилпропановая (изомасляная) кислота:
СН3–СН(СН3)–СН2ОН + [О] СН3–СН(СН3)–СООН.
По уравнению растворения цинка в кислоте, для получения 4,48 л водорода (0,2 моль) необходимо 0,4 моль изомасляной кислоты массой 0,488 = = 35,2 (г). Чтобы получить такое количество кислоты с выходом 80%, необходимо взять 0,4/0,8 = 0,5 (моль) 2-метилпропанола-1 массой 0,574 = 37 (г).
Ответ. 35,2 г изомасляной кислоты; 37 г 2-метилпропанола-1.
Задача 12. Раствор смеси муравьиной и уксусной кислот вступил во взаимодействие с 0,77 г магния. Продукты сгорания такого же количества смеси пропустили через трубку с безводным сульфатом меди. Масса трубки увеличилась на 1,8 г. Вычислите молярное соотношение кислот в исходном растворе.
Решение. Запишем уравнения реакций:
Mg + 2HCOOH (HCOO)2Mg + H2,
Mg + 2CH3COOH 2(CH3COO)2Mg + H2,
2HCOOH + О2 2СО2 + 2Н2О,
СН3СООН + 2О2 2СО2 + 2Н2О.
Пусть в растворе было х моль НСООН и у моль СН3СООН, тогда в реакции с кислотами вступило х/2 + у/2 моль Mg: х/2 + у/2 = 0,77/24 = 0,032.
В реакции сгорания образовалось х + 2у моль воды, которая поглотилась безводным CuSO4:
CuSO4 + 5H2O CuSO45H2O
Число молей воды равно х + 2у = 1,8/18 = 0,10.
Решая систему двух уравнений, находим: х = 0,028, у = 0,036. Молярное соотношение кислот в растворе равно:
(НСООН) : (СН3СООН) = х : у = 0,028 : 0,036 = 7 : 9.
Ответ. (НСООН) : (СН3СООН) = 7 : 9.
Ж И Р Ы
Жиры исключительно широко распространены в природе: они входят в состав организма человека, животных, растений, микроорганизмов и даже некоторых вирусов. Они выполняют в организме следующие функции:
1. Структурная (жиры и другие липиды являются основными компонентами цитоплазматических мембран и субклеточных частиц).
2. Энергетическая (при расщеплении в организме 1 г жира выделяется 38,9 кДж энергии).
3. Синтетическая (при расщеплении жиров образуются соединения, участвующие в синтезе других веществ).
С химической точки зрения жиры представляют собой сложные эфиры, образованные трехатомным спиртом глицерином и высшими жирными кислотами.
Глицерин как трехатомный спирт может образовывать сложные эфиры с участием всех или 1–2 гидроксильных групп. Жиры являются, как правило, полными эфирами глицерина, включающие остатки одной или нескольких кислот:
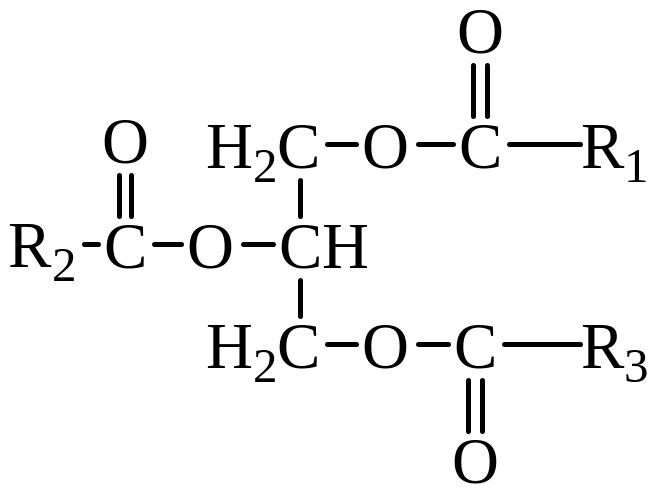
В состав жиров входят ацильные остатки высших жирных кислот (от 10 до 20 атомов С). Как правило, в них число атомов четное.
Наиболее важные жирные кислоты, входящие в состав жиров, следующие:
1) насыщенные: миристиновая кислота С13Н27СООН; пальмитиновая кислота С15Н31СООН; стеариновая кислота С17Н35СООН;
2) ненасыщенные:
олеиновая кислота СН3–(СН2)7–СН=СН–(СН2)7–СООН;
линолевая кислота СН3–(СН2)3–(СН2–СН=СН)2–(СН2)7–СООН;
линоленовая кислота СН3–(СН2–СН=СН)3–(СН2)7–СООН.
Твердые жиры образуются преимущественно насыщенными жирными кислотами. Это в основном животные жиры – сало (кроме рыбьего жира). Жидкие жиры (растительные масла) образованы в основном ненасыщенными кислотами (кроме кокосового масла).
Жиры легко растворяются в органических растворителях, практически нерастворимы в воде, но в присутствии поверхностно-активных веществ могут образовывать с водой стойкие эмульсии. В природных условиях жиры эмульгируются белками (например, в молоке), солями желчных кислот и др. Эмульгирование необходимо для быстрого переваривания жиров пищи пищеварительными органами. Во время пищеварения жиры под действием ферментов липаз (липазы находятся в слюне, желудочном и кишечном соках) гидролизуются до свободных кислот и глицерина, которые всасываются клетками кишечника:

Затем последние снова связываются в различных комбинациях (в печени, слизистой кишечника, жировой ткани), отлагаясь в виде резервного жира.
Химические свойства жиров обусловлены сложноэфирными связями и строением радикалов кислот.
1. Гидролиз сложноэфирных связей (см. выше).
Гидролиз жиров ускоряется щелочами и кислотами. При щелочном гидролизе (омылении) образуются соли насыщенных жирных кислот, называемые мылами:

На практике гидролиз жиров служит основой для получения глицерина, жирных кислот и мыл.
2. Окисление. Жиры, содержащие остатки ненасыщенных кислот, способны окисляться кислородом воздуха по месту разрыва двойных связей. Это свойство используется для приготовлении олифы, лаков и красок. При "высыхании" последних происходит окисление кислородом воздуха масел, из которых их изготовляют. Окисленный полимер льняного масла – густая эластичная масса линоксин – применяется для изготовления линолеума и клеенок.
3. Гидрогенизация (гидрирование). Сущность этой реакции состоит в присоединении водорода к непредельным жирным кислотам. Таким путем из жидких жиров получают твердые, используемые в производстве мыла и в пищевых целях. Например, лучшие сорта гидрированного жира используют для получения маргарина.
Масла проявляют и другие свойства непредельных соединений (присоединение галогенов, полимеризация).
У Г Л Е В О Д Ы
Углеводы содержатся в растительных и животных организмах, где выполняют следующие функции.
1. Энергетическая (углеводы – материал, при окислении которого выделяется энергия, необходимая для осуществления химических реакций в организме).
2. Структурная (углеводы входят в состав биологических мембран и органоидов клеток, участвуют в образовании ферментов, нуклеопротеидов и т.д.; в растениях углеводы – опорный материал).
3. Синтетическая (промежуточные продукты окисления углеводов используются для синтеза многих других органических соединений).
Некоторые углеводы выполняют защитную, регуляторную, рецепторную функции, участвуют в обеспечении специфичности групп крови и т.д.
В классе углеводов выделяют три группы – моносахариды, олигосахариды и полисахариды.
Моносахариды – это гетерофункциональные соединения, содержащие альдегидную или кетонную группу и несколько гидроксильных групп. Они не способны распадаться на более простые углеводы. Моносахариды, содержащие альдегидную группу, называют альдозами (альдегидоспиртами), а моносахариды, содержащие кетогруппу, – кетозами (кетоспиртами). По числу углеродных атомов в молекуле различают тетрозы, пентозы, гексозы, гептозы.
Примерами пентоз являются рибоза и дезоксирибоза, остатки которых входят в состав нуклеиновых кислот (см. ниже); примеры гексоз – глюкоза и фруктоза.
Глюкоза С6Н12О6 содержит альдегидную группу, которая может быть сформирована только за счет концевых углеродных атомов. Важным свойством глюкозы является способность взаимодействовать со свежеприготовленным гидроксидом меди (II) с образованием ярко-синего комплекса, что характерно для многоатомных спиртов. Таким образом, глюкоза является альдегидоспиртом:

Наряду с ациклической формой глюкоза и другие моносахариды могут существовать и в циклических формах (см. выше). Образование циклических форм легко понять исходя из строения молекулы глюкозы: углеродная цепь изогнута и поэтому гидроксигруппа у пятого атома С располагается близко к альдегидной группе. Атом водорода группы –ОН присоединяется к атому кислорода карбонильной группы и образуется внутренний полуацеталь (взаимодействуют в одной молекуле 2 функциональные группы – спиртовая и карбонильная):

-глюкоза -глюкоза
Гидроксигруппа, которая при этом образуется, называется полуацетальным гидроксилом (в циклических формулах он выделен жирным шрифтом). Для циклической формы одного и того же моносахарида возможно различное расположение в пространстве полуацетального гидроксила, которое приводит к - и -формам, называемым анамерами. Циклические и альдегидная формы находятся в равновесии друг с другом.
Моносахариды вступают в реакции, которые обусловлены имеющимися в них функциональными группами. Как спирты, они могут образовывать простые и сложные эфиры.
За счет альдегидной группы глюкоза легко окисляется в мягких условиях, и при этом образуется глюконовая кислота (окислителем могут быть: бромная вода, аммиачный раствор оксида серебра – реакция "серебряного зеркала", гидроксид меди (II) – реакция Троммера) и др.:

В условиях реакции "серебряного зеркала" глюкоза как альдегид восстанавливает серебро, однако наряду с глюконовой кислотой образуются продукты окислительного расщепления по С–С связям.
Возможна реакция восстановления альдегидной группы, что приводит к образованию 6-атомного спирта сорбита:

Моносахариды подвергаются сложному процессу расщепления под влиянием микроорганизмов. Этот процесс называют брожением. В результате такого расщепления образуются этанол, молочная кислота СН3–СН(ОН)–СООН и т.д. Наряду с ними выделяются СО2, Н2О и другие соединения. В зависимости от конечных продуктов (спирт, молочная, лимонная, масляная кислоты и т.п.) различают соответственно спиртовое, молочнокислое, лимоннокислое, маслянокислое брожение и т.д. Каждый из этих процессов протекает под влиянием определенных микроорганизмов. Например, спиртовое брожение протекает при участии ферментов дрожжевых грибков:
С6Н12О6 2С2Н5ОН + 2СО2.
Глюкоза (виноградный сахар) широко распространена в природе и в свободном состоянии встречается во фруктах, меде и т.д. Является структурной единицей таких полисахаридов, как крахмал, гликоген, клетчатка (целлюлоза).
Фруктоза (фруктовый сахар) – структурный изомер глюкозы, но в отличие от последней, относится к кетоспиртам:

-фруктоза -фруктоза
Дисахариды. Примером дисахарида является сахароза (тростниковый, или свекловичный сахар). Молекула сахарозы состоит из остатков молекул двух моносахаридов: -глюкозы и -фруктозы, связанных между собой связью С1–С2. Это означает, что полуацетальный гидроксил глюкозы взаимодействует с полуацетальным гидроксилом фруктозы с выделением воды. Структурная формула сахарозы может быть представлена следующим образом:

При гидролизе сахарозы образуются глюкоза и фруктоза.
Сахароза широко распространена в природе и содержится в сахарном тростнике, свекле, кукурузе и др.
Сахароза – важный пищевой продукт.
Задача 13. Галактоза – это изомер глюкозы, отличающийся от нее положением гидроксильной группы при 4-м атоме углерода. Напишите структурную формулу дисахарида, образованного двумя остатками -галактозы, которые связаны между собой 1-4-гликозидной связью. Напишите структурную формулу продукта взаимодействия этого дисахарида с метиловым спиртом в присутствии хлороводорода. Могут ли эти соединения вступать в реакцию «серебряного зеркала»? Напишите уравнения необходимых реакций.
Решение. Циклическая формула -галактозы:

-глюкоза -галактоза
Молекулы этого углевода могут образовать между собой связи с участием 1-го и 4-го атомов углерода:

Звездочкой обозначен полуацетальный (гликозидный) гидроксил, который может замещаться на группу –ОСН3 при реакции с метанолом:


Благодаря наличию гликозидного гидроксила дисахарид -галактозы может в водном растворе превращаться в линейную форму с альдегидной группой (подобно глюкозе), поэтому он дает реакцию «серебряного зеркала»:


(Такие дисахариды называются восстанавливающими; дисахариды, подобные сахарозе, являются невосстанавливающими, т. к. на образование гликозидной связи в них оба моносахарида расходуют полуацетальные гидроксилы).
Монометиловый эфир данного дисахарида не содержит гликозидного гидроксила, поэтому он не может существовать в линейной форме и не вступает в реакцию «серебряного зеркала».
Полисахариды. Примерами полисахаридов являются крахмал и целлюлоза. Состав этих углеводов выражается формулой (С6Н10О5)n.
Крахмал образуется в растениях при фотосинтезе. Белое вещество, состоящее из мелких зерен. Нерастворим в холодной воде и постепенно растворяется в горячей, образуя вязкие растворы, при охлаждении превращающиеся в студень – клейстер.
Крахмал представляет собой смесь полисахаридов – амилопектина и амилозы. Амилоза не образует клейстера, с иодом дает темно-синий комплекс, а амилопектин ответственен за образование клейстера и с иодом дает слабо-фиолетовый комплекс. И амилоза, и амилопектин состоят из остатков -глюкозы, но различаются формой молекул. Амилоза – линейный полисахарид:

Молекула ее свернута в спираль, внутри которой могут располагаться молекулы низкомолекулярных веществ, например иода, образуя соединения включения.
Молекула амилопектина имеет разветвленное строение.
Крахмал подвергается гидролизу при действии ферментов амилаз или при нагревании с кислотами:
(С6Н10О5)n + nН2О nС6Н12О6 (глюкоза).
Ферментативный гидролиз крахмала используют в производстве этилового спирта из зерна или картофеля. Кислотный гидролиз – в получении патоки. Крахмал является пищевым продуктом, содержится в хлебе, картофеле, крупах. Крахмал – главный источник углеводов в питании. Используется в производстве кондитерских изделий, колбас. Крахмал также применяют для проклеивания тканей, склеивания бумаги, в производстве декстринового клея.
Целлюлоза (клетчатка) – полисахарид линейного строения, состоящий из остатков -глюкозы:

Целлюлоза не плавится и не кипит. При 350оС она разлагается – обугливается. Нерастворима в воде и в большинстве растворителей.
Химические свойства целлюлозы определяются прежде всего присутствием гидроксильных групп. За счет них она образует простые и сложные эфиры:
[С6Н7О2(ОН)3]n
+ 3nHNO3
![]() [C6H7O2(ONO2)3]n
+ 3nH2O
[C6H7O2(ONO2)3]n
+ 3nH2O
тринитроцеллюлоза
Тринитроцеллюлоза (пироксилин) используют как взрывчатое вещество и применяют в производстве бездымного пороха, для изготовления некоторых нитролаков, а также искусственной кожи. Раствор динитроклетчатки (коллоксилина) в смеси спирта и эфира (коллодий) применяют в медицине, а смесь коллоксилина с камфорой – в производстве целлулоида, использующегося в производстве кинопленки, нитролаков и т.д.
[С6Н7О2(ОН)3]n + 3n(СН3СО)2О [C6H7O2(OСОСН3)3]n + 3nСН3СООН
уксусный триацетатцеллюлоза
ангидрид
Из ацетатов целлюлозы готовят лаки, негорючую кинопленку, ацетатное волокно.
Целлюлоза подвергается гидролизу (как крахмал).
Целлюлоза (древесина) используется как горючий и строительный материал, в производстве бумаги. Хлопковое, льняное и др. волокна – как текстильное сырье.
