- •Кислородсодержащие органические соединения спирты
- •Физические свойства спиртов
- •1. Кислотно-основные свойства
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •5. Дегидратация спиртов
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •6. Реакции окисления
- •7. Каталитическое дегидрирование
- •Физические свойства фенола и циклогексанола
- •Альдегиды и кетоны
- •Названия некоторых альдегидов
- •Названия некоторых кетонов
- •Физические свойства некоторых альдегидов и кетонов
- •Карбоновые кислоты
- •Названия некоторых карбоновых кислот
- •Физические свойства некоторых одноосновных карбоновых кислот
- •Азотсодержащие органические соединения
- •Физические свойства некоторых аминов
- •– Образование сложных эфиров (этерификация):
- •Азотсодержащие гетероциклические соединения
- •Нуклеиновые кислоты
Физические свойства фенола и циклогексанола
|
Т. пл., С |
Т. кип., С |
Растворимость (в Н2О, 20С), г/100 г |
Фенол |
41 |
181 |
9,0 |
Циклогексанол |
25,5 |
161 |
3,6 |
Промышленные способы получения фенолов
Большие количества фенола и крезолов (метилфенолов) содержатся в среднем масле каменноугольной смолы и в древесном дегте. Из смолы их извлекают обработкой раствором гидроксида натрия в виде фенолятов, затем осаждают кислотами. В синтетических методах для получения самого фенола исходным сырьем является главным образом бензол или кумол.
Один из наиболее старых методов получения фенолов заключается в сплавлении натриевых солей бензолсульфокислот со щелочами. Образовавшиеся феноляты разлагают минеральными кислотами. В настоящее время метод используют главным образом для получения многоатомных фенолов:

Наиболее важным промышленным способом получения простейшего из фенолов является кумольный способ. Исходным веществом служит кумол (изопропилбензол), получаемый алкилированием бензола пропиленом. Окисление кумола проводят кислородом воздуха, а образовавшийся гидропероксид кумола разлагают серной кислотой. Способ экономически выгоден, так как одновременно с фенолом получается и другой важный продукт – ацетон:

Этот метод был впервые освоен в СССР (1949 г.). Из ди-изопропилбензолов аналогично могут быть получены резорцин и гидрохинон.
Стадия разложения пероксида интересна тем, что при этом происходит перегруппировка, во время которой группа ОН переходит к бензольному ядру.
Применяют в промышленности и старый способ Рашига – окислительное хлорирование бензола смесью хлороводорода и воздуха с последующим гидролизом образующегося хлорбензола:

Метод выгоден тем, что хлороводород постоянно регенерируется, гидролиз не требует расхода щелочи.
Химические свойства фенолов
По строению фенолы аналогичны спиртам. Однако гидроксильная группа и бензольное ядро оказывают сильное влияние друг на друга, что обусловливает специфичность свойств фенолов, отличающих их от ароматических спиртов.
Для характеристики важнейших свойств фенолов рассмотрим отдельно реакции фенольной гидроксильной группы и бензольного ядра.
Реакции, обусловленные гидроксильной группой
1. Кислотные свойства
Фенолы, как и спирты, не изменяют окраски индикаторов, но кислотные свойства у них выражены хотя и слабо, но сильнее, чем у спиртов и воды.
Более сильный кислотный характер фенолов по сравнению со спиртами объясняется влиянием бензольного ядра. Неподеленная пара электронов атома кислорода вступает в сопряжение с -электронами бензольного ядра. В результате электронная плотность кислородного атома перемещается частично на связь кислород–углерод, увеличивая при этом электронную плотность в орто- и пара-положениях в бензольном ядре. Электронная пара связи кислород–водород сильнее притягивается к атому кислорода, способствуя тем самым созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде иона:

В отличие от спиртов фенолы реагируют с водными растворами щелочей, образуя феноляты (поэтому простейший фенол был назван «карболовой кислотой»):
С6Н5ОН + NаОН ⇄ С6Н5ОNа + Н2О.
фенолят натрия
Феноляты подобно всем солям слабых кислот и сильных оснований легко гидролизуются, водные растворы их имеют сильнощелочную реакцию:
Под действием.сильных кислот гидролиз протекает необратимо:
C6H5ONa + H2SО4 С6Н5ОН + NaHSO4.
По сравнению с кислотами кислотные свойства у фенолов выражены чрезвычайно слабо. Так, фенол значительно слабее угольной кислоты (примерно в 3000 раз), поэтому фенолы нерастворимы в водных растворах карбонатов щелочных металлов и не разлагают солей угольной кислоты. Наоборот, при действии на фенолят угольной кислотой образуется свободный фенол:
C6H5ONa + СО2 + Н2О С6Н5ОН + NaHCO3.
Кислотные свойства фенола усиливаются под влиянием связанных с ядром электроноакцепторных групп, например нитрогруппы, галогенов и др.
2. Образование простых эфиров
Простые эфиры фенолов образуются аналогично простым эфирам спиртов:
С6Н5–ONa + СН3Br С6Н5–О–СН3 + NaBr.
метилфениловый
эфир
3. Образование сложных эфиров
В отличие от спиртов фенолы не образуют сложных эфиров при непосредственном действии кислот. Обычно их получают при действии на фенолы хлорангидридами или ангидридами кислот:
С6Н5ОН + Cl–СО–СН3 С6Н5–О–СО–СН3 + НСl.
хлорангидрид
уксусной кислоты
4. Обмен гидроксильной группы на галоген
Эта реакция практически не идет, так как связь углерод–кислород в фенолах прочнее, чем в спиртах.
Реакции бензольного ядра
1. Реакции электрофильного замещения
Гидроксильная группа относится к числу наиболее сильных орто-пара-ориентантов (см. методичку «Теоретические основы органической химии. Углеводороды»). Реакции электрофильного замещения водорода в бензольном ядре для фенолов протекают значительно легче и в более мягких условиях, чем для бензола.
Так, при действии бромной водой происходит замещение трех атомов водорода в ядре на бром, образовавшийся трибромфенол выпадает в виде белого осадка (качественная реакция на фенолы); при действии хлора на фенол образуются о- и п-хлорфенолы:

2,4,6-трибромфенол о-хлорфенол п-хлорфенол
Нитрование фенола идет в более мягких условиях, чем нитрование бензола. При действии разбавленной азотной кислоты при комнатной температуре образуется смесь о- и п-нитрофенолов; конечным продуктом нитрования является 2,4,6-тринитрофенол, называемый также пикриновой кислотой:

пикриновая кислота о-нитрофенол п-нитрофенол
2. Конденсация с альдегидами
Данная реакция может протекать как в кислой, так и в щелочной средах за счет атомов водорода орто- и пара-положений. Одной из практически важных реакций является конденсация фенола с формальдегидом с образованием гидроксиметилфенолов:

При дальнейшей конденсации образуются высокомолекулярные соединения – фенолоформальдегидные смолы.
3. Гидрирование
Фенолы хорошо гидрируются в присутствии никелевого катализатора, давая соответствующие циклогексанолы:

Фенол дает с 1–2%-ным раствором хлорида железа (III) фиолетовое окрашивание, в результате образования комплексного иона:
6С6Н5ОН + FеСl3 Н3[Fе(ОС6Н5)6] + 3НСl.
Крезолы СН3–С6Н4–ОН образуют соединения синего цвета, многоатомные фенолы – соединения различных оттенков.
Эту реакцию используют для качественного обнаружения фенолов.
Отдельные представители фенолов
Фенол (карболовая кислота) С6Н5ОН – бесцветное кристаллическое вещество со специфическим запахом. На воздухе окисляется, сначала розовеет, затем темнеет; кристаллы расплываются вследствие гидроскопичности. Мало растворим в холодной воде, хорошо – в горячей. Смешивается во всех отношениях со спиртом, эфиром, бензолом. Обладает сильными антисептическими свойствами. Его водный раствор применяется для дезинфекции. Токсичен, вызывает ожоги кожи.
Фенол – один из важнейших полупродуктов современной промышленности органического синтеза; его используют для получения фенолоформальдегидных смол, циклогексанола и синтетических волокон на его основе (капрон, найлон), в синтезе красителей, лекарственных веществ, салициловой кислоты, гербицидов, анилина, термостойких смол, поликарбонатов, эпоксидных смол и др.
Продукт исчерпывающего хлорирования фенола – пентахлорфенол С6Сl5ОН, обладает сильным бактерицидным действием, применяется для консервации древесины; пентахлорфенолят натрия используют как гербицид.
Крезолы (о-, м-, п-метилфенолы) СН3С6Н4ОН получают из каменноугольной смолы в виде смеси, носящей название «сырой крезол». Используют их для получения синтетических смол, красителей, ядохимикатов. Водные эмульсии крезолов с раствором мыла (лизол, креолин) – антисептики, применяемые в ветеринарии.
Двух- и трехатомные фенолы (дигидрокси- и тригидроксибензолы) – кристаллические вещества, растворимые в воде лучше, чем одноатомные фенолы. Ниже приведены представители тригидроксибензолов (дигидроксибензолы см. выше):

пирогаллол гидроксигидрохинон флороглюцин
(1,2,3-тригидрокси- (1,2,4-тригидрокси- (1,3,5-тригидрокси-
бензол) бензол) бензол)
(т. пл. 133С) (т. пл. 140С) (т. пл. 219С)
Производные многоатомных фенолов распространены в природе (красящие вещества растений и дубильные вещества). Многоатомные фенолы используют для синтеза красителей, лекарственных веществ, для получения полимеров и др.
Увеличение числа гидроксильных групп в ядре повышает его активность в реакциях электрофильного замещения. Наличие нескольких гидроксильных групп в ядре, особенно в орто- и пара-положениях друг к другу, вызывает особую чувствительность к действию окислителей. Такие фенолы чрезвычайно легко окисляются и являются хорошими восстановителями. Особо следует отметить сильные восстановительные свойства гидрохинона (1,4-дигидроксибензол) и пирогаллола (1,2,3-тригидроксибензол), которые используют в качестве проявителей в фотографии. Гидрохинон применяют также в качестве антиоксиданта – вещества, предотвращающего окислительные процессы.
Пирогаллол в щелочном растворе очень легко поглощает молекулярный кислород (из воздуха или других газовых смесей), что используют при анализе газовых смесей для количественного определения кислорода.
Примеры решения задач
Задача 5. Расположите в порядке возрастания кислотности следующие вещества: фенол, сернистая кислота, метанол. Приведите уравнения химических реакций, подтверждающие правильность выбранной последовательности.
Решение. Правильный ряд выглядит так: СН3ОН < C6H5OH < H2SO3.
Фенол сильнее метанола, поскольку фенол реагирует с растворами щелочей, а метанол – нет:
С6Н5ОН + NaOH C6H5ONa + H2O
CH3OH + NaOH ↛
Далее воспользуемся правилом, согласно которому более сильная кислота вытесняет более слабую из ее солей.
С6Н5ОNa + SO2 + H2O С6Н5ОН + NaHSO3
Фенол вытесняется сернистой кислотой из фенолята натрия, следовательно сернистая кислота сильнее фенола.
Задача 6. При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 л водорода (н.у.). Для полной нейтрализации этой же смеси потребовалось 25 мл 40%-ного раствора гидроксида калия (плотность 1,4 г/мл). Определите массовые доли веществ в исходной смеси.
Решение. С натрием реагируют и этанол, и фенол:
2C2H5OH + 2Na 2C2H5ONa + H2,
2C6H5OH + 2Na 2C6H5ONa + H2,
а с гидроксидом калия – только фенол:
C6H5OH + КОН C6H5OК + H2О.
(КОН) = 251,40,4/56 = 0,25 (моль) = (C6H5OH).
Из 0,25 моль фенола в реакции с натрием выделилось 0,25/2 = 0,125 (моль) Н2, а всего выделилось 6,72/22,4 = 0,3 (моль) Н2. Оставшиеся 0,3 – 0,125 = 0,175 (моль) Н2 выделились из этанола, которого израсходовано 0,1752 = 0,35 (моль).
Массы веществ в исходной смеси: m(C6H5OH) = 0,2594 = 23,5 (г); m(C2H5OH) = 0,3546 = 16,1 (г). Массовые доли:
(C6H5OH) = 23,5/(23,5+16,1) = 0,593, или 59,3%,
(C2H5OH) = 16,1/(23,5+16,1) = 0,407, или 40,7%.
Ответ: 59,3% фенола, 40,7% этанола.
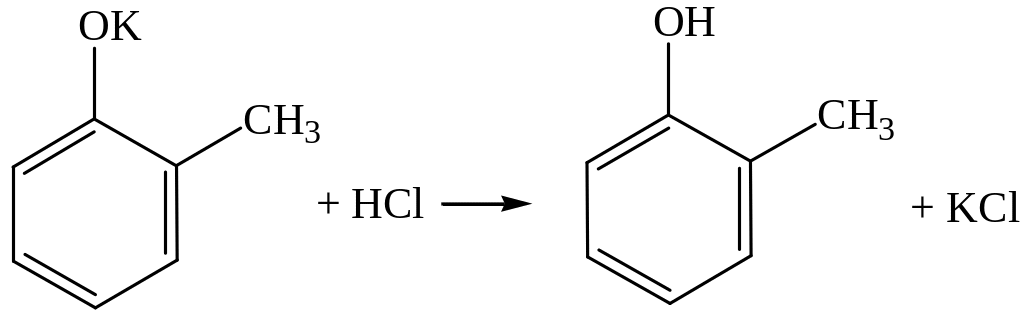
Задача 7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С7Н7ОК Х С7Н6ОBr2.
Приведите структурные формулы исходных веществ и продуктов реакций.
Решение. Изомеры состава С7Н7ОК могут быть производными метилфенолов (крезолов) или бензилового спирта – простейшего ароматического спирта:
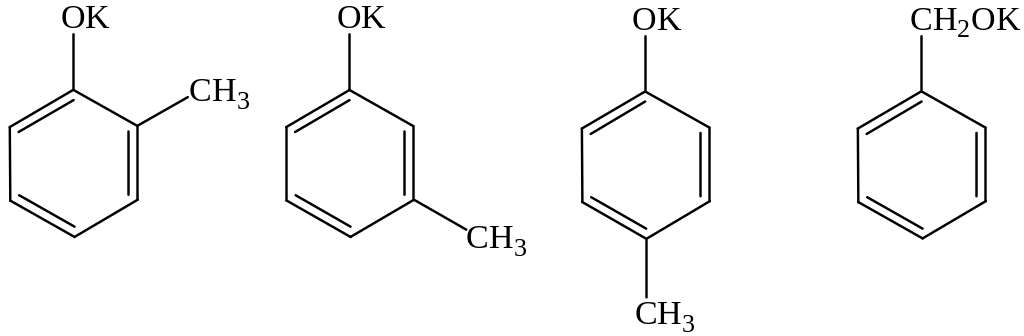
Вещество состава С7Н6ОBr2 – это дибромпроизводное от С7Н8О, которое можно получить по реакции С7Н7ОК с любой неорганической кислотой (фенол, его гомологи и ароматические спирты – очень слабые кислоты). Два атома водорода можно заместить на два атома брома в бензольном кольце под действием бромной воды, если с бензольным кольцом соединена группа ОН, и при этом одно из орто- и пара-положений по отношению к группе ОН занято группой СН3 (если все эти положения будут свободны от заместителей, то образуется трибромпроизводное). Этому условию удовлетворяют 2-метилфенол (о-крезол) и 4-метилфенол (п-крезол). Таким образом, уравнения реакций выглядят следующим образом (на примере 2-метилфенолята калия):