
- •Кислородсодержащие органические соединения спирты
- •Физические свойства спиртов
- •1. Кислотно-основные свойства
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •5. Дегидратация спиртов
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •6. Реакции окисления
- •7. Каталитическое дегидрирование
- •Физические свойства фенола и циклогексанола
- •Альдегиды и кетоны
- •Названия некоторых альдегидов
- •Названия некоторых кетонов
- •Физические свойства некоторых альдегидов и кетонов
- •Карбоновые кислоты
- •Названия некоторых карбоновых кислот
- •Физические свойства некоторых одноосновных карбоновых кислот
- •Азотсодержащие органические соединения
- •Физические свойства некоторых аминов
- •– Образование сложных эфиров (этерификация):
- •Азотсодержащие гетероциклические соединения
- •Нуклеиновые кислоты
5. Дегидратация спиртов
В определенных условиях спирты способны терять воду. В качестве водоотнимающих средств можно применять концентрированную серную или фосфорную кислоты. Легче всего дегидратируются третичные спирты, труднее – первичные.
Спирты дегидратируются также при пропускании их паров над нагретым твердым катализатором (силикагель, каолин, оксид алюминия и др.).
В зависимости от условий реакция может идти по одному из двух направлений. В жестких условиях (при высокой температуре) каждая молекула спирта теряет молекулу воды с образованием алкена (внутримолекулярная дегидратация)1:

При дегидратации спиртов водород предпочтительнее отщепляется по правилу А.М. Зайцева (1875 г.) – от того из соседних атомов углерода, который беднее водородом (наименее гидрогенизирован):

При менее жестких условиях молекула воды отщепляется от двух молекул спирта и образуется простой эфир (межмолекулярная гидратация):

Механизм реакции в присутствии кислоты:
Кислотно-основное взаимодействие
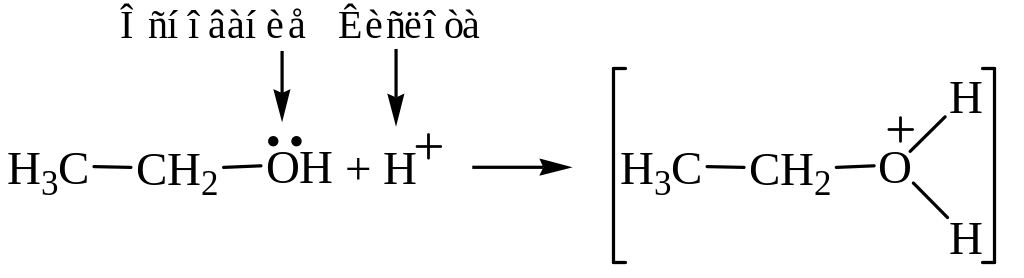
Нуклеофильное замещение

![]()
Таким образом, первая стадия реакции заключается в превращении молекулы этанола в этилоксониевый ион. Последний подвергается атаке второй молекулой спирта, выступающей в роли нуклеофила. Образующийся при этом новый алкилоксониевый ион стабилизируется путем отщепления иона водорода (возврат катализатора) и превращается в простой эфир.
6. Реакции окисления
Спирты окисляются легче, чем углеводороды, причем в первую очередь окислению подвергается атом углерода, при котором находится гидроксильная группа. Первичные и вторичные спирты окисляются легче третичных, что обусловлено наличием атомов водорода у атома углерода, связанного с гидроксильной группой.
Окисление спиртов обычно проводят сильными окислителями – хромовой смесью или смесью перманганата калия с серной кислотой.
В зависимости от природы спирта, а также условий проведения реакции могут образовываться различные продукты.
Первичные спирты окисляются до альдегидов, а затем до карбоновых кислот:

(5С3Н7ОН + 2КMnO4 + 3H2SO4 5C2H5CHO + 2MnSO4 + K2SO4 + 8H2O;
5С2Н5СНО + 2КMnO4 + 3H2SO4 5C2H5CОOН + 2MnSO4 + K2SO4 + 3H2O)

Вторичные спирты окисляются до кетонов:

Третичные спирты при действии сильных окислителей окисляются с разрывом связей С–С и образованием кетонов и кислот, содержащих в молекуле меньше атомов углерода, чем исходный спирт.
7. Каталитическое дегидрирование
Превращение спиртов в альдегиды и кетоны можно осуществить также дегидрированием – пропусканием паров спиртов над нагретым металлическим катализатором, например медью, цинком или серебром, при 300С без добавления окислителя:

Эта реакция эндотермична. Оптимальную температуру можно поддерживать за счет сожжения части выделяющегося водорода. В промышленных условиях для этого применяют принцип непрерывного потока, используя дешевый окислитель – воздух (при тщательном контроле, чтобы не произошло более глубокого окисления).
Отдельные представители
Метиловый спирт (метанол) – бесцветная жидкость с резким запахом, легче воды (плотность 0,79 г/мл), легко воспламеняется. Растворим в воде и полярных органических растворителях. Метанол получают в больших количествах в промышленности из оксида углерода (II) и водорода:
СО + 2Н2 СН3ОН.
Эту реакцию долгое время проводили над катализаторами (оксиды цинка и хрома) при 350–400°С и давлении до 30 МПа. В настоящее время разработан новый катализатор (смесь оксидов цинка и меди), который позволяет осуществлять синтез в более мягких условиях (250°С, 7 МПа). Это дает большой экономический эффект, позволяет упростить аппаратуру.
При сухой перегонке дерева среди других веществ в качестве побочного продукта образуется и метиловый спирт (названный из-за этого «древесным»). В настоящее время этот способ сохранил значение лишь при переработке отходов древесины.
Главное промышленное применение метилового спирта – получение формальдегида. Он используется также для синтеза метилирующих средств (метилхлорид, диметилсульфат), диметиланилина, для получения уксусной кислоты. При реакции метанола с изобутиленом получают трет-бутилметиловый эфир – антидетонатор, который в отличие от тетраэтил-свинца не токсичен.
Метиловый спирт – растворитель органических веществ. Токсичен в любых дозах, в малых количествах вызывает слепоту, в больших – смерть.
Этиловый спирт (этанол, винный спирт) – бесцветная жидкость с характерным алкогольным запахом, жгучим вкусом. Легко воспламеняется. Смешивается с водой в любых соотношениях.
Получаемый в промышленности спирт-ректификат представляет собой смесь 95,6% этанола и 4,4% воды, которая кипит при постоянной температуре 78,15С (смеси определенного состава, кипящие при постоянной температуре и нераздельно перегоняющиеся, называют азеотропными смесями).
Для получения абсолютного (безводного) спирта воду можно удалить химическим путем – кипячением спирта с оксидом кальция или безводным сульфатом меди.
Абсолютный спирт смешивается во всех отношениях с бензином (в отличие от 95%-го), что дает возможность использовать его в составе смесей топлива для двигателей внутреннего сгорания. Спирт является хорошим растворителем многих органических веществ, обладает антисептическими свойствами, консервирует белок.
В промышленности этанол получают гидратацией этилена (см. выше) или из природных сложных углеводов (крахмал, целлюлоза).
Сущность самого старого способа производства спирта – спиртового брожения сахаристых веществ – заключается в том, что углеводы (в первую очередь, глюкоза С6Н12О6) в присутствии особых микроорганизмов – дрожжей – подвергаются расщеплению (брожению). Механизм реакции брожения сложен, суммарно процесс можно выразить уравнением:
С6Н12О6
![]() 2СО2
+ 2С2Н5ОН
2СО2
+ 2С2Н5ОН
Сырьем могут служить ягоды, виноград, свекловичная патока, которые содержат сахаристые вещества в свободном состоянии, а также крахмалсодержащие вещества – зерна хлебных злаков, кукуруза, картофель. Крахмал (C6H10O5)n сначала подвергают «осахариванию» – гидролизу до глюкозы, а затем брожению. Для получения спирта, применяемого для технических целей, в промышленности используют также целлюлозу (C6H10O5)n. Для этого отходы лесотехнической промышленности (опилки, щепа и др.) гидролизуют 5%-й серной кислотой под давлением 1 МПа. В продуктах гидролиза содержится главным образом глюкоза. Гидролизат нейтрализуют известью (известь реагирует с серной кислотой, при этом осаждается CaSO4), фильтруют и затем сбраживают, получая гидролизный спирт:
(С6Н10О5)n
![]() С6Н12О6
С6Н12О6
![]() С2Н5ОН
С2Н5ОН
крахмал (или целлюлоза – опилки, щепа) гидролизный спирт
Из 1 т сухих опилок можно получить столько же спирта, сколько из 1 т картофеля или 300 кг зерна.
Спирт используют как растворитель для экстракции и кристаллизации, для изготовления лаков и красок, для консервирования анатомических препаратов, как дезинфицирующее средство в медицине, для изготовления лекарственных веществ, в парфюмерной промышленности для изготовления одеколона и духов. Большие количества спирта расходуются для синтеза диэтилового эфира, этилхлорида, сложных эфиров органических кислот, хлороформа, йодоформа и др.
Этиловый спирт входит в состав алкогольных напитков. Их употребление – большое социальное зло. Прием внутрь даже небольших количеств этанола понижает восприимчивость органов чувств, вызывает сильное поражение центральной нервной системы. Хотя этиловый спирт менее ядовит, чем метиловый, но острое отравление этанолом может вызвать смерть, а постоянное употребление спиртных напитков разрушает физическое и психическое здоровье.
Высшие жирные спирты (ВЖС). В начале XIX века французский химик Шёврель впервые выделил высший жирный спирт С16Н33ОН из жироподобного вещества, имеющегося в голове кашалота, и назвал его цетиловым (лат. cetus – кит). Это вещество внешне напоминает жир; Тпл. = 50°С. В зависимости от длины радикала и от консистенции различают спирты: С6 – C12 – сиропообразные жидкости, Ткип. 157–263°С; С13 – С20 – мазеобразные вещества, напоминающие застывшее сало, Тпл. 31–66°С, по свойствам они более близки к углеводородам; и C21–С40 – твердые вещества, Тпл. 69–95С.
До конца 40-х годов основным источником получения ВЖС оставался китовый жир. В настоящее время ВЖС производят в большом количестве синтетически. Мировое производство этих спиртов составляет около 1 млн. т в год. Сырье для их получения поставляет нефтеперерабатывающая промышленность. Один из способов синтеза – восстановление высших жирных кислот, получаемых окислением парафина. Вторичные ВЖС можно приготовлять прямым окислением нормальных алканов кислородом в присутствии борной кислоты. Первичные нормальные спирты С6–С20 получают полимеризацией этилена по способу Циглера с последующим окислением и гидролизом.
Применяют ВЖС в качестве поверхностно-активных веществ– антииспарителей (защита водоемов), пенообразователей (флотация руд) и др. Они являются хорошими растворителями. Диэфиры на основе ВЖС – хорошие пластификаторы, смазочные масла для авиационных двигателей, работающие при температурах от –50 до +200°С. В большом количестве ВЖС используют для получения синтетических моющих средств, которые полностью разрушаются при биохимической очистке сточных вод и потому не загрязняют водоемы. На основе ВЖС получают четвертичные аммониевые соли, микродобавки которых в воду обеззараживают (стерилизуют) ее, что имеет большое значение в пищевой промышленности при переработке мясных продуктов, рыбы, фруктов, овощей, промывке аппаратуры и др.
Аллиловый спирт СН2=СН–СН2ОН – представитель ненасыщенных спиртов. В промышленности его получают гидролизом аллилхлорида. Более новым промышленным способом получения аллилового спирта является каталитическое окисление пропилена в акролеин и восстановление последнего:
СН2=СН–СН3
![]() СН2=СН–СНО
СН2=СН–СНО
![]() СН2=СН–СН2ОН
СН2=СН–СН2ОН
Аллиловый спирт – промежуточный продукт синтеза глицерина.
Ненасыщенные спирты типа винилового спирта СН2=СНОН, которые содержат гидроксильную группу у атома углерода, связанного двойной связью, так называемые енолы, в свободном состоянии неустойчивы (правило А.П. Эльтекова). Неустойчивость винилового спирта связана с тем, что свободные электронные пары кислорода вступают в сопряжение с -электронами двойной связи:
![]()
Атом водорода гидроксильной группы, приобретая повышенный положительный заряд, легко отрывается в виде иона Н+, который затем присоединяется к имеющему избыток электронной плотности атому углерода СН2-группы.
В момент образования такие спирты изомеризуются в карбонильные соединения – альдегиды и кетоны:


Бензиловый спирт С6Н5–СН2ОН – простейший ароматический спирт – в свободном состоянии и в виде сложных эфиров содержится в эфирных маслах жасмина и других цветов. Применяется в парфюмерии. Получают его гидролизом бензилхлорида, а также восстановлением бензальдегида.
Многоатомные спирты
Двухатомные спирты называют гликолями или диолами, трехатомные – глицеринами или триолами. Положение гидроксильных групп указывают цифрами:
НО–СН2–СН2–ОН этиленгликоль (этандиол-1,2)
СН3–СН(ОН)–СН2–ОН пропиленгликоль (пропандиол-1,2)
НО–СН2–СН2–СН2–ОН триметиленгликоль (пропандиол-1,3)
НО–СН2–СН2–СН2–СН2–ОН тетраметиленгликоль (бутандиол-1,4)
НО–СН2–СН(ОН)–СН2–ОН глицерин (пропантриол-1,2,3)
Многоатомные спирты хорошо растворимы в воде, плохо – в органических растворителях, имеют высокие температуры кипения. Могут быть получены теми же способами, что и одноатомные спирты.
Этиленгликоль
Наиболее важным из диолов является этиленгликоль. Это бесцветная жидкость; температура кипения 197С; плотность 1,11 г/мл; смешивается с водой во всех отношениях.
Его производят в промышленности из этилена разными путями:


Перспективным является способ получения этиленгликоля из синтез-газа (250°С, 200 МПа, катализатор):
2СО + 3Н2 НО–СН2–СН2–ОН
Химические свойства этиленгликоля и вообще многоатомных спиртов напоминают свойства одноатомных спиртов. В зависимости от того, участвует ли в реакции одна гидроксильная группа или обе, получаются два ряда соединений. Гликоли так же, как и одноатомные спирты, не изменяют окраски индикаторов, но этиленгликоль обладает несколько более кислотным характером, чем этиловый спирт. Увеличение числа гидроксильных групп усиливает кислотный характер. Гликоляты образуются под действием не только щелочных металлов, но и гидроксидов тяжелых металлов. Например, при реакции этиленгликоля со свежеосажденным гидроксидом меди получается гликолят меди (синего цвета). Причиной легкого образования гликолятов тяжелых металлов является не только повышенная кислотность этиленгликоля, но и повышенная устойчивость этих гликолятов, имеющих характер внутрикомплексных соединений:

Гидроксильные группы в этиленгликоле могут замещаться на атомы галогена. При действии хлоро- или бромоводорода замещается одна гидроксильная группа и получается галогенгидрин:
HO–CH2–СН2–ОН + НСl С1–СН2–СН2–ОН этиленхлоргидрин
Вторая гидроксильная группа замещается труднее – под действием РС15 или SOC12.
Этиленгликоль образует простые и сложные эфиры. Некоторые из них нашли промышленное применение как растворители, например метилцеллозольв СН3–О–СН2–СН2–ОН (жидкость с температурой кипения 125°С).
Водный 50%-й раствор этиленгликоля используют в качестве незамерзающей жидкости (антифриз) для охлаждения автомобильных двигателей в зимних условиях (температура застывания –34°С). Этиленгликоль применяют для синтеза полимерных материалов и для других синтезов.
Глицерин
Глицерин (пропантриол-1,2,3) – важнейший представитель многоатомных спиртов. В обычных условиях это вязкая гигроскопическая жидкость сладкого вкуса (температура плавления 17°С, температура кипения 290°С, плотность 1,26 г/мл). Смешивается с водой во всех отношениях. Глицерин входит в состав жиров и других веществ, образующих животные ткани.
Наиболее старый способ производства глицерина в промышленности– гидролиз жиров и масел. В более новом и важном промышленном способе исходят из пропилена, являющегося продуктом нефтепереработки. Пути превращения пропилена в глицерин различны.
При термическом хлорировании пропилена получают аллилхлорид, при гидролизе которого образуется аллиловый спирт. Аллиловый спирт под действием хлорноватистой кислоты (Сl2 + Н2О) переводят в 3-хлорпропандиол-1,2, а последний гидролизуют в глицерин:

Пропилен Аллилхлорид Аллиловый 3-Хлорпропандиол-1,2 Глицерин
спирт
Более перспективный способ – окисление пропилена кислородом воздуха (катализатор Сu, 370°С) до акролеина, восстановлением которого получают аллиловый спирт. Под действием пероксида водорода аллиловый спирт превращается в глицидный спирт (глицидол), а последний гидролизуется в глицерин:

Пропилен Акролеин Аллиловый спирт Глицидол Глицерин
При действии пероксида водорода непосредственно на акролеин получается глицериновый альдегид, который каталитическим гидрированием переводят в глицерин:
Н2С=СН–СНО
![]() НОСН2–СН(ОН)–СНО
НОСН2–СН(ОН)–СНО
![]() НОСН2–СН(ОН)–СН2ОН
НОСН2–СН(ОН)–СН2ОН
Перспективен способ получения глицерина из синтез-газа при нагревании под давлением в присутствии катализатора:
3СО + 4Н2 НОСН2–СН(ОН)–СН2ОН
Получение глицерина гидролизом пищевых жиров постепенно теряет значение.
По свойствам глицерин подобен этиленгликолю: легко дает с гидроксидами тяжелых металлов глицераты, например, глицерат меди – внутрикомплексное соединение ярко-синего цвета:

Гидроксильные группы обмениваются на галоген, глицерин образует простые и сложные эфиры, например эфир глицерина и азотной кислоты – тринитрат глицерина (тринитроглицерин), неточно называемый «нитроглицерином»:

При обычной температуре это жидкость (температура плавления 13°С), чувствительная к удару, является взрывчатым веществом.
Разложение нитроглицерина – сильно экзотермическая реакция (3000°С), при этом выделяется большое количество газов:

Для повышения стабильности нитроглицерина и обеспечения безопасности в обращении нитроглицерином пропитывают пористую массу (инфузорную землю, древесную муку и др.) и готовят так называемые динамиты. Динамиты используют в военном и горном деле.
Глицерин гигроскопичен, поэтому его используют в качестве увлажняющего средства при изготовлении фармацевтических препаратов и косметических средств, а также в кожевенной и текстильной промышленности. В пищевой промышленности его применяют для подслащивания ликеров и др.
Примеры решения задач
Задача 1. Этиленовый углеводород присоединяет 6,72 л (н. у.) хлороводорода. При гидролизе продукта реакции водным раствором гидроксида натрия при нагревании образуется 22,2 г предельного одноатомного спирта, содержащего три метильные группы. Определите строение исходного углеводорода и полученного спирта.
Решение. Запишем уравнения реакций, используя общие формулы соединений:
СnH2n + HCl CnH2n+1Cl;
CnH2n+1Cl + NaOH CnH2n+1OH + NaCl.
(HCl) = 6,72/22,4 = 0,3 (моль). Согласно уравнениям реакций, (CnH2n+1OH) = (CnH2n+1Cl) = (HCl) = 0,3 (моль). Молярная масса спирта равна: М(CnH2n+1OH) = 12n + 2n + 2 + 16 = 14n + 18 = 22,2/0,3 = 74 (г/моль), откуда n = 4. Следовательно, молекулярная формула спирта – С4Н9ОН.
Из четырех спиртов состава С4Н9ОН только третичный спирт (2-метилпропанол-2, или трет-бутиловый спирт) содержит три метильные группы. В состав молекулы этого спирта входит разветвленный углеродный скелет, следовательно, исходный алкен состава С4Н8 тоже имел разветвленный скелет. Это – 2-метилпропен. Уравнения реакций:


Ответ: 2-метилпропен; трет-бутанол.
Задача 2. Соединение неизвестного строения медленно реагирует с натрием, не окисляется раствором дихромата натрия, с концентрированной соляной кислотой реагирует быстро с образованием алкилхлорида, содержащего 33,3% хлора по массе. Определите строение этого соединения.
Решение. Характер реакций с натрием, с дихроматом натрия и с соляной кислотой свидетельствует о том, что неизвестное вещество – третичный спирт. При реакции с HCl образуется третичный алкилхлорид:
ROH + HCl RCl + H2O.
1 моль RCl содержит 1 моль хлора массой 35,5 г, что составляет 33,3% от общей массы, следовательно молярная масса алкилхлорида равна: М(RCl) = 35,5/0,333 = 106,5 (г/моль), а молярная масса углеводородного радикала равна: М(R) = 106,5 – 35,5 = 71 (г/моль). Единственный радикал с такой молярной массой – С5Н11.
Третичные спирты имеют общую формулу:

Один атом углерода из пяти соединен с гидроксильной группой, а четыре атома входят в состав трех радикалов. Разбить четыре атома углерода можно единственным способом: два радикала СН3 и один радикал С2Н5. Искомый спирт – 2-метилбутанол-2:

Ответ: 2-метилбутанол-2.
Задача 3. При обработке 10,5 г этиленового углеводорода водным раствором перманганата калия получили 15,2 г двухатомного спирта. При реакции этого спирта с избытком натрия выделилось 4,48 л газа (н.у.). Определите строение спирта и рассчитайте его выход в первой реакции.
Решение. Запишем общее уравнение окисления любых этиленовых углеводородов водным раствором перманганата калия:
3СnH2n + 2KMnO4 + 4H2O 3CnH2n(OH)2 + 2MnO2 + 2KOH.
Спирт реагирует с натрием по уравнению:
CnH2n(OH)2 + 2Na CnH2n(ONa)2 + H2.
Молярную массу спирта можно определить по количеству выделившегося водорода: (Н2) = 4,48/22,4 = 0,2 (моль); (CnH2n(OH)2) = (Н2) = 0,2 (моль); М(CnH2n(OH)2) = 14n + 34 = 15,2/0,2 = 76 (г/моль), откуда n = 3. Искомый углеводород – пропен, двухатомный спирт – пропандиол-1,2:
СН3–СН=СН2
![]() СН3–СН(ОН)–СН2(ОН).
СН3–СН(ОН)–СН2(ОН).
Количество исходного пропена составляет: (С3Н6) = 10,5/42 = 0,25 (моль). Теоретически могло образоваться 0,25 моль пропандиола-1,2, а практически образовалось 0,2 моль. Выход пропандиола-1,2 равен:
( CnH2n(OH)2) = 0,2/0,25 = 0,8
Ответ: пропандиол-1,2; выход 80%.
Задача 4. Предложите метод синтеза 2,3-диметилбутана из изопропилового спирта. Напишите уравнения соответствующих реакций.
Решение. Молекула 2,3-диметилбутана содержит 6 атомов углерода, а молекула изопропилового спирта – 3, следовательно, одна из стадий синтеза включает реакцию с удвоением углеродного скелета. Такой реакцией является реакция Вюрца:

2-Бромпропан, необходимый для этой реакции, можно получить реакцией изопропилового спирта с избытком бромоводородной кислоты:
СН3–СН(СН3)–ОН + НBr СН3–СН(СН3)–Br + Н2О.
Схема данного синтеза выглядит следующим образом:
СН3–СН(СН3)–ОН
![]() СН3–СН(СН3)–Br
СН3–СН(СН3)–Br
![]()
СН3–СН(СН3)–СН(СН3)–СН3
Ф Е Н О Л Ы
Фенолы – гидроксилсодержащие ароматические соединения, в молекулах которых гидроксильная группа связана непосредственно с углеродным атомом бензольного ядра (в отличие от ароматических спиртов).
По числу гидроксильных групп в молекуле различают одно-, двух- и многоатомные фенолы:




фенол о-крезол гидрохинон пирогаллол
(гидрокси- (2-гидрокси- (1,4-дигидрокси- (1,2,3-тригидрокси-
бензол) толуол) бензол) бензол)
Изомерия фенолов обусловлена положением гидроксильной группы. Для двухатомных фенолов, как и для других двузамещенных ароматических соединений, известны три изомера – орто-, мета- и пара-:

пирокатехин резорцин гидрохинон
(1,2-дигидрокси- (1,3-дигидрокси- (1,4-дигидрокси-
бензол) бензол) бензол)
(т. пл. 105С) (т. пл. 110С) (т. пл. 171С)
Физические свойства
Фенолы – кристаллические вещества или высококипящие жидкости, обладающие сильным характерным запахом. Плотность фенолов около 1 г/мл. Бóльшая кислотность атома водорода гидроксильной группы по сравнению со спиртами отражается на физических свойствах фенолов. Они образуют более прочные водородные связи, имеют более высокие температуры кипения, большую растворимость в воде по сравнению с соответствующими циклическими спиртами (табл. 2).
Таблица 2
