
- •Кислородсодержащие органические соединения спирты
- •Физические свойства спиртов
- •1. Кислотно-основные свойства
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •5. Дегидратация спиртов
- •Кислотно-основное взаимодействие
- •Нуклеофильное замещение
- •6. Реакции окисления
- •7. Каталитическое дегидрирование
- •Физические свойства фенола и циклогексанола
- •Альдегиды и кетоны
- •Названия некоторых альдегидов
- •Названия некоторых кетонов
- •Физические свойства некоторых альдегидов и кетонов
- •Карбоновые кислоты
- •Названия некоторых карбоновых кислот
- •Физические свойства некоторых одноосновных карбоновых кислот
- •Азотсодержащие органические соединения
- •Физические свойства некоторых аминов
- •– Образование сложных эфиров (этерификация):
- •Азотсодержащие гетероциклические соединения
- •Нуклеиновые кислоты
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ КИРОВСКОЙ ОБЛАСТИ
ЦЕНТР ДОПОЛНИТЕЛЬНОГО ОБРАЗОВАНИЯ ОДАРЕННЫХ ШКОЛЬНИКОВ
ХИМИЧЕСКОЕ ОТДЕЛЕНИЕ
ВЯТСКИЙ ГОСУДАРСТВЕННЫЙ ГУМАНИТАРНЫЙ УНИВЕРСИТЕТ
НАУЧНО-ИССЛЕДОВАТЕЛЬСКАЯ ЛАБОРАТОРИЯ
МЕТОДИКИ ОБУЧЕНИЯ ХИМИИ

М.А. ЗАЙЦЕВ
КИСЛОРОД- И АЗОТСОДЕРЖАЩИЕ
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Учебное пособие
Киров
2009
ББК 74.26
З-17
Рецензенты: В.П. Исупов, методист и преподаватель химического отделения ЦДООШ;
Е.В. Береснева, доцент кафедры химии и методики обучения химии ВятГГУ, кандидат педагогических наук.
З-17 Зайцев М.А. Кислород- и азотсодержащие органические соединения. Учебное пособие. Для учащихся ЦДООШ. – Киров: ЦДООШ, 2009. – 40 с.
В учебном пособии рассмотрены строение молекул, способы получения и свойства спиртов, альдегидов и кетонов, карбоновых кислот, жиров, углеводов, аминов, аминокислот, белков, азотсодержащих гетероциклов, нуклеиновых кислот. Приведены примеры задач по химии кислород- и азотсодержащих органических соединений. Пособие будет полезно не только учащимся заочного химического отделения ЦДООШ, но и другим школьникам при подготовке к олимпиадам, абитуриентам при подготовке к вступительным экзаменам, студентам вузов, изучающим химию и учителям средних школ.
ЦДООШ, 2009
НИЛМОХ ВятГГУ, 2009
М. А. Зайцев, 2009
Кислородсодержащие органические соединения спирты
Спирты – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы.
В зависимости от числа гидроксилов в молекуле спирты делятся на следующие группы.
1. Одноатомные:
СН3–СН2–ОН этанол (этиловый спирт)
СН2=СН–СН2–ОН пропен-2-ол-1 (аллиловый спирт)
С6Н5–СН2–ОН бензиловый спирт
2. Двухатомные (гликоли):
НО–СН2–СН2–ОН этандиол-1,2 (этиленгликоль)
3. Трехатомные:
 пропантриол-1,2,3
(глицерин)
пропантриол-1,2,3
(глицерин)
4. Многоатомные:
 миоинозит
миоинозит
В зависимости от характера углеводородного радикала спирты делят на ациклические (насыщенные и ненасыщенные), циклические и ароматические.
Одноатомные спирты
Номенклатура и изомерия
По заместительной номенклатуре названия спиртов составляют из названия родоначального углеводорода с прибавлением суффикса -ол. Нумерацию главной цепи начинают с того конца, ближе к которому находится гидроксильная группа. По радикало-функциональной номенклатуре название производят от названия углеводородного радикала, связанного с гидроксильной группой, с прибавлением слова спирт.
СН3–СН2–ОН СН3–СН2–СН2–ОН СН3–СН(ОН)–СН3
Этанол Пропанол-1 Пропанол-2
(этиловый спирт) (пропиловый спирт) (изопропиловый спирт)
В зависимости от того, при каком атоме углерода находится гидроксильная группа, различают первичные (пропанол-1, бутанол-1), вторичные (пропанол-2, бутанол-2) и третичные (2-метилпропанол-2) спирты.
Структурная изомерия спиртов определяется изомерией углеродного скелета и изомерией положения гидроксильной группы:

Число структурных изомеров в гомологическом ряду спиртов быстро возрастает. Например, на основе бутана существует 4 изомера, пентана – 8, а декана – уже 567.
Способы получения
1. Гидратация алкенов в кислой среде (этот способ получения спиртов имеет большое промышленное значение – этим способом получают спирты из газов крекинга).
СН2=СН2 + Н2О СН3–СН2ОН (первичный спирт);
этанол
 (вторичный
спирт);
(вторичный
спирт);
пропанол-2
 (третичный
спирт);
(третичный
спирт);
2-метилпропанол-2
Условия: прямая гидратация – смесь алкенов с водяным паром пропускают над фосфатным катализатором (Н3РО4 на алюмосиликате с солями кадмия, меди, кобальта), 300С, 8 МПа.
2. Получение из галогенопроизводных (гидролиз):
R–Cl
+ KOH
![]() R–OH + KCl
R–OH + KCl
3. Восстановление альдегидов и кетонов:
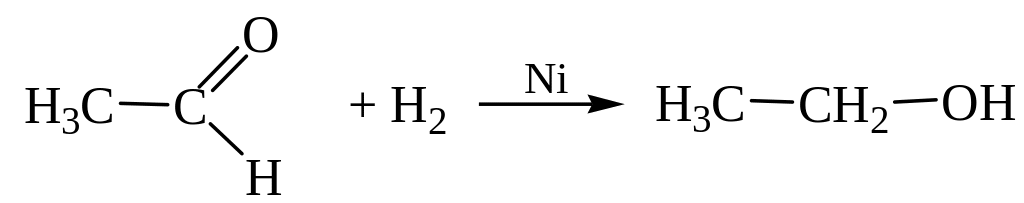
Этаналь (ацетальдегид) Этанол

Пропанон (ацетон) Пропанол-2
Физические свойства
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества. Для низших нормальных (неразветвленных) первичных спиртов разность температур кипения гомологов составляет примерно 20°С (табл. 1).
Таблица 1
Физические свойства спиртов
Отдельные представители |
Физические свойства |
||
Название |
Структурная формула |
Тпл., С |
Ткип., С |
Метанол (метиловый) |
СН3ОН |
–97 |
64,5 |
Этанол (этиловый) |
СН3–СН2–ОН |
–115 |
78 |
Пропанол-1 (н-пропиловый) |
СН3–СН2–СН2–ОН |
–127 |
97 |
Пропанол-2 (изопропиловый) |
СН3–СН(ОН)–СН3 |
–86 |
82,5 |
Бутанол-1 (н-бутиловый) |
СН3–(СН2)2–СН2–ОН |
–80 |
118 |
2-Метилпропанол-1 (изобутиловый) |
(СН3)2СН–СН2–ОН |
–108 |
108 |
Бутанол-2 (втор-бутиловый) |
СН3–СН(ОН)–СН2–СН3 |
–114 |
99,5 |
2-Метилпропанол-2 (трет-бутиловый) |
(СН3)3С–ОН |
25,5 |
83 |
3-Метил-1-бутанол (изоамиловый спирт) |
(СН3)2СН–СН2–СН2–ОН |
–117,2 |
131,4 |
Циклогексанол |
С6Н11ОН |
24 |
161,5 |
Фенилметанол (бензиловый) |
С6Н5–СН2–ОН |
–15 |
205 |
Пропен-2-ол-1 (аллиловый) |
СН2=СН–СН2–ОН |
–129 |
97 |
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает. Высшие спирты практически не растворимы в воде. Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Низшие гликоли – вязкие бесцветные жидкости, не имеющие запаха; хорошо растворимы в воде и этаноле, обладают сладким вкусом.
С введением в молекулу второй гидроксильной группы происходит повышение относительной плотности и температуры кипения спиртов. Например, плотность этиленгликоля при 0°С – 1,13, а этилового спирта – 0,81.
Водородные связи
Спирты обладают аномально высокими температурами кипения по сравнению с представителями таких классов органических соединений, как алканы, галогеналканы, тиолы, амины, например, температура кипения этанола 78°С, тогда как хлорэтана – 13°С, а этана – –88,5°С. Эти различия объясняются особенностями строения спиртов. Атом кислорода в молекуле спирта обладает большой электроотрицательностью и оттягивает на себя электронную плотность -связей связанных с ним атомов, в частности атома водорода. Связь О–Н в молекуле спирта сильно поляризована RОН. Электронная плотность на атоме водорода оказывается пониженной. Поэтому он может взаимодействовать с неподеленной парой электронов атома кислорода другой молекулы спирта. Между двумя молекулами возникает нековалентная водородная связь. Молекулы, связанные между собой водородными связями, образуют ассоциаты:

Образование ассоциатов как бы увеличивает массу спирта и понижает его летучесть. Прочность водородных связей невелика, но для их разрыва при переходе молекулы из жидкого в газообразное состояние требуется дополнительная энергия. Этим и объясняются высокие температуры кипения спиртов. Наибольшую склонность к образованию водородных связей проявляют первичные спирты. Для вторичных и особенно третичных спиртов способность к ассоциации уменьшается, поскольку образованию водородных связей препятствуют разветвленные углеводородные радикалы.
Химические свойства
Главные химические свойства спиртов обусловливает функциональная группа – гидроксильная. Связи С–О и О–Н поляризованы, причем отрицательным полюсом диполя является атом кислорода как более электроотрицательный. На атомах С и Н имеются частичные положительные заряды:
R–С+Н2О–Н+.
Такой электронный характер гидроксильной группы предопределяет ее склонность к реакциям гетеролитического типа, в ходе которых может разрываться связь С–О или О–Н.
