
- •Глава 1. (введение). “кризис” кинетической теории. Необходимое изменение традиционной молекулярной модели. История и состояние вопроса
- •Глава 2. Компьютерное моделирование затвердевания. Отсутствие затвердевания в традиционной модели. Характер эффектов, стабилизирующих структуру
- •Глава 3. Квазикристаллические свойства жидкостей.
- •1.1.1. В традиционной модели нет затвердевания
- •1.1.3. Затвердевание как следствие нарастания атомарных квантовых эффектов
- •1.1.5. История вопроса об отсутствии затвердевания
- •1.1.6. Соотношение теории и опыта. Психологические аспекты
- •1.1.7. Общая физическая причина обсуждаемых дискуссий
- •1.1.8. Квазикристаллические свойства жидкости
- •1.2. Феноменологическое описание свойств жидкости и твердого тела, представление о их противоположности.
- •1.2.1. Прочность и дальний порядок
- •1.2.2. Формирование традиционной молекулярной модели жидкости и затвердевания
- •1.2.3. Успехи кинетической теории на основе традиционной модели
- •1.2.4. Современный вид традиционной модели
- •1.2.5. Аналитические оценки кинетических свойств
- •1.2.6.Выявление неадекватности модели. Анализ прочности на атомарном уровне
- •1.2.7.Структурный подход к плавлению
- •1.2.8. Энергии активации
- •1.2.9. Нарастание трудностей в истолковании фазовых переходов
- •1.2.10. Признаки застоя в молекулярной теории кинетических свойств
- •1.3. Заключение
- •1.3.1. Мировоззренческий характер традиционных взглядов. Влияние философии
- •Традиционная модель и философия
- •Традиционная модель и философия
- •Кризисы в разных областях исследования
- •1.3.2. О химической форме движения материи
- •1.3.3. Ориентировочные оценки и строгие методы. Математизация исследований
- •1.3.4.Математизация исследований. Вытеснение
- •1.3.5. Приближённые оценки
- •1.4. Заключение к главе 1
- •Глава 2. Компьютерное моделирование затвердевания. Характер эффектов, стабилизирующих структуру
- •2.1 Прямое моделирование процессов переноса. Отсутствие затвердевания в традиционной модели
- •2.1.1.Затвердевание как скачок кинетических свойств
- •2.1.2. Прямое компьютерное моделирование вязкого или пластического течения и ионного электропереноса
- •2.1.3. Течение в модели при температурах около абсолютного нуля
- •2.1.4. Релаксация механических напряжений. Деформация постоянной силой
- •2.2. Обсуждение результатов моделирования
- •2.2.1.Температурная зависимость кинетических свойств
- •2.2.2. Влияние вида парного потенциала
- •2.2.3. Молекулярный механизм пластической деформации или вязкого течения
- •2.2.4. Молекулярный механизм течения около абсолютного нуля
- •2.3. Кристаллизация. Устойчивость
- •2.3.1. Моделирование кристаллизации
- •2.3.2. Устойчивость решеток и сеток
- •2.3.3. Определение мягких мод в компьютерном эксперименте
- •2.4. Состояние вопроса об отсутствии затвердевания
- •2.4.1. Литературные данные
- •2.4.2. Расхождение традиционной модели с действительностью по дальнему порядку и размытости фазовых переходов
- •2.5. Затвердевание как переход в квантовую область. Подбор потенциала для стабилизирующих структуру эффектов
- •2.5.1. Затвердевание приходится на температуры перехода из классической области в квантовую
- •2.5.2. Подобие затвердевания и перехода к сверхтекучести
- •2.5.3. Диаграммы состояния других веществ в области около абсолютного нуля
- •2.5.4. Подбор поправки к потенциалу для выражения эффектов, стабилизирующих структуру
- •2.5.5. Влияние направленности и ковалентности связи
- •2.5.6. Другие свойства твердых тел, не объясняющиеся в рамках традиционной модели
- •2.6. Заключение к гЛаве 2. Состояние вопроса
- •Глава 3. Квазикристалличекие свойства жидкостей
- •3.1. Традиционная модель и квазикристаллические свойства. Состояние вопроса
- •3.1.1. Введение
- •3.2. Модуль сдвига и предел прочности жидкости
- •3.2.1. Экспериментальная часть
- •3.2.2. Обсуждение результатов. Состояние вопроса
- •3.2.3. Последействие
- •3.3. Особенности на политермах и структурные перестройки в жидкости
- •3.3.1. Превращение в жидком железе около 1640 oС
- •3.3.2. Превращения в силикатных расплавах
- •3.3.3. Политермы вязкости воды
- •3.3.4. Дифференциальные координаты
- •3.4. О дальнем порядке в жидкости
- •3.4.1. Экспериментальные данные
- •3.4.2. Огранка
- •3.4.3. Сопоставление с традиционным подходом. Состояние вопроса
- •3.5. Осцилляции
- •3. 6. Квазикристаллические свойства жидкости и генерация турбулентных пульсаций в гидродинамическом потоке. Состояние вопроса
- •3.6.1. Введение
- •3.6.2. История вопроса (по работам [12, 53, 133, 134])
- •3.6.3. Механизм генерации пульсаций в потоке при твердоподобном сопротивлении течению
- •3.6.4. Сопоставление с известными примерами генерации колебаний.
- •3.6.5. Концентрация течения в отдельных плоскостях
- •3.6.6. Образование вихрей
- •3.6.7. Объемная и поверхностная турбулизация
- •3.6.8. Резюме к параграфу 3.6
- •Глава 4. Зернистая, или блоковая, структура реальной жидкости
- •4.1. Блоки и размытость фазовых переходов
- •4.1.1. Температурный интервал размытия т переходов
- •4.1.2. Экспериментальные данные [28, 30]
- •4.1.3. Оценка величины "кванта превращения" при других переходах
- •4.1.4. Размытость "концентрационных фазовых переходов"
- •4.1.5. "Надмолекулярный" характер соединений в твердом теле
- •4.1.6. Устойчивость соединений. Выделение химического и структурного слагаемых в энергии взаимодействия
- •4.2. Неоднородность течения реальной жидкости. Зернистая структура и соотношение коэффициентов вязкости и диффузии
- •4.2.1. Неоднородность течения
- •4.2.2. Оценка размеров "блоков течения" в жидкости
- •4.3. Наследование зернистой структуры при плавлении и кристаллизации
- •4.3.1."Наследственность"
- •4.3.2. Потоковая обработка
- •4.3.3. Термовременная обработка жидкого металла (тво) [24, 25]
- •4.3.4. Зародышеобразование и кинетика кристаллизации
- •4.3.5. Микронеоднородность эвтектических расплавов
- •4.3.6. Влияние слабых полей. Ультразвуковая обработка
- •4.3.7. Жидкий кристалл
- •4.3.8. Зависимость свойств поликристалла от размера зерна. Сверхпластичность. Дисперсионное упрочнение
- •4.4.9. Микрокристаллитная и коллоидная модель стекла
- •4.3.10. Состояние вопроса
- •4.4. Заключение к главе 4
- •Глава 5. Структурные дальнодействия и поверхностные явления
- •5.1. Дальнодействия в пленках и коллоидах
- •5.1.1. Дальнодействия в модели
- •5.1.2. Опытные данные по пленкам
- •5.1.3. Вязкие коллоиды и гели
- •5.1.4. Обсуждение опытных данных. Состояние вопроса
- •5.2. Дальнодействия в твердом состоянии
- •5.2.1. Масштабный фактор прочности
- •5.2.3. Дисперсионное упрочнение
- •5.2.4. О морфологии включений, фаз эвтектики, растущих кристаллов
- •5.2.5. Эффект ребиндера
- •5.2.6. Ориентирующие взаимодействия кристаллов
- •5.3. Выделение вклада дальнодействий в поверхностном натяжении
- •5.3.1. Дальнодействия, толстые пленки и их вклад в поверхностное натяжение
- •5.3.2. Термодинамические функции взаимодействия
- •5.3.3. Энтропия взаимодействия и оценки плотности упаковки, степени квантовости
- •5.3.4. Модель разорванных связей
- •5. 3. 5. Электронные теории поверхностного натяжения
- •5. 3. 6. Уточнение формулы для поверхностного натяжения чистых жидкостей
- •5.3.7.Поверхностное натяжение растворов
- •5.3.8.Аномально высокая поверхностная активность
- •5.3.9. Межфазное натяжение
- •5.3.10.Выделение вклада структурных дальнодействий и толстых пленок в поверхностное натяжение. Граница кристалл-жидкость в однокомпонентной системе
- •5.3.11. Граница кристалл-газ. Межзеренные границы
- •5.3.12. Зависимость температуры кристаллизации от размера капельки
- •5.3.13. Решетка и огранка малых частиц
- •5.4. Спекание и смачивание. Роль структурных дальнодействий и толстых пленок
- •5.4.1. Кинетический акт в традиционной модели
- •5.4.2. Кинетический акт спекания и смачивания в предлагаемой модели. Трение
- •5.4.3. Опытные данные по скорости самого акта спекания (кинетического звена)
- •5.4.4. Кинетическое сопротивление растеканию
- •5.4.5. Транспортное сопротивление спеканию и смачиванию.
- •5.5. Поверхностные свойства и дальнодействующие структурные
- •Глава 6. Корреляция параметров затвердевания и стабильности структуры с приведенной температурой и с мерой квантовости.
- •6.2.Превращения в начале и конце интервала затвердевания.
- •6.2.1. Начало интервала затвердевания или переход от состояния простой жидкости к состоянию реальной (затвердевающей) жидкости.
- •6.2.2. Конец интервала затвердевания.
- •6.2.3. "Точка стеклования" кристаллических веществ.
- •6.3.Общая сxема изменения кинетических свойств.
- •6.3.1. Общая схема изменения кинетических свойств при стекловании и кристаллизации.
- •6.3.2. Общий вид и истолкование политерм вязкости. Состояние вопроса.
- •6.3.3. Описание затвердевания в терминах вязкости и прочности. O качественном различии жидкости и твердого тела.
- •6.3.4. Тепловой эффект, сопровождающий повышение вязкости.
- •6.3.5. Химические классы жидкостей и стадии затвердевания.
- •6.4. Влияние атомарных квантовых эффектов.
- •6.4.1. Затвердевание и “степень квантовости”.
- •6. 4. 2. Влияние квантового параметра на tемпературу плавления.
- •6.5. Аналогичные закономерности для скорости химических реакций.
- •6.5.1. Подобие закономерностей для стабильности межмолекулярной и внутримолекулярной структуры. Постановка вопроса.
- •6.5.2. Зависимость стабильности внутримолекулярной структуры и “степени молекулярности” от квантового параметра.
- •6.5.3. Переходы от молекулярной формы к атомарной. Стёкла как промежуточные состояния.
- •6.5.4.Размягчение внутримолекулярной структуры при нагреве. Температурная зависимость энергий активации химических реакций.
- •6.5.5.Другие закономерности. Усреднение степени молекулярности компонентов раствора и катализ.
- •6.5.6. Перераспределение суммарной стабильности между внутри- и межмолекулярной структурой.
- •6.5.7. Перераспределение жесткости структуры и термодинамические характеристики плавления молекулярных веществ.
- •6.5.8.Простая атомарная многокомпонентная жидкость.
- •6.6. Заключение. Состояние вопроса.
- •6.6.1. Основные результаты.
- •7. Резюме.
- •Часть 2. - м.: Металлургиздат, 1966, 720 с.
5. 3. 6. Уточнение формулы для поверхностного натяжения чистых жидкостей
Определяя потенциал взаимодействия жидкости вз по давлению паров, вз = RTln(RT/pVж), получаем из формулы (5.11):
= *RTln(RT/pVж)/No1/3Vж2/3 . (5.13)
По этой формуле, а также по аналогичному уравнению, выражающему натяжение через Fвз, было рассчитано поверхностное натяжение 160 жидкостей различной природы. Удовлетворительное согласие получается для молекулярных жидкостей от температуры плавления до околокритической области; для жидких металлов и полупроводников, окислов, стеклообразующих соединений со смешанным ионно-ковалентным взаимодействием и др. Ошибка расчета в большинстве случаев не превысила 5%. Расчет температурного коэффициента d/dT в результате замены Uвз на вз уточняется еще в большей степени, чем расчет самого натяжения. Политерма натяжения принимает вид, близкий к экспериментальной, за исключением околокритической области [179].
Формула (5.13), опубликованная в 1963 году [185 ], получила многочисленные отклики и применялась затем многими исследователями. Просьбы выслать оттиски работы поступили из 10 исследовательских центров Европы и Америки. Американские исследователи Гольд и Огле [186] проверили применимость предложенной формулы для еще 800 других жидкостей и сочли её одной из более точных; она вошла в справочник [187] в числе “наиболее достоверных методов расчета” поверхностного натяжения. Подобное уточнение формул для поверхностного натяжения в рамках традиционной молекулярной модели вещества было близко, очевидно, к направлению поисков многих исследователей. Более сложные последующие работы, выходящие за рамки традиционной модели и опровергающие ее в некоторых пунктах, обычно не получали откликов или же получали резко отрицательные отзывы.
5.3.7.Поверхностное натяжение растворов
С помощью потенциалов взаимодействия вз легко получаются также и формулы для поверхностного натяжения растворов, в частности, для изотерм натяжения. Условие равновесия поверхностного слоя и объёма по компоненту i записывается как равенство полных потенциалов i , включающих идеальное слагаемое ид= идо+ RTlnC, потенциал химических взаимодействий вз и член i, выражающий действие натяжения:
вз i - взv i i = RTlnCi/Civ = 0 .
Здесь - парциальная молярная площадь компонента в поверхностном слое; величина i= вз i -взv i выражает работу выхода компонента в поверхностный слой. Переходя от объемных концентраций к мольным долям Ni=Ci/Ci, из условия Ni=1 получаем:
(V/V)Niexp(i-i)/RT = 1 . ( 5.14)
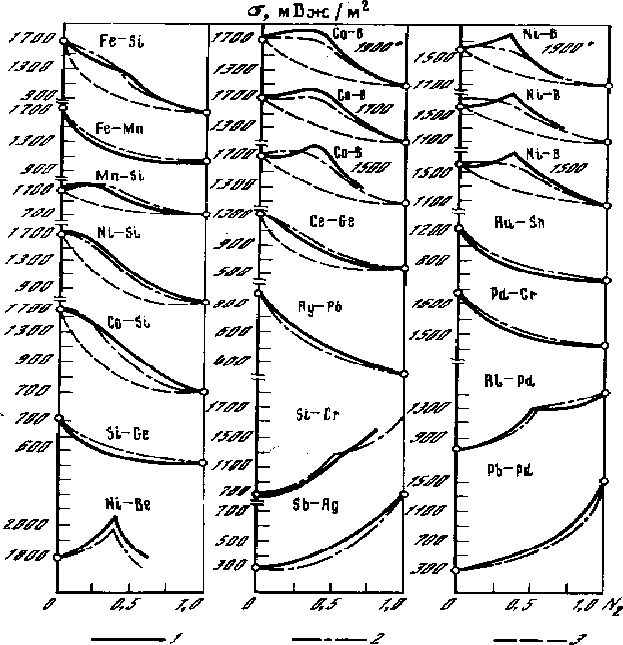
Рис. 5.6. Изотермы поверхностного натяжения бинарных систем: 1- опытные, 2- рассчитанные по уравнению (5.14), 3- идеальная изотерма Жуховицкого А. А. Уравнение (5.14) описывает изотермы с максимумом, минимумом, перегибом и др.
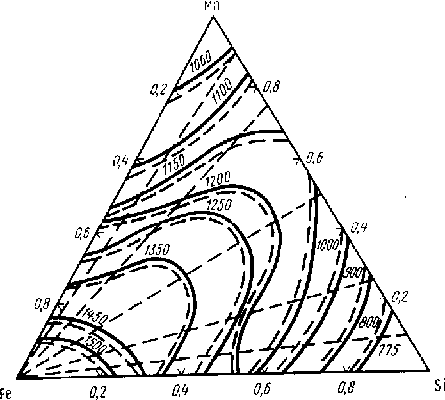
Рис.5.7 Расчётные (сплошные) и опытные (штриховые) линии равного натяжения в тройной системе Fe - Si - Mn
Это уравнение и решает поставленную задачу; оно определяет натяжение раствора в виде неявной функции концентраций Сi и температуры Т, причем интенсивность взаимодействия компонента в растворе характеризуется концентрациями частиц в растворе и в парах; вз= RTln(Cр/Cп) и может быть рассчитан по парциальному давлению пара. Это уравнение с успехом применялось для определения абсолютных значений натяжения раствора и поверхностной активности компонентов d/dN по давлениям паров и другим термодинамическим данным [22,179]. Однако в основном его использовали для определения вида политерм и изотерм поверхностного натяжения растворов. В этом случае натяжения чистых веществ io считаются известными, а концентрационная зависимость парциальных площадей i, натяжений i и работ i выхода в поверхностный слой определяются уравнениями:
i = ioio -iRTlni = ii ;
i = No1/3Vж2/3,
i - объемные коэффициенты активности. В случае идеального бинарного раствора, при близких размерах частиц (парциальных объёмах) уравнение (5.14) переходит в формулу Шишковского, которую выводят интегрированием адсорбционного уравнения Гиббса при адсорбции, определенной по формуле Ленгмюра. При неодинаковых, но не зависящих от концентрации размерах частиц из (5.14) получается формула Жуховицкого, а в случае многокомпонентной системы - современные уравнения изотерм Спроу-Праузнитца и Эрикссона (подробнее см. [179,22]).
Уравнение (5.14) позволило, по видимому, впервые, описать сложные неидеальные изотермы с точками перегиба, максимума, минимума и др. (рис. 5.6, 5.7). В связи с этим уравнение (5.14) широко применялось многими исследователями для описания сложных изотерм натяжения в различных исследовательских центрах СССР: в Свердловске, Киеве, Москве, Тбилиси и др.; примерно в 50 диссертациях оно было одним из основных или основным приемом анализа (подробнее см. фундаментальную монографию С.И. Попеля [179]) .
Интересно, что отклонения изотермы поверхностного натяжения pаствора от идеальной кривой при этом оказались связаны в основном с изменениями парциальных объёмов компонентов и, соответственно, парциальных площадей i = No1/3Vж2/3. В предшествующих работах неидеальность раствора по натяжению связывали обычно с концентрационными изменениями энергии взаимодействия; задача описания неидеальной изотермы натяжения сводилась к построению теории коэффициентов активности в поверхностном слое.
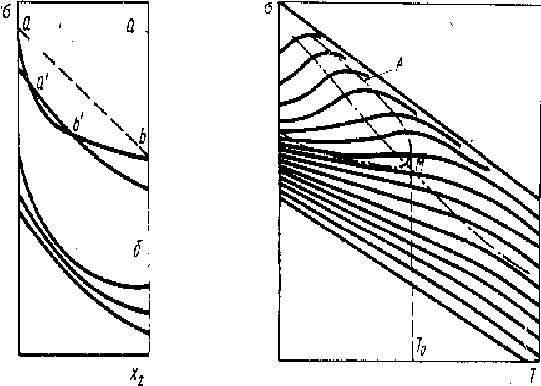
Рис. 5.8. Вид политерм поверхностного натяжения двойной системы. В области , ограниченной штриховой кривой, температурный коэффициент — положителен, а на границе наблюдается “температурная буферность” поверхностного натяжения
С помощью уравнения (5.14) был успешно описан ряд закономерностей поверхностной активности компонентов раствора. Получила описание также “температурная буферность” поверхностного натяжения. Семейство политерм поверхностного натяжения раствора имеет вид - рис. 5.8. Температурный коэффициент натяжения d/dT чистых веществ отрицателен; в растворе к нему добавляется второе, адсорбционное положительное слагаемое; при нагреве адсорбция уменьшается, что ведет к увеличению натяжения . В результате появляется область температур и концентраций, в которой второе слагаемое преобладает и температурный коэффициент d/dT раствора в целом становится положительным, (см. рис 5.8).
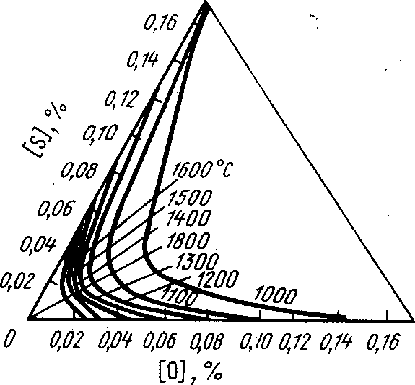
Рис. 5.9. Взаимное усиление поверхностной активности серы и кислорода в железе. При аддитивной поверхностной активности линии равного натяжения - прямые.
Рис.5.10. Аномальные изотермы адсорбции по Гиббсу. Участок (аб) изотермы противоречит термодинамике, так как концентрация примеси в поверхностном слое убывает при росте концентрации в объёме.
