
- •Глава 1. (введение). “кризис” кинетической теории. Необходимое изменение традиционной молекулярной модели. История и состояние вопроса
- •Глава 2. Компьютерное моделирование затвердевания. Отсутствие затвердевания в традиционной модели. Характер эффектов, стабилизирующих структуру
- •Глава 3. Квазикристаллические свойства жидкостей.
- •1.1.1. В традиционной модели нет затвердевания
- •1.1.3. Затвердевание как следствие нарастания атомарных квантовых эффектов
- •1.1.5. История вопроса об отсутствии затвердевания
- •1.1.6. Соотношение теории и опыта. Психологические аспекты
- •1.1.7. Общая физическая причина обсуждаемых дискуссий
- •1.1.8. Квазикристаллические свойства жидкости
- •1.2. Феноменологическое описание свойств жидкости и твердого тела, представление о их противоположности.
- •1.2.1. Прочность и дальний порядок
- •1.2.2. Формирование традиционной молекулярной модели жидкости и затвердевания
- •1.2.3. Успехи кинетической теории на основе традиционной модели
- •1.2.4. Современный вид традиционной модели
- •1.2.5. Аналитические оценки кинетических свойств
- •1.2.6.Выявление неадекватности модели. Анализ прочности на атомарном уровне
- •1.2.7.Структурный подход к плавлению
- •1.2.8. Энергии активации
- •1.2.9. Нарастание трудностей в истолковании фазовых переходов
- •1.2.10. Признаки застоя в молекулярной теории кинетических свойств
- •1.3. Заключение
- •1.3.1. Мировоззренческий характер традиционных взглядов. Влияние философии
- •Традиционная модель и философия
- •Традиционная модель и философия
- •Кризисы в разных областях исследования
- •1.3.2. О химической форме движения материи
- •1.3.3. Ориентировочные оценки и строгие методы. Математизация исследований
- •1.3.4.Математизация исследований. Вытеснение
- •1.3.5. Приближённые оценки
- •1.4. Заключение к главе 1
- •Глава 2. Компьютерное моделирование затвердевания. Характер эффектов, стабилизирующих структуру
- •2.1 Прямое моделирование процессов переноса. Отсутствие затвердевания в традиционной модели
- •2.1.1.Затвердевание как скачок кинетических свойств
- •2.1.2. Прямое компьютерное моделирование вязкого или пластического течения и ионного электропереноса
- •2.1.3. Течение в модели при температурах около абсолютного нуля
- •2.1.4. Релаксация механических напряжений. Деформация постоянной силой
- •2.2. Обсуждение результатов моделирования
- •2.2.1.Температурная зависимость кинетических свойств
- •2.2.2. Влияние вида парного потенциала
- •2.2.3. Молекулярный механизм пластической деформации или вязкого течения
- •2.2.4. Молекулярный механизм течения около абсолютного нуля
- •2.3. Кристаллизация. Устойчивость
- •2.3.1. Моделирование кристаллизации
- •2.3.2. Устойчивость решеток и сеток
- •2.3.3. Определение мягких мод в компьютерном эксперименте
- •2.4. Состояние вопроса об отсутствии затвердевания
- •2.4.1. Литературные данные
- •2.4.2. Расхождение традиционной модели с действительностью по дальнему порядку и размытости фазовых переходов
- •2.5. Затвердевание как переход в квантовую область. Подбор потенциала для стабилизирующих структуру эффектов
- •2.5.1. Затвердевание приходится на температуры перехода из классической области в квантовую
- •2.5.2. Подобие затвердевания и перехода к сверхтекучести
- •2.5.3. Диаграммы состояния других веществ в области около абсолютного нуля
- •2.5.4. Подбор поправки к потенциалу для выражения эффектов, стабилизирующих структуру
- •2.5.5. Влияние направленности и ковалентности связи
- •2.5.6. Другие свойства твердых тел, не объясняющиеся в рамках традиционной модели
- •2.6. Заключение к гЛаве 2. Состояние вопроса
- •Глава 3. Квазикристалличекие свойства жидкостей
- •3.1. Традиционная модель и квазикристаллические свойства. Состояние вопроса
- •3.1.1. Введение
- •3.2. Модуль сдвига и предел прочности жидкости
- •3.2.1. Экспериментальная часть
- •3.2.2. Обсуждение результатов. Состояние вопроса
- •3.2.3. Последействие
- •3.3. Особенности на политермах и структурные перестройки в жидкости
- •3.3.1. Превращение в жидком железе около 1640 oС
- •3.3.2. Превращения в силикатных расплавах
- •3.3.3. Политермы вязкости воды
- •3.3.4. Дифференциальные координаты
- •3.4. О дальнем порядке в жидкости
- •3.4.1. Экспериментальные данные
- •3.4.2. Огранка
- •3.4.3. Сопоставление с традиционным подходом. Состояние вопроса
- •3.5. Осцилляции
- •3. 6. Квазикристаллические свойства жидкости и генерация турбулентных пульсаций в гидродинамическом потоке. Состояние вопроса
- •3.6.1. Введение
- •3.6.2. История вопроса (по работам [12, 53, 133, 134])
- •3.6.3. Механизм генерации пульсаций в потоке при твердоподобном сопротивлении течению
- •3.6.4. Сопоставление с известными примерами генерации колебаний.
- •3.6.5. Концентрация течения в отдельных плоскостях
- •3.6.6. Образование вихрей
- •3.6.7. Объемная и поверхностная турбулизация
- •3.6.8. Резюме к параграфу 3.6
- •Глава 4. Зернистая, или блоковая, структура реальной жидкости
- •4.1. Блоки и размытость фазовых переходов
- •4.1.1. Температурный интервал размытия т переходов
- •4.1.2. Экспериментальные данные [28, 30]
- •4.1.3. Оценка величины "кванта превращения" при других переходах
- •4.1.4. Размытость "концентрационных фазовых переходов"
- •4.1.5. "Надмолекулярный" характер соединений в твердом теле
- •4.1.6. Устойчивость соединений. Выделение химического и структурного слагаемых в энергии взаимодействия
- •4.2. Неоднородность течения реальной жидкости. Зернистая структура и соотношение коэффициентов вязкости и диффузии
- •4.2.1. Неоднородность течения
- •4.2.2. Оценка размеров "блоков течения" в жидкости
- •4.3. Наследование зернистой структуры при плавлении и кристаллизации
- •4.3.1."Наследственность"
- •4.3.2. Потоковая обработка
- •4.3.3. Термовременная обработка жидкого металла (тво) [24, 25]
- •4.3.4. Зародышеобразование и кинетика кристаллизации
- •4.3.5. Микронеоднородность эвтектических расплавов
- •4.3.6. Влияние слабых полей. Ультразвуковая обработка
- •4.3.7. Жидкий кристалл
- •4.3.8. Зависимость свойств поликристалла от размера зерна. Сверхпластичность. Дисперсионное упрочнение
- •4.4.9. Микрокристаллитная и коллоидная модель стекла
- •4.3.10. Состояние вопроса
- •4.4. Заключение к главе 4
- •Глава 5. Структурные дальнодействия и поверхностные явления
- •5.1. Дальнодействия в пленках и коллоидах
- •5.1.1. Дальнодействия в модели
- •5.1.2. Опытные данные по пленкам
- •5.1.3. Вязкие коллоиды и гели
- •5.1.4. Обсуждение опытных данных. Состояние вопроса
- •5.2. Дальнодействия в твердом состоянии
- •5.2.1. Масштабный фактор прочности
- •5.2.3. Дисперсионное упрочнение
- •5.2.4. О морфологии включений, фаз эвтектики, растущих кристаллов
- •5.2.5. Эффект ребиндера
- •5.2.6. Ориентирующие взаимодействия кристаллов
- •5.3. Выделение вклада дальнодействий в поверхностном натяжении
- •5.3.1. Дальнодействия, толстые пленки и их вклад в поверхностное натяжение
- •5.3.2. Термодинамические функции взаимодействия
- •5.3.3. Энтропия взаимодействия и оценки плотности упаковки, степени квантовости
- •5.3.4. Модель разорванных связей
- •5. 3. 5. Электронные теории поверхностного натяжения
- •5. 3. 6. Уточнение формулы для поверхностного натяжения чистых жидкостей
- •5.3.7.Поверхностное натяжение растворов
- •5.3.8.Аномально высокая поверхностная активность
- •5.3.9. Межфазное натяжение
- •5.3.10.Выделение вклада структурных дальнодействий и толстых пленок в поверхностное натяжение. Граница кристалл-жидкость в однокомпонентной системе
- •5.3.11. Граница кристалл-газ. Межзеренные границы
- •5.3.12. Зависимость температуры кристаллизации от размера капельки
- •5.3.13. Решетка и огранка малых частиц
- •5.4. Спекание и смачивание. Роль структурных дальнодействий и толстых пленок
- •5.4.1. Кинетический акт в традиционной модели
- •5.4.2. Кинетический акт спекания и смачивания в предлагаемой модели. Трение
- •5.4.3. Опытные данные по скорости самого акта спекания (кинетического звена)
- •5.4.4. Кинетическое сопротивление растеканию
- •5.4.5. Транспортное сопротивление спеканию и смачиванию.
- •5.5. Поверхностные свойства и дальнодействующие структурные
- •Глава 6. Корреляция параметров затвердевания и стабильности структуры с приведенной температурой и с мерой квантовости.
- •6.2.Превращения в начале и конце интервала затвердевания.
- •6.2.1. Начало интервала затвердевания или переход от состояния простой жидкости к состоянию реальной (затвердевающей) жидкости.
- •6.2.2. Конец интервала затвердевания.
- •6.2.3. "Точка стеклования" кристаллических веществ.
- •6.3.Общая сxема изменения кинетических свойств.
- •6.3.1. Общая схема изменения кинетических свойств при стекловании и кристаллизации.
- •6.3.2. Общий вид и истолкование политерм вязкости. Состояние вопроса.
- •6.3.3. Описание затвердевания в терминах вязкости и прочности. O качественном различии жидкости и твердого тела.
- •6.3.4. Тепловой эффект, сопровождающий повышение вязкости.
- •6.3.5. Химические классы жидкостей и стадии затвердевания.
- •6.4. Влияние атомарных квантовых эффектов.
- •6.4.1. Затвердевание и “степень квантовости”.
- •6. 4. 2. Влияние квантового параметра на tемпературу плавления.
- •6.5. Аналогичные закономерности для скорости химических реакций.
- •6.5.1. Подобие закономерностей для стабильности межмолекулярной и внутримолекулярной структуры. Постановка вопроса.
- •6.5.2. Зависимость стабильности внутримолекулярной структуры и “степени молекулярности” от квантового параметра.
- •6.5.3. Переходы от молекулярной формы к атомарной. Стёкла как промежуточные состояния.
- •6.5.4.Размягчение внутримолекулярной структуры при нагреве. Температурная зависимость энергий активации химических реакций.
- •6.5.5.Другие закономерности. Усреднение степени молекулярности компонентов раствора и катализ.
- •6.5.6. Перераспределение суммарной стабильности между внутри- и межмолекулярной структурой.
- •6.5.7. Перераспределение жесткости структуры и термодинамические характеристики плавления молекулярных веществ.
- •6.5.8.Простая атомарная многокомпонентная жидкость.
- •6.6. Заключение. Состояние вопроса.
- •6.6.1. Основные результаты.
- •7. Резюме.
- •Часть 2. - м.: Металлургиздат, 1966, 720 с.
5.3.3. Энтропия взаимодействия и оценки плотности упаковки, степени квантовости
Для выяснения физического смысла энтропии взаимодействия представляет интерес уравнение S - Sид = RlnVс/V [181]. Но при обычном выводе этой формулы делаются довольно грубые допущения; свободный объём Vс и энергия Uвз считаются не зависящими от температуры, и др. [181].
Известное статистическое определение свободного объёма в ячеечной модели Vс = exp ((Uвз - Uвзо)/kT)dV целесообразно несколько изменить, заменяя уровень дна потенциальной ямы Uвзо средней энергией взаимодействия Uвзср и записать: Vс = exp ((Uвз - Uвзср)/kT)dV . (5.4)
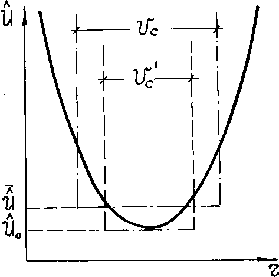
Рис.5.2. Схема статистического определения свободного объёма.
Реальная потенциальная яма заменяется термодинамически эквивалентной прямоугольной ямой с плоским дном, в пределах которой атом движется свободно. При этом реальная потенциальная яма ячейки (рис. 5.2) как бы заменяется эквивалентной ямой с плоским дном объёмом Vс таким образом, что энергия, энтропия и другие термодинамические функции системы не изменяются в результате такой замены взаимодействия (ямы).
Уравнение Fвз= kTlnQвз можно записать в следующем виде:
Fвз = Uвз + (kT*ln exp((Uвз - Uвзcp)/kT)*d )/ . (5.5)
Здесь d= dq11 dq12...dq3N -элементарный объём в координатном фазовом пространстве, = VN - его полная величина. Так как Fвз=Uвз - TSвз, то из формулы (5.5) следует:
Sвз = k*ln /c , (5.6)
где c = (exp(Uвз - Uвзcp)/kT)d(5.7)
Сравнивая последнюю формулу (5.7) с определением свободного объёма (5.4), замечаем, что величина с имеет смысл свободного 3N -мерного координатного фазового пространства. Здесь также можно считать, что сложная реальная 3N-мерная энергетическая поверхность Uвз= f(q11,q12 ...q3N) заменяется эквивалентной совокупностью 3N-мерных ям и ложбин, в пределах которых фигуративная точка системы свободно движется по законам идеального газа, как и атом в яме с плоским дном, (см. рис. 5.2). Другие точки объёма ямы на рис. 5.2, не входящие в свободный объём, считаются не доступными для частицы; недоступными предполагаются и участки полного фазового пространства, не входящие в с.
Часто с той или иной точностью можно выделить группы из небольшого числа n координат так, что изменения энергии взаимодействия по данным координатам будут зависеть только от них, Uвз= f(q1, q2,...qn). Тогда в свободном фазовом пространстве выделяется множитель, характеризующий свободный n-мерный фазовый объём cn:
cn = ... exp(Uвзn - (Uвзn)cp)/kT*dn
и соответствующий вклад данной группы координат в энтропию взаимодействия Sвз = klnn/cn. При n = 1, 2 ,3 ,6 приходим соответственно к понятиям свободной координаты qc (амплитуды колебаний ), свободной площади c, свободного объёма Vc, свободного шестимерного координатного пространства c6, выражающего стеснённость перегруппировок двух частиц, и т.д.. При этом
Sвз k*ln(/с) ... (3R/n)*ln(n/сn) (R/2)*ln/с6
R*ln(V/Vc) (3R/2)*ln(c) 3R*ln(q/qc). (5.8)
Получается ряд последовательных приближений к точной формуле Sвз = kln/с. Каждое последующее приближение выражает стеснённость всё более сложных движений. В первом приближении Sвз 3Rln(q /qс) вещество как бы представляется в виде совокупности 3N независимых осцилляторов с амплитудой колебаний, равной свободной координате qс. Свободный объём даёт третье приближение, пригодное в случае ячеечной модели, когда каждая из N независимых частиц помещена в постоянную потенциальную 3-мерную яму. Влияние одних частиц на колебание других, перегруппировки атомов и другие “колллективные” эффекты не описываются в рамках модели свободного объёма; для их описания необходимы более многомерные пространства c.
Из приведенных формул виден физический смысл энтропии взаимодействия: величина Sвз выражает плотность упаковки или степень стеснённости частиц силами взаимодействия. В результате действия сил связи интервал разрешённых движений в среднем по каждой координате сокращается в q/qс раз по сравнению с идеальным газом, в котором взаимодействие отсутствует. Фигуративная точка системы движется практически лишь по свободным или разрешённым 3N-мерным энергетическим “ямам” и “ложбинам”, доля которых в полном фазовом пространстве составляет с/.
Энергия и характер взаимодействия по различным связям могут сильно различаться, поэтому весьма различна и стеснённость по разным координатам. Для системы 3N осцилляторов энтропия взаимодействия характеризует среднее значение логарифма qс/q, для приближения свободного объема - среднюю величину Vc/V и др.
Величину свободной координаты или среднюю амплитуду колебаний можно определить различными физическими методами: спектроскопически, рентгенографически, по степени размытия линий рентгенограммы и др. Результаты термодинамических расчётов qc по энтропии взаимодействия удовлетворительно согласуются с данными физических определений.
Приведём расчёт Sвз из ширины потенциальной ямы Uвз=f(r). Около “дна”, при r rо, яму можно считать, как обычно, параболической, так что Uвз(r)-Uвзо = =Uвз*d(r - rо)2. Для потенциалов 6-12, 4-12 численный расчёт коэффициента d даёт соответственно d=0,30rо и 0,45rо; в случае более широкой ямы электростатического взаимодействия 1-12 получается d=0,7rо , в среднем 0,45rо; имеем (подробнее [7]):
Sвз = 3Rln(Uвзо/0,3*RT)1/2; Sвз = 1,5RlnUвз + const . (5.9)
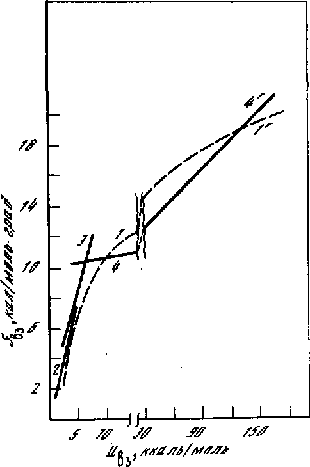
Рис. 5.3 Расчётная кривая (1,11, формула 5.9) для энтропии взаимодействия передаёт три линейные зависимости компенсационного эффекта соответственно для газов (2), жидкостей, включая растворы (3,31), и кристаллов 4 и 41 [180]
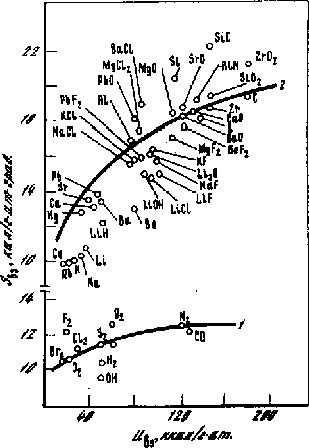
Рис. 5.4. Сопоставление расчётных кривых компенсационного эффекта для кристаллов (2) и двухатомных газовых молекул (1) с опытными данными (точки [180])
На рис. 5.3, 5.4 зависимость (5.9) сопоставлена с корреляциями Sвз - Uвз, полученными Е.С. Рудаковым [180]. Видно, что простая формула (5.9) качественно правильно передаёт зависимость энтропии взаимодействия от прочности связи Uвз в реальных газах, жидкостях, кристаллах, а также в случае внутримолекулярного взаимодействия в двухатомных газовых молекулах.
На рис. 5.5 представлен общий вид температурной зависимости свободной координаты, энтропии взаимодействия и Fвз от приведённой температуры T/= kT/h в соответствии с теорией теплоёмкости Дебая. При свободной координате qc плотность упаковки Y=Yо(1-qc/q)3, где Yo - плотность в плотнейшей упаковке, равная 0,754 для решеток ГЦК и ГПУ.
Здесь появляются две интересные характеристики вещества, рассчитываемые термодинамически: 1) Максимальное значение энтропии взаимодействия Sвзmax, (см. рис 5.5; 2)Предельное значение при T0 свободного фазового пространства или, упрощенно, свободного объема; предельное значение плотности упаковки атомов.
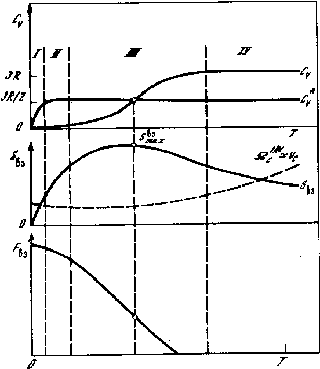
Рис. 5.5. Схема температурной зависимости свободного объёма, энтропии взаимодействия и потенциала Fвз
Через Sвз можно определить и интенсивность квантовых эффектов атомарной системы. Действительно, величина квантовых поправок к термодинамическим свойствам системы определяется величиной пространства, в котором стеснены или локализованы атомы. Квантовая неопределённость импульса p для атома, локализованного в пределах свободной координаты qc, равна, согласно соотношению неопределённостей, p= h/qc. Фермиевская энергия частиц, локализованных в пределах свободного объёма Vc: Uf = const/mVc2/3 и т.д.
В концепции свободного объёма Vс или свободного фазового пространства с полная энтропия реальной системы равна энтропии идеального газа, помещённого в объём Vс ( или в пространство с).
Квантовые поправки Aкв к свойствам вещества равны соответствующим поправкам к свойствам идеального газа в объёме Vс:
Aкв = A - Aкл = Aкв - Aкл ,
причем величина квантового свойства Aкв здесь берется по формулам идеального газа при Vид = Vс, то есть при Sид = S. Соответствующие формулы для величины квантовых поправок к свойствам идеального газа при заданном объеме Vид= Vс можно взять, например, в [182].
Полную энтропию можно считать мерой интенсивности квантовых эффектов, “мерою квантовости” системы. Если система приближается к “чисто квантовому” состоянию, kT/h 0 при Т 0 или Vс 0, то энтропия стремится к нулю, S 0. В теории теплоёмкостей Дебая квантовый параметр h/kT и квантовые поправки также являются однозначными функциями полной энтропии, как и в приведенной концепции свободного фазового пространства или, упрощенно, свободного объёма. Так, при величине энтропии S = 0,78R квантовый параметр составляет h/kT = 4,0; теплоёмкость Cv понижена по сравнению с классическим значением Cv = 3R наполовину, Cv = 3R - 3/2R = 3/2R; квантовая поправка к энергии: Uкв -1,7RT , к энтропии; Sкв~ -7,3R , к потенциалу; Fкв= 5,6RT . Примерно этому состоянию соответствует лёд в точке плавления.
В реальных многокомпонентных веществах (и особенно в молекулярных) жёсткость связи, масса атома, частоты и параметры h/kT по разным координатам могут сильно отличаться. Приведённое определение степени квантовости даёт в этом случае при повышенных температурах среднеарифметическое значение логарифма частоты, (ln)ср. В квантовой области закон усреднения более сложный.
Таким образом, интенсивность квантовых эффектов и величина квантовых поправок легко определяются через полную энтропию S, а параметры плотности упаковки атомов, такие как, свободный объём, свободная координата и др. - через энтропию взаимодействия Sвз. Эти способы оценок широко применялись ранее [7] и используются в следующей главе.
Зная плотность Y упаковки атомов (или c, а упрощенно-свободный объём системы), можно далее определить все кинетические коэффициенты, например, по формулам теории жестких сфер [77,78]; в итоге получается выражение кинетических свойств через энтропию взаимодействия [7]. Такие формулы удобны для оценок, так как кинетические свойства легко определяются по общедоступным термодинамическим данным; в области простой жидкости получается хорошее совпадение с экспериментом [7]. Cо вступлением в интервал затвердевания обсуждаемые формулы начинают давать более высокую подвижность частиц, чем в действительности, как и уравнения модели жестких сфер, коррелятивных функций, компьютерные эксперименты и др. Подвижность частиц в вязкой жидкости или в твердых телах ограничивается не плотностью упаковки частиц, но качественно иными эффектами, стабилизирующими структуру.
