
- •Глава 1. (введение). “кризис” кинетической теории. Необходимое изменение традиционной молекулярной модели. История и состояние вопроса
- •Глава 2. Компьютерное моделирование затвердевания. Отсутствие затвердевания в традиционной модели. Характер эффектов, стабилизирующих структуру
- •Глава 3. Квазикристаллические свойства жидкостей.
- •1.1.1. В традиционной модели нет затвердевания
- •1.1.3. Затвердевание как следствие нарастания атомарных квантовых эффектов
- •1.1.5. История вопроса об отсутствии затвердевания
- •1.1.6. Соотношение теории и опыта. Психологические аспекты
- •1.1.7. Общая физическая причина обсуждаемых дискуссий
- •1.1.8. Квазикристаллические свойства жидкости
- •1.2. Феноменологическое описание свойств жидкости и твердого тела, представление о их противоположности.
- •1.2.1. Прочность и дальний порядок
- •1.2.2. Формирование традиционной молекулярной модели жидкости и затвердевания
- •1.2.3. Успехи кинетической теории на основе традиционной модели
- •1.2.4. Современный вид традиционной модели
- •1.2.5. Аналитические оценки кинетических свойств
- •1.2.6.Выявление неадекватности модели. Анализ прочности на атомарном уровне
- •1.2.7.Структурный подход к плавлению
- •1.2.8. Энергии активации
- •1.2.9. Нарастание трудностей в истолковании фазовых переходов
- •1.2.10. Признаки застоя в молекулярной теории кинетических свойств
- •1.3. Заключение
- •1.3.1. Мировоззренческий характер традиционных взглядов. Влияние философии
- •Традиционная модель и философия
- •Традиционная модель и философия
- •Кризисы в разных областях исследования
- •1.3.2. О химической форме движения материи
- •1.3.3. Ориентировочные оценки и строгие методы. Математизация исследований
- •1.3.4.Математизация исследований. Вытеснение
- •1.3.5. Приближённые оценки
- •1.4. Заключение к главе 1
- •Глава 2. Компьютерное моделирование затвердевания. Характер эффектов, стабилизирующих структуру
- •2.1 Прямое моделирование процессов переноса. Отсутствие затвердевания в традиционной модели
- •2.1.1.Затвердевание как скачок кинетических свойств
- •2.1.2. Прямое компьютерное моделирование вязкого или пластического течения и ионного электропереноса
- •2.1.3. Течение в модели при температурах около абсолютного нуля
- •2.1.4. Релаксация механических напряжений. Деформация постоянной силой
- •2.2. Обсуждение результатов моделирования
- •2.2.1.Температурная зависимость кинетических свойств
- •2.2.2. Влияние вида парного потенциала
- •2.2.3. Молекулярный механизм пластической деформации или вязкого течения
- •2.2.4. Молекулярный механизм течения около абсолютного нуля
- •2.3. Кристаллизация. Устойчивость
- •2.3.1. Моделирование кристаллизации
- •2.3.2. Устойчивость решеток и сеток
- •2.3.3. Определение мягких мод в компьютерном эксперименте
- •2.4. Состояние вопроса об отсутствии затвердевания
- •2.4.1. Литературные данные
- •2.4.2. Расхождение традиционной модели с действительностью по дальнему порядку и размытости фазовых переходов
- •2.5. Затвердевание как переход в квантовую область. Подбор потенциала для стабилизирующих структуру эффектов
- •2.5.1. Затвердевание приходится на температуры перехода из классической области в квантовую
- •2.5.2. Подобие затвердевания и перехода к сверхтекучести
- •2.5.3. Диаграммы состояния других веществ в области около абсолютного нуля
- •2.5.4. Подбор поправки к потенциалу для выражения эффектов, стабилизирующих структуру
- •2.5.5. Влияние направленности и ковалентности связи
- •2.5.6. Другие свойства твердых тел, не объясняющиеся в рамках традиционной модели
- •2.6. Заключение к гЛаве 2. Состояние вопроса
- •Глава 3. Квазикристалличекие свойства жидкостей
- •3.1. Традиционная модель и квазикристаллические свойства. Состояние вопроса
- •3.1.1. Введение
- •3.2. Модуль сдвига и предел прочности жидкости
- •3.2.1. Экспериментальная часть
- •3.2.2. Обсуждение результатов. Состояние вопроса
- •3.2.3. Последействие
- •3.3. Особенности на политермах и структурные перестройки в жидкости
- •3.3.1. Превращение в жидком железе около 1640 oС
- •3.3.2. Превращения в силикатных расплавах
- •3.3.3. Политермы вязкости воды
- •3.3.4. Дифференциальные координаты
- •3.4. О дальнем порядке в жидкости
- •3.4.1. Экспериментальные данные
- •3.4.2. Огранка
- •3.4.3. Сопоставление с традиционным подходом. Состояние вопроса
- •3.5. Осцилляции
- •3. 6. Квазикристаллические свойства жидкости и генерация турбулентных пульсаций в гидродинамическом потоке. Состояние вопроса
- •3.6.1. Введение
- •3.6.2. История вопроса (по работам [12, 53, 133, 134])
- •3.6.3. Механизм генерации пульсаций в потоке при твердоподобном сопротивлении течению
- •3.6.4. Сопоставление с известными примерами генерации колебаний.
- •3.6.5. Концентрация течения в отдельных плоскостях
- •3.6.6. Образование вихрей
- •3.6.7. Объемная и поверхностная турбулизация
- •3.6.8. Резюме к параграфу 3.6
- •Глава 4. Зернистая, или блоковая, структура реальной жидкости
- •4.1. Блоки и размытость фазовых переходов
- •4.1.1. Температурный интервал размытия т переходов
- •4.1.2. Экспериментальные данные [28, 30]
- •4.1.3. Оценка величины "кванта превращения" при других переходах
- •4.1.4. Размытость "концентрационных фазовых переходов"
- •4.1.5. "Надмолекулярный" характер соединений в твердом теле
- •4.1.6. Устойчивость соединений. Выделение химического и структурного слагаемых в энергии взаимодействия
- •4.2. Неоднородность течения реальной жидкости. Зернистая структура и соотношение коэффициентов вязкости и диффузии
- •4.2.1. Неоднородность течения
- •4.2.2. Оценка размеров "блоков течения" в жидкости
- •4.3. Наследование зернистой структуры при плавлении и кристаллизации
- •4.3.1."Наследственность"
- •4.3.2. Потоковая обработка
- •4.3.3. Термовременная обработка жидкого металла (тво) [24, 25]
- •4.3.4. Зародышеобразование и кинетика кристаллизации
- •4.3.5. Микронеоднородность эвтектических расплавов
- •4.3.6. Влияние слабых полей. Ультразвуковая обработка
- •4.3.7. Жидкий кристалл
- •4.3.8. Зависимость свойств поликристалла от размера зерна. Сверхпластичность. Дисперсионное упрочнение
- •4.4.9. Микрокристаллитная и коллоидная модель стекла
- •4.3.10. Состояние вопроса
- •4.4. Заключение к главе 4
- •Глава 5. Структурные дальнодействия и поверхностные явления
- •5.1. Дальнодействия в пленках и коллоидах
- •5.1.1. Дальнодействия в модели
- •5.1.2. Опытные данные по пленкам
- •5.1.3. Вязкие коллоиды и гели
- •5.1.4. Обсуждение опытных данных. Состояние вопроса
- •5.2. Дальнодействия в твердом состоянии
- •5.2.1. Масштабный фактор прочности
- •5.2.3. Дисперсионное упрочнение
- •5.2.4. О морфологии включений, фаз эвтектики, растущих кристаллов
- •5.2.5. Эффект ребиндера
- •5.2.6. Ориентирующие взаимодействия кристаллов
- •5.3. Выделение вклада дальнодействий в поверхностном натяжении
- •5.3.1. Дальнодействия, толстые пленки и их вклад в поверхностное натяжение
- •5.3.2. Термодинамические функции взаимодействия
- •5.3.3. Энтропия взаимодействия и оценки плотности упаковки, степени квантовости
- •5.3.4. Модель разорванных связей
- •5. 3. 5. Электронные теории поверхностного натяжения
- •5. 3. 6. Уточнение формулы для поверхностного натяжения чистых жидкостей
- •5.3.7.Поверхностное натяжение растворов
- •5.3.8.Аномально высокая поверхностная активность
- •5.3.9. Межфазное натяжение
- •5.3.10.Выделение вклада структурных дальнодействий и толстых пленок в поверхностное натяжение. Граница кристалл-жидкость в однокомпонентной системе
- •5.3.11. Граница кристалл-газ. Межзеренные границы
- •5.3.12. Зависимость температуры кристаллизации от размера капельки
- •5.3.13. Решетка и огранка малых частиц
- •5.4. Спекание и смачивание. Роль структурных дальнодействий и толстых пленок
- •5.4.1. Кинетический акт в традиционной модели
- •5.4.2. Кинетический акт спекания и смачивания в предлагаемой модели. Трение
- •5.4.3. Опытные данные по скорости самого акта спекания (кинетического звена)
- •5.4.4. Кинетическое сопротивление растеканию
- •5.4.5. Транспортное сопротивление спеканию и смачиванию.
- •5.5. Поверхностные свойства и дальнодействующие структурные
- •Глава 6. Корреляция параметров затвердевания и стабильности структуры с приведенной температурой и с мерой квантовости.
- •6.2.Превращения в начале и конце интервала затвердевания.
- •6.2.1. Начало интервала затвердевания или переход от состояния простой жидкости к состоянию реальной (затвердевающей) жидкости.
- •6.2.2. Конец интервала затвердевания.
- •6.2.3. "Точка стеклования" кристаллических веществ.
- •6.3.Общая сxема изменения кинетических свойств.
- •6.3.1. Общая схема изменения кинетических свойств при стекловании и кристаллизации.
- •6.3.2. Общий вид и истолкование политерм вязкости. Состояние вопроса.
- •6.3.3. Описание затвердевания в терминах вязкости и прочности. O качественном различии жидкости и твердого тела.
- •6.3.4. Тепловой эффект, сопровождающий повышение вязкости.
- •6.3.5. Химические классы жидкостей и стадии затвердевания.
- •6.4. Влияние атомарных квантовых эффектов.
- •6.4.1. Затвердевание и “степень квантовости”.
- •6. 4. 2. Влияние квантового параметра на tемпературу плавления.
- •6.5. Аналогичные закономерности для скорости химических реакций.
- •6.5.1. Подобие закономерностей для стабильности межмолекулярной и внутримолекулярной структуры. Постановка вопроса.
- •6.5.2. Зависимость стабильности внутримолекулярной структуры и “степени молекулярности” от квантового параметра.
- •6.5.3. Переходы от молекулярной формы к атомарной. Стёкла как промежуточные состояния.
- •6.5.4.Размягчение внутримолекулярной структуры при нагреве. Температурная зависимость энергий активации химических реакций.
- •6.5.5.Другие закономерности. Усреднение степени молекулярности компонентов раствора и катализ.
- •6.5.6. Перераспределение суммарной стабильности между внутри- и межмолекулярной структурой.
- •6.5.7. Перераспределение жесткости структуры и термодинамические характеристики плавления молекулярных веществ.
- •6.5.8.Простая атомарная многокомпонентная жидкость.
- •6.6. Заключение. Состояние вопроса.
- •6.6.1. Основные результаты.
- •7. Резюме.
- •Часть 2. - м.: Металлургиздат, 1966, 720 с.
4.1.6. Устойчивость соединений. Выделение химического и структурного слагаемых в энергии взаимодействия
Мерою устойчивости механической системы ( в простейшем случае - частицы в потенциальной яме) является, как известно, величина d2U/dX2 (кривизна потенциальной ямы); аналогично можно определить и устойчивость структуры твердого тела, молекулы или кристалла, причём часто наиболее интересны минимальные значения d2U/dX2, характеризующие лёгкие перегруппировки - минимальные частоты min, или мягкие моды.
Мерою устойчивости структуры к изменениям концентрации N также можно считать величину второй производной d2U/dN2, точнее - d2 F/dN2; F - изменение потенциала F при образовании раствора. Если кривизна d2F/dN2 всюду положительна, то растворимость неограниченная. Если на политерме F - N имеется участок отрицательных значений второй производной, то около его появляется область нерастворимости (расслоения), см. рис. 4.3. Чем больше кривизна d2F/dN2 или чем выше устойчивость, тем меньше растворимость (см. рис. 4.3).
Наиболее устойчивые соединения обычно имеют минимальные области нестехиометричности (растворимости). Если растворимость компонента В в растворителе А равна N, то для процесса растворения В в А можно записать: U Fo RTlnN. Это уравнение позволяет оценить энергию взаимодействия компонента В, растворённого в А, на границе растворимости (в насыщенном растворе). На рис. 4.4. представлена характерная кривая зависимости энергии взаимодействия от состава, полученная с помощью таких оценок. Кривая относится к системе с четырьмя соединениями. Видно, что энергия взаимодействия Uвз естественно распадается на два слагаемых, качественно различных:
Энергия обычных взаимодействий, плавно зависящая от состава по кривой с максимумом примерно посередине диаграммы; эта изотерма подобна характерным изотермам квазихимических растворов и опытным изотермам в области простой жидкости ( сплошная кривая).
Энергия Uст стабилизирующих структуру эффектов, которая изменяется по сложной кривой с острыми максимумами; каждый максимум соответствует соединению (верхняя кривая).
Кривизна d2U/dN2 по второму слагаемому (по стабилизирующим эффектам) многократно превосходит соответствующую величину по обычным химическим связям. Устойчивость соединений d2U/dN2 и растворимость определяются практически одними лишь стабилизирующими структуру эффектами. Если бы не было второго (стабилизирующего) слагаемого , то политермы Uвз - N были бы плавными и получилась бы неограниченная растворимость.
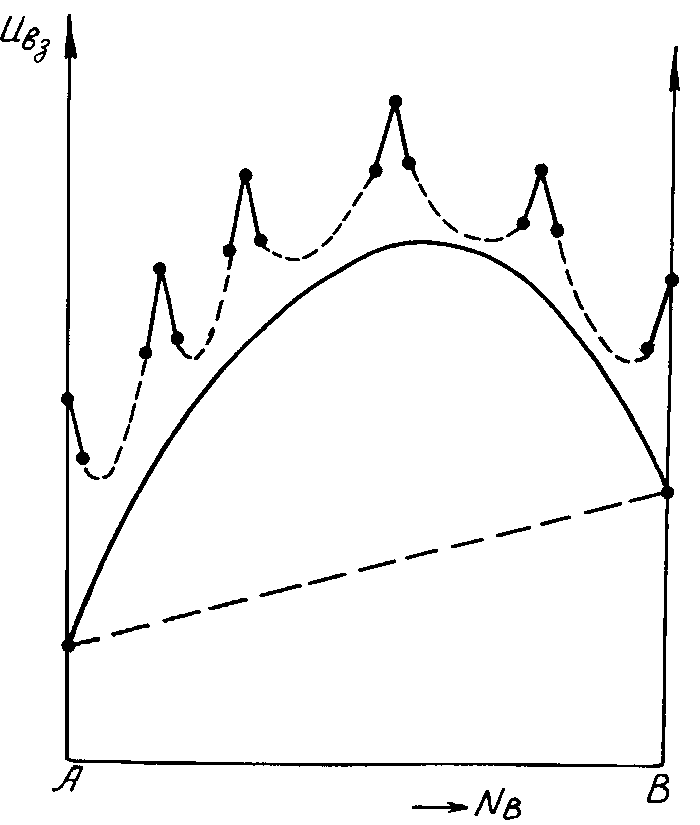
Рис. 4.4. Политерма энергии Uвз двойной системы. Энергия распадается на обычное медленно изменяющееся квазихимическое слагаемое Uх и структурное Uст с резкими максимумами
Этот случай и реализуется при переходе к состоянию простой жидкости, в которой второе слагаемое исчезает, Uст = 0. Первое слагаемое обычных связей мало изменяется при переходе от твердого тела к простой жидкости.
Следует отметить, что реальная политерма Uвз- N ещё намного сложнее, чем на рис. 4.4, и, соответственно, ещё дальше от простой плавной политермы типа квазихимической, которая получается в традиционной модели. Действительно, новые методы эксперимента убеждают, что мы знаем далеко не все соединения. В последнее время число известных соединений и структур быстро возрастает, в частности, в связи с применением новых методов быстрого переохлаждения и стеклования расплавов, получения аморфных металлов. Так получены качественно новые структуры - квазикристаллы, имеющие дальний порядок без периодической структуры [142]. Выявляется много новых стабильных и метастабильных соединений. Это означает, что на политермах (см. рис. 4.4) стабильных соединений и соответствующих максимумов Uвз, по-видимому, значительно больше, чем мы знаем в настоящее время. Далее, между высокими максимумами стабильных соединений имеется ещё много более низких максимумов, соответствующих метастабильным соединениям. Кроме того, изотермы энергии, вязкости, прочности и других свойств и в области растворов не сводятся к монотонным кривым; они содержат много особенностей, в частности, осцилляций. При этом прослеживается подобие таких особенностей у кристалла и у жидкости [143]. Нет надежды получить что-либо подобное этой сложной реальной картине в рамках традиционной модели, которая даёт лишь плавные изотермы (см. рис. 4.3).
Таким образом, вид изотерм энергии в бинарных системах и их изменение с температурой также свидетельствует о наличии качественно иного эффекта по сравнению с тем, что дает традиционная модель; видимо, это структурные стабилизирующие взаимодействия Uст.
4.1.7. "ОДНОНАПРАВЛЕННЫЕ" ВЛИЯНИЯ ПРИМЕСЕЙ
Как известно, в квантовой области результат взаимодействия двух частиц зависит от того, можно ли их считать идентичными, или же их следует рассматривать как различные. Если стабилизирующие структуру силы Fст обусловлены квантовыми эффектами в атомарной системе, то влияние добавки на структурно-чувствительные свойства также должно зависеть не только от ее химических характеристик, но и от того, можно ли считать атомы добавки практически идентичными атомам матрицы, или же принципиально отличными от них. В этом случае все инородные добавки, независимо от их химических свойств, могут давать изменения свойств одного знака. Действительно, в твердом состоянии наблюдаются подобные "однонаправленные" влияния.
Хорошо известно, что добавление к чистому кристаллическому веществу примеси любого другого инородного вещества приводит к повышению прочности и хрупкости; неизвестны факты обратного влияния, то есть понижения хрупкости при любых химических свойствах добавки. У металлов, кроме того, инородные добавки, видимо, всегда повышают электросопротивление. Инородная добавка почти всегда понижает также температуру плавления исходного чистого вещества; двухкомпонентные системы более легкоплавки по сравнению с чистыми веществами, состоящими из идентичных атомов. Имеются также системы, в которых перечисленные эффекты малозаметны, а атомы добавки "ведут себя" практически как атомы матрицы. Такие системы имеют"сигарообразные" диараммы плавкости и неограниченную растворимость в твердом состоянии. Очевидно, такие влияния связаны со стабильностью структуры, это "Fст- эффекты". В системах с нулевой жесткостью структуры (Е= 0), то есть у простых жидкостей и плотных газов, насколько нам известно, не встречаются такие "однонаправленные" влияния любых инородных примесей. Tемпературы кипения и критической точки, вязкость бинарной системы и др. обычно повышаются примесями, если их молекулы (атомы) вносят в систему более прочные взаимодействия, и понижаются при внесении более слабых связей. Легкоплавкость бинарных систем по сравнению с чистыми веществами связана с тем фактом, что твердые растворы относительно менее выгодны энергетически; растворимость в твердом состоянии обычно ниже, чем в жидком. Малая растворимость означает, что бинарная система в твердом состоянии имеет повышенный термодинамический потенциал F. Если растворимость двух компонентов незначительна, то моль их примерно эквиатомной эвтектической смеси имеет потенциал F, повышенный на F RTln2 по сравнению со случаем образования их идеального раствора. Такое повышение F твердого состояния приведет к понижению температуры плавления на
Тпл F/Sпл RTплln2/Sпл Tплln2 0,69Тпл ,
если Sпл R в соответствии с правилом Гильдебранда. Температура плавления такой эвтектики будет понижена на Tпл 0,69Тпл, то есть более чем наполовину. Если предположить обратный случай, когда в твёрдом состоянии растворимость неограниченная, а в жидком - небольшая, то обычный термодинамический анализ такой гипотетической системы привёл бы к "перевёрнутой" эвтектической диаграмме, в которой эвтектика была бы самым тугоплавким составом, (рис.4.5). Легкоплавкость реальных двухкомпонентных систем, в частности, эвтектик, отражает понижение стабильности твердого вещества при добавлении почти любых инородных атомов. В кристаллическом состоянии более стабильны решётки из одинаковых атомов - чистые вещества. Приведенные температуры плавления (Tпл/Uвз) у них максимальны.
Обсуждаемый эффект незначителен у систем с сигарообразной диаграммой плавления. Характерно, что такие двойные системы с неограниченной растворимостью в твердом состоянии, на которых малозаметно обсуждаемое влияние идентичности атомов, не встречаются у легких элементов, то есть у атомов с наибольшей величиной квантовых эффектов. Нам не удалось найти непереходный элемент легче германия (атомный вес - 72,6), который давал бы неограниченную растворимость в твердом состоянии с каким-то более легким компонентом. Германий дает такую диаграмму с кремнием.
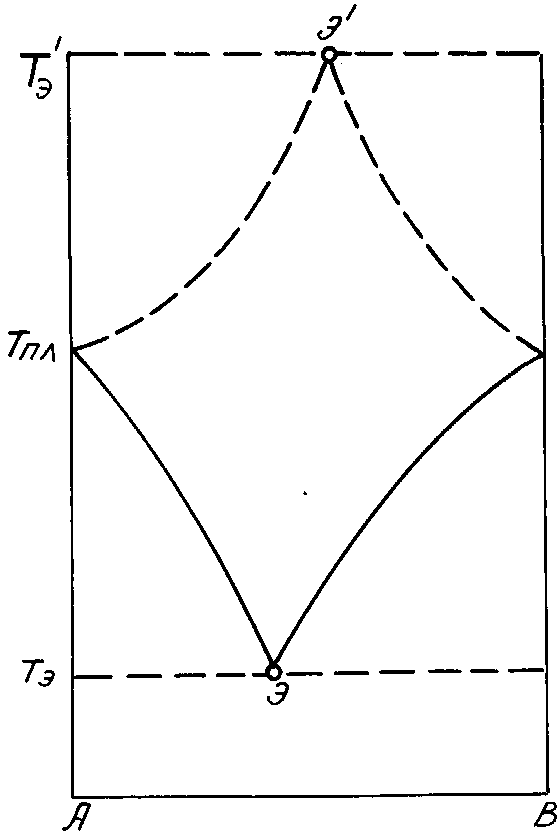
Рис. 4.5. Перевернутая эвтектическая диаграмма
При традиционном анализе удивительные "однонаправленные" влияния примесей часто остаются незамеченными, а закономерности растворимости связывают, естественно, с химическими свойствами - с энергией взаимодействия, характером связи, размером внедряемых атомов и др. [144]. Тем более показателен тот факт, что установлены эмпирические правила, связывающие растворимость с соотношением атомных весов компонентов [144], хотя атомный вес, по традиционным представлениям, не должен влиять на растворимость.
Так как растворы обычно менее склонны к затвердеванию по сравнению с чистыми жидкостями, то на их основе легче, очевидно, получить и незамерзающие квантовые жидкости. В многокомпонентной системе легких элементов H - H2 - D - D2- 3He - 4He - Li ... имеется, вероятно, широкая область незамерзающих растворов (стабильных и нестабильных), в том числе и без участия или почти без участия изотопов гелия.
Отметим,что обычно не только твёрдые растворы и смеси, но и твёрдые соединения относительно менее стабильны и более легкоплавки по сравнению с чистыми веществами. Так, оксид алюминия плавится при 2050 oС, оксид кальция - при 2570 oС, а их соединение Ca24Al14O45 при 1455 oС, хотя прочность связи в нём больше; оно образуется с тепловым эффектом около 200 кДж/моль [30]. Приведённая температура плавления соединения Tпл/Uвз в данном случае примерно вдвое ниже, чем у образующих его чистых окислов. Если в этой системе CaO - Al2O3 соединить кривой точки плавления соединений, то получатся линии, подобные линиям ликвидуса в простой эвтектической диаграмме, (см. рис 4.5). Образование соединений здесь дает лишь малые поправки к общему виду диаграммы.
Отметим также, что при традиционном подходе трудно дать ясное определение широко применяемому термину "структурно-чувствительные свойства".
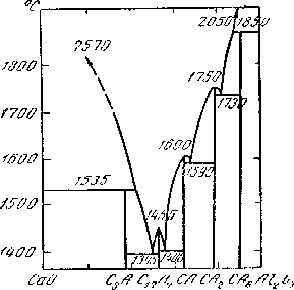
Рис. 4.6. Диаграмма плавкости системы CaO-Al2O3
С точки зрения предлагаемой модели структурно-чувствительными являются свойства, обусловленные стабилизирующими структуру эффектами, энергией Uст, и связанные с жесткостью структуры; это "Fст- свойства". Таковы энергии активации Е, повышенная вязкость или прочность, зависящая от характера зернистой структуры поликристалла, то есть от "надмолекулярной структуры", от Fст-структуры. Часто малочувствительны к структуре, например, объём или энергия взаимодействия жидкости, которая даже в твёрдом состоянии часто на 95% и более определяется обычными взаимодействиями (Uст Hпл< 0.05Uвз).
В материаловедении структурно-чувствительными называют свойства, которые определяются дефектностью кристалла - концентрацией дислокаций, вакансий, дислоцированных атомов, межблоковых и межзеренных границ и др. С позиций предлагаемой модели это также "Fст - свойства".
4.1.8. ИСТОРИЯ ВОПРОСА О РАЗМЫТОСТИ ПЕРЕХОДОВ. СОПОСТАВЛЕНИЕ С ТРАДИЦИОННЫМ ПОДХОДОМ
Изучение структурных фазовых переходов началось сравнительно поздно, практически лишь после появления лабораторных электропечей и термопар в конце прошлого века [28]. До этого высокие температуры определяли лишь на глаз, по цветам каления. В начале века, после работ Ван-дер-Ваальса, Кюри-Вейсса, классификации Эренфеста ситуация представлялась достаточно ясной [1,18]. Как и в других вопросах, исходным было априорное убеждение, что основные явления объясняются или объяснятся и будут описаны на основе традиционной молекулярной модели, на основе представления об упругих притягивающихся и отталкивающихся классических атомах. Эксперимент показал, что плавление и полиморфные превращения являются точечными; поэтому было принято, что в традиционной модели такие превращения также являются точечными.
Встречается мнение, что точечный характер плавления в модели доказан; иногда считают, что этого требует уже правило фаз. Известен также следующий аргумент: переходы должны идти скачком, так как симметрия может появиться или измениться лишь скачкообразно [28].
Однако со временем нарастали трудности теории [28]. Более тщательные измерения выявляли размытость все новых превращений, считавшихся ранее точечными. Сначала такую размытость объясняли "случайными" причинами, например, влиянием примесей, дефектностью решетки, гетерогенными флюктуациями и др. Но в настоящее время под давлением опытных данных распространяется убеждение, что чисто точечных переходов вообще нет в природе, есть лишь переходы, интервал T размытия которых мал (например, меньше 0,1 К) и неудобен или пока недоступен для измерения. "Почти общепризнано, что проблема фазовых переходов относится к числу сложнейших, далеких от разрешения проблем физики" [28] и др.
Теперь становится ясно, что традиционная модель недостаточна в этих вопросах; при обычных взаимодействиях атомов и классическом движении "кристаллические" свойства, отличающие кристалл от жидкости, включая точечные фазовые переходы, не появляются в этой модели и в области твердого состояния. Плавление и другие переходы в традиционной модели отнюдь не точечные, но очень размытые (Тпл Tпл (100-1000) К. Задача теории, следовательно, скорее обратная: требуется объяснить не тот факт, что небольшое размытие существует, Тпл 0,1 К вместо Тпл = 0; в действительности требуется объяснить, почему реальное размытие столь мало, 0.1 К, вместо величины (100-1000) К, которую мы получили бы при последовательном анализе традиционной модели.
Простейший, казалось бы, исходный вопрос: почему реакции размыты, а плавление точечное ? - не мог быть решён и, cоответственно, не ставился при традиционном подходе. Следует признать, что решетки и сетки реальных твердых тел скреплены качественно иными эффектами, весьма дальнодействующими, способными сцепить атомы в блоки, например, по 105 частиц и обеспечить их переход блоками, что приводит к реальному интервалу размытия, в 105 раз меньшему по сравнению с химической реакцией. Простейший, казалось бы, исходный вопрос: почему реакции размыты, а плавление точечное ? - не мог быть решён и, соответственно, не ставился при традиционном подходе. Следует признать, что решетки и сетки реальных твердых тел скреплены качественно иными эффектами, весьма дальнодействующими, способными сцепить атомы в блоки, например, по 105 частиц и обеспечить их переход блоками, что приводит к реальному интервалу размытия, в 105 раз меньшему по сравнению с химической реакцией. Простейший, казалось бы, исходный вопрос: почему реакции размыты, а плавление точечное ? - не мог быть решён и, соответственно, не ставился при традиционном подходе. Следует признать, что решетки и сетки реальных твердых тел скреплены качественно иными эффектами, весьма дальнодействующими, способными сцепить атомы в блоки, например, по 105 частиц и обеспечить их переход блоками, что приводит к реальному интервалу размытия, в 105 раз меньшему по сравнению с химической реакцией.
Независимо, но подобным же образом развивались и представления о молекулярном механизме "размытости концентрационных фазовых переходов". Считалось, что из традиционной модели можно получить наблюдаемые соединения постоянного состава в твердом теле; выявленные позднее области нестехиометричности объясняли дефектностью структуры.
Особенности соединений в твёрдом состоянии, их непохожесть на молекулярные соединения в газах и жидкостях неоднократно вызывали дискуссии крупнейших физикохимиков в прошлом [138,18]. В ХV111 и Х1Х веках преобладало мнение, что твёрдые соединения являются химическими индивидами, и для них справедливо положение Дальтона о постоянстве химического состава. Следовательно, "концентрационные фазовые переходы", как и температурные, считались точечными, а их интервал размытия, или область нестехиометричности N - нулевой. Понятие "раствор" долго относили лишь к жидкостям; понятие "твёрдый раствор" ввёл Вант-Гофф лишь в 1890 г. Правда, Бертолле развивал представление о соединениях переменного состава, однако считалось, что Пруст опроверг эти представления в известной дискуссии прямыми данными химического анализа, в частности, для карбоната меди. Менделеев считал соединения переменного состава настоящими соединениями, но частично диссоциированными. Курнаков Н.С., исследуя зависимость твёрдости, электропроводности, температуры плавления от состава, постулировал существование соединений как постоянного, так и переменного состава, как "дальтонидов", так и "бертоллидов".
С накоплением опытных данных об областях нестехиометричности главной задачей стало объяснение таких небольших интервалов размытости этих переходов. "Лишние" или недостающие атомы по отношению к стехиометрическому составу обычно рассматривали как дефекты структуры, как атомы, дислоцированные в междоузлия, или вакансии.
Но в действительности последовательный анализ в рамках традиционного подхода даёт лишь то, что наблюдается в состоянии простой жидкости, то есть лишь растворы, но не соединения. Удивительны и подлежат объяснению не отклонения от постоянного состава соединений, а само существование соединений, невозможных в традиционной модели. Предположение о том, что реакция образования соединений идет блоками, например, по 105 частиц, позволяет объяснить - почему размытость перехода или ширина области нестехиометричности в действительности в 105 раз меньше, чем в модели.
