
- •Глава 1. (введение). “кризис” кинетической теории. Необходимое изменение традиционной молекулярной модели. История и состояние вопроса
- •Глава 2. Компьютерное моделирование затвердевания. Отсутствие затвердевания в традиционной модели. Характер эффектов, стабилизирующих структуру
- •Глава 3. Квазикристаллические свойства жидкостей.
- •1.1.1. В традиционной модели нет затвердевания
- •1.1.3. Затвердевание как следствие нарастания атомарных квантовых эффектов
- •1.1.5. История вопроса об отсутствии затвердевания
- •1.1.6. Соотношение теории и опыта. Психологические аспекты
- •1.1.7. Общая физическая причина обсуждаемых дискуссий
- •1.1.8. Квазикристаллические свойства жидкости
- •1.2. Феноменологическое описание свойств жидкости и твердого тела, представление о их противоположности.
- •1.2.1. Прочность и дальний порядок
- •1.2.2. Формирование традиционной молекулярной модели жидкости и затвердевания
- •1.2.3. Успехи кинетической теории на основе традиционной модели
- •1.2.4. Современный вид традиционной модели
- •1.2.5. Аналитические оценки кинетических свойств
- •1.2.6.Выявление неадекватности модели. Анализ прочности на атомарном уровне
- •1.2.7.Структурный подход к плавлению
- •1.2.8. Энергии активации
- •1.2.9. Нарастание трудностей в истолковании фазовых переходов
- •1.2.10. Признаки застоя в молекулярной теории кинетических свойств
- •1.3. Заключение
- •1.3.1. Мировоззренческий характер традиционных взглядов. Влияние философии
- •Традиционная модель и философия
- •Традиционная модель и философия
- •Кризисы в разных областях исследования
- •1.3.2. О химической форме движения материи
- •1.3.3. Ориентировочные оценки и строгие методы. Математизация исследований
- •1.3.4.Математизация исследований. Вытеснение
- •1.3.5. Приближённые оценки
- •1.4. Заключение к главе 1
- •Глава 2. Компьютерное моделирование затвердевания. Характер эффектов, стабилизирующих структуру
- •2.1 Прямое моделирование процессов переноса. Отсутствие затвердевания в традиционной модели
- •2.1.1.Затвердевание как скачок кинетических свойств
- •2.1.2. Прямое компьютерное моделирование вязкого или пластического течения и ионного электропереноса
- •2.1.3. Течение в модели при температурах около абсолютного нуля
- •2.1.4. Релаксация механических напряжений. Деформация постоянной силой
- •2.2. Обсуждение результатов моделирования
- •2.2.1.Температурная зависимость кинетических свойств
- •2.2.2. Влияние вида парного потенциала
- •2.2.3. Молекулярный механизм пластической деформации или вязкого течения
- •2.2.4. Молекулярный механизм течения около абсолютного нуля
- •2.3. Кристаллизация. Устойчивость
- •2.3.1. Моделирование кристаллизации
- •2.3.2. Устойчивость решеток и сеток
- •2.3.3. Определение мягких мод в компьютерном эксперименте
- •2.4. Состояние вопроса об отсутствии затвердевания
- •2.4.1. Литературные данные
- •2.4.2. Расхождение традиционной модели с действительностью по дальнему порядку и размытости фазовых переходов
- •2.5. Затвердевание как переход в квантовую область. Подбор потенциала для стабилизирующих структуру эффектов
- •2.5.1. Затвердевание приходится на температуры перехода из классической области в квантовую
- •2.5.2. Подобие затвердевания и перехода к сверхтекучести
- •2.5.3. Диаграммы состояния других веществ в области около абсолютного нуля
- •2.5.4. Подбор поправки к потенциалу для выражения эффектов, стабилизирующих структуру
- •2.5.5. Влияние направленности и ковалентности связи
- •2.5.6. Другие свойства твердых тел, не объясняющиеся в рамках традиционной модели
- •2.6. Заключение к гЛаве 2. Состояние вопроса
- •Глава 3. Квазикристалличекие свойства жидкостей
- •3.1. Традиционная модель и квазикристаллические свойства. Состояние вопроса
- •3.1.1. Введение
- •3.2. Модуль сдвига и предел прочности жидкости
- •3.2.1. Экспериментальная часть
- •3.2.2. Обсуждение результатов. Состояние вопроса
- •3.2.3. Последействие
- •3.3. Особенности на политермах и структурные перестройки в жидкости
- •3.3.1. Превращение в жидком железе около 1640 oС
- •3.3.2. Превращения в силикатных расплавах
- •3.3.3. Политермы вязкости воды
- •3.3.4. Дифференциальные координаты
- •3.4. О дальнем порядке в жидкости
- •3.4.1. Экспериментальные данные
- •3.4.2. Огранка
- •3.4.3. Сопоставление с традиционным подходом. Состояние вопроса
- •3.5. Осцилляции
- •3. 6. Квазикристаллические свойства жидкости и генерация турбулентных пульсаций в гидродинамическом потоке. Состояние вопроса
- •3.6.1. Введение
- •3.6.2. История вопроса (по работам [12, 53, 133, 134])
- •3.6.3. Механизм генерации пульсаций в потоке при твердоподобном сопротивлении течению
- •3.6.4. Сопоставление с известными примерами генерации колебаний.
- •3.6.5. Концентрация течения в отдельных плоскостях
- •3.6.6. Образование вихрей
- •3.6.7. Объемная и поверхностная турбулизация
- •3.6.8. Резюме к параграфу 3.6
- •Глава 4. Зернистая, или блоковая, структура реальной жидкости
- •4.1. Блоки и размытость фазовых переходов
- •4.1.1. Температурный интервал размытия т переходов
- •4.1.2. Экспериментальные данные [28, 30]
- •4.1.3. Оценка величины "кванта превращения" при других переходах
- •4.1.4. Размытость "концентрационных фазовых переходов"
- •4.1.5. "Надмолекулярный" характер соединений в твердом теле
- •4.1.6. Устойчивость соединений. Выделение химического и структурного слагаемых в энергии взаимодействия
- •4.2. Неоднородность течения реальной жидкости. Зернистая структура и соотношение коэффициентов вязкости и диффузии
- •4.2.1. Неоднородность течения
- •4.2.2. Оценка размеров "блоков течения" в жидкости
- •4.3. Наследование зернистой структуры при плавлении и кристаллизации
- •4.3.1."Наследственность"
- •4.3.2. Потоковая обработка
- •4.3.3. Термовременная обработка жидкого металла (тво) [24, 25]
- •4.3.4. Зародышеобразование и кинетика кристаллизации
- •4.3.5. Микронеоднородность эвтектических расплавов
- •4.3.6. Влияние слабых полей. Ультразвуковая обработка
- •4.3.7. Жидкий кристалл
- •4.3.8. Зависимость свойств поликристалла от размера зерна. Сверхпластичность. Дисперсионное упрочнение
- •4.4.9. Микрокристаллитная и коллоидная модель стекла
- •4.3.10. Состояние вопроса
- •4.4. Заключение к главе 4
- •Глава 5. Структурные дальнодействия и поверхностные явления
- •5.1. Дальнодействия в пленках и коллоидах
- •5.1.1. Дальнодействия в модели
- •5.1.2. Опытные данные по пленкам
- •5.1.3. Вязкие коллоиды и гели
- •5.1.4. Обсуждение опытных данных. Состояние вопроса
- •5.2. Дальнодействия в твердом состоянии
- •5.2.1. Масштабный фактор прочности
- •5.2.3. Дисперсионное упрочнение
- •5.2.4. О морфологии включений, фаз эвтектики, растущих кристаллов
- •5.2.5. Эффект ребиндера
- •5.2.6. Ориентирующие взаимодействия кристаллов
- •5.3. Выделение вклада дальнодействий в поверхностном натяжении
- •5.3.1. Дальнодействия, толстые пленки и их вклад в поверхностное натяжение
- •5.3.2. Термодинамические функции взаимодействия
- •5.3.3. Энтропия взаимодействия и оценки плотности упаковки, степени квантовости
- •5.3.4. Модель разорванных связей
- •5. 3. 5. Электронные теории поверхностного натяжения
- •5. 3. 6. Уточнение формулы для поверхностного натяжения чистых жидкостей
- •5.3.7.Поверхностное натяжение растворов
- •5.3.8.Аномально высокая поверхностная активность
- •5.3.9. Межфазное натяжение
- •5.3.10.Выделение вклада структурных дальнодействий и толстых пленок в поверхностное натяжение. Граница кристалл-жидкость в однокомпонентной системе
- •5.3.11. Граница кристалл-газ. Межзеренные границы
- •5.3.12. Зависимость температуры кристаллизации от размера капельки
- •5.3.13. Решетка и огранка малых частиц
- •5.4. Спекание и смачивание. Роль структурных дальнодействий и толстых пленок
- •5.4.1. Кинетический акт в традиционной модели
- •5.4.2. Кинетический акт спекания и смачивания в предлагаемой модели. Трение
- •5.4.3. Опытные данные по скорости самого акта спекания (кинетического звена)
- •5.4.4. Кинетическое сопротивление растеканию
- •5.4.5. Транспортное сопротивление спеканию и смачиванию.
- •5.5. Поверхностные свойства и дальнодействующие структурные
- •Глава 6. Корреляция параметров затвердевания и стабильности структуры с приведенной температурой и с мерой квантовости.
- •6.2.Превращения в начале и конце интервала затвердевания.
- •6.2.1. Начало интервала затвердевания или переход от состояния простой жидкости к состоянию реальной (затвердевающей) жидкости.
- •6.2.2. Конец интервала затвердевания.
- •6.2.3. "Точка стеклования" кристаллических веществ.
- •6.3.Общая сxема изменения кинетических свойств.
- •6.3.1. Общая схема изменения кинетических свойств при стекловании и кристаллизации.
- •6.3.2. Общий вид и истолкование политерм вязкости. Состояние вопроса.
- •6.3.3. Описание затвердевания в терминах вязкости и прочности. O качественном различии жидкости и твердого тела.
- •6.3.4. Тепловой эффект, сопровождающий повышение вязкости.
- •6.3.5. Химические классы жидкостей и стадии затвердевания.
- •6.4. Влияние атомарных квантовых эффектов.
- •6.4.1. Затвердевание и “степень квантовости”.
- •6. 4. 2. Влияние квантового параметра на tемпературу плавления.
- •6.5. Аналогичные закономерности для скорости химических реакций.
- •6.5.1. Подобие закономерностей для стабильности межмолекулярной и внутримолекулярной структуры. Постановка вопроса.
- •6.5.2. Зависимость стабильности внутримолекулярной структуры и “степени молекулярности” от квантового параметра.
- •6.5.3. Переходы от молекулярной формы к атомарной. Стёкла как промежуточные состояния.
- •6.5.4.Размягчение внутримолекулярной структуры при нагреве. Температурная зависимость энергий активации химических реакций.
- •6.5.5.Другие закономерности. Усреднение степени молекулярности компонентов раствора и катализ.
- •6.5.6. Перераспределение суммарной стабильности между внутри- и межмолекулярной структурой.
- •6.5.7. Перераспределение жесткости структуры и термодинамические характеристики плавления молекулярных веществ.
- •6.5.8.Простая атомарная многокомпонентная жидкость.
- •6.6. Заключение. Состояние вопроса.
- •6.6.1. Основные результаты.
- •7. Резюме.
- •Часть 2. - м.: Металлургиздат, 1966, 720 с.
6.5.2. Зависимость стабильности внутримолекулярной структуры и “степени молекулярности” от квантового параметра.
Согласно традиционным представлениям, энергия активации Ех необходима для разрыва или ослабления старых связей, исчезающих в элементарном акте реакции; величина Ех определяется прочностью и характером связей, зависящих от строения электронных оболочек атомов; величины Ех должны быть примерно одинаковы у химически подобных веществ с одинаковыми связями.
Согласно предлагаемой модели, стабильность структуры молекул и Ех, как и жесткость структуры твердого или затвердевающего вещества, определяются степенью квантовости вещества, то есть параметрами h/kT, S, Aср. При одних лишь обычных парных взаимодействиях и классическом движении частиц перегруппировки были бы безактивационными, Ех 0, структура была бы нестабильной.
Приведенные выше корреляции показали, что квантовые эффекты способствуют образованию стабильной структуры жидкости или твёрдого тела; при больших значениях h/kT кристаллизация при охлаждении наступает раньше, при более высоких приведённых температурах. Лишь при высоких значениях h/kT и лишь на основе десяти лёгких элементов с интенсивными квантовыми эффектами получается медленное нарастание вязкости в интервале затвердевания, с малым коэффициентом n = (1-1.5) зависимости Е ~ T-n и, соответственно, образуются легко стеклующиеся системы. Цель данного раздела - рассмотреть подобные корреляции для стабильности внутримолекулярной структуры.
Обычно различают лишь чисто атомарные и чисто молекулярные жидкости, не рассматривая промежуточные формы; нет количественной характеристики “степени молекулярности” жидкости. Между тем, варьируя температуру и концентрации, нередко можно непрерывно перейти от “чисто атомарной” жидкости к “чисто молекулярной” через все промежуточные состояния. Количественной характеристикой степени молекулярности жидкости может служить величина = Ue/Ui, которая показывает, во сколько раз энергия взаимодействия по связям внутри молекул Ue (или комплексов, группировок) больше энергии взаимодействия Ui таких же атомов, но принадлежащих к разным молекулам. В простой атомарной жидкости, например, в перегретом жидком металле все связи равноценны, =1. Так, в сплавах Fe-Si длительное время предполагалось существование молекул FeSi, так как при этом составе выявляются особенности изотерм. К настоящему времени достаточно ясно, что “соединения” типа FeSi в жидком металле - это не молекулы, а “мотив структуры”, то есть "Fст-соединения". Дифракционные исследования убеждают, что в расплаве нет выделенных связей Fe-Si c уменьшенным расстоянием между ядрами и, соответственно, с повышенной энергией взаимодействия; все связи равноценны. В простой атомарной жидкости безактивационны все перегруппировки атомов; Ех = 0, и для таких перегруппировок, которые в молекулярной жидкости соответствуют химической реакции.
Другим предельным случаем - “наиболее молекулярной жидкостью” можно считать вещества, подобные жидкому водороду, у которого внутримолекулярное взаимодействие каждого атома H со своим партнёром в молекуле имеет примерно в 2000 раз большую энергию, чем взаимодействия с каждым из атомов в соседних молекулах: = Ue/Ui ~ 2000. Для практических расчётов удобнее величина = Hат/Hисп, то есть отношение теплоты атомизации к теплоте испарения. Для водорода получается =400, для CH4 - 100, для Cl2 и S2 - 50, для J2 = 20 и т.д. В силикатных и боратных расплавах, образующих основу стёкол и шлаков, встречаются случаи от 1 до 2, или несколько более. Энергия связи внутри комплексов SiO4, BO3, может, например, вдвое превышать энергию внешних взаимодействий. Если величина не превышает нескольких единиц, то обычно говорят не о молекулообразовании, а о комплексообразовании.
Наиболее стабильны резко обособленные молекулы, при больших значениях . В простой атомарной жидкости, при =1, когда все связи равноценны, перегруппировки , соответствующие реакциям, идут безактивационно, стабильность нулевая, Ех 0. Легко определяемую “степень молекулярности” удобно принять за меру стабильности молекул.
Молекулообразование или комплексообразование в жидкости можно выявить также по понижению её приведённой температуры кипения и плавления RTкип/Hат, RTпл/Hат. Так, резкое обособление молекул в жидком водороде (внутримолекулярная связь примерно в 2000 раз прочнее внешних ) проявляется в том, что его температуры плавления (14К) и кипения (20К) примерно в сто раз ниже, чем у атомарных веществ при той же энергии атомизации Hат или при той же общей энергии Uат межатомных взаимодействий.
Если стабильность молекул определяется квантовыми эффектами, то должна существовать чёткая корреляция характеристик стабильности и обособленности молекул ( , RTкип/Hат, RTпл/Hат) с показателями меры квантовости системы (h/kT, S, Aср). Действительно, каждая такая величина, характеризующая стабильность молекул (степень молекулярности жидкости), хорошо коррелирует с каждым показателем квантовости; все такие корреляции имеют качественно одинаковый вид [204].
На рисунке 6.18 приведена одна из таких корреляций в координатах - h/kT, а на рисунке 6.19 подобная корреляция в координатах lnRTпл/Hат - lnAср. Всего здесь представлено 260 неорганических веществ, данные по которым имеются в справочниках [9, 205]. Видно, что степень молекулярности (отношение теплоты атомизации к теплоте испарения) у молекулярных веществ (крестики) интенсивно зависит от квантового параметра h/kT. Получается чёткая корреляция ln(RTпл/Hат) = 0,6lnA+const с дисперсией (средней ошибкой) - 0,34. Однако характер химической связи также существенно влияет на “степень молекулярности” жидкости, на стабильность её молекул и величины Ех. Так, металлы, инертные газы, бор, углерод ( точки на рис. 6.18, 6.19.) образуют полосу атомарных веществ, в которой или RTпл/ Hат значительно слабее зависят от h/kT или S, Aср. Большая величина атомарных квантовых эффектов является, следовательно, необходимым, но недостаточным условием высокой степени молекулярности, резкого обособления молекул. В частности, при металлической связи молекулообразования нет. Однако при малых значениях квантового параметра молекулы не образуются ни в одном случае; нет точек ниже молекулярной полосы на рис 6.18, 6.19. Тяжёлые элементы не образуют молекул независимо от характера связи, строения электронных оболочек, принадлежности элемента к определённой группе периодической системы.
Рассмотрим одну частную закономерность - изменение температур плавления простых веществ с двухатомными молекулами Э2:
Элемент |
H2 |
D2 |
N2 |
O2 |
F2 |
P2 |
S2 |
Br2 |
J2 |
Аср |
1 |
2 |
14 |
16 |
19 |
31 |
32 |
80 |
160 |
Тпл, К |
14 |
19 |
63 |
55 |
53 |
317 |
392 |
266 |
387 |
Видно, что температура плавления почти монотонно растёт с увеличением атомного веса, то есть с уменьшением интенсивности квантовых эффектов, так как энергия связи всех рассматриваемых веществ имеет величину одного порядка.
Согласно предлагаемой модели, и приведённой корреляции рис.6.19, при прочих равных условиях температура плавления должна возрастать пропорционально А0.6ср и при изотопическом эффекте, когда масса атома изменяется при неизменном взаимодействии. Действительно, более тяжёлые изотопы плавятся при более высоких температурах. В ряду водород (Тпл = 14К), дейтерий (Тпл = 19К) и тритий (Тпл = 21К) количественное изменение температуры плавления получается из уравнения Тпл А0.6ср примерно таким же, как в действительности. У других веществ повышение темературы плавления при переходе к более тяжёлым изотопам получается по уравнению значительно больше, чем в действительности ( например, при переходе от N14 к N15 Тпл в действительности составляет лишь 0,05К ). Вероятно, здесь нужно учитывать ещё и изменение нулевой энергии при варьировании Аcр.
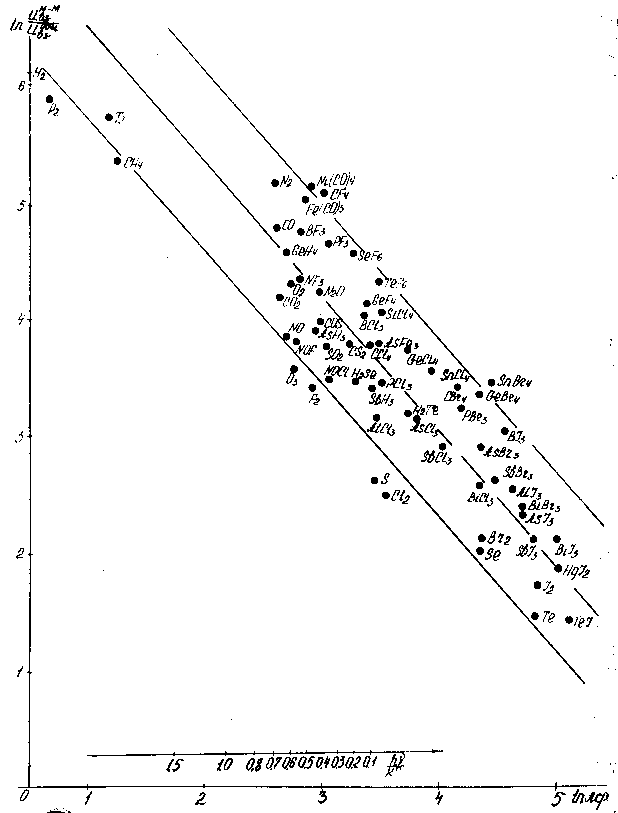
Рис. 6.18 Зависимость "степени молекулярности" b=Uат./DHисп. от квантового параметра hn/kT и от среднего атомного веса.
Чтобы остаться в рамках традиционного подхода, можно было бы попытаться объяснить высокую степень молекулярности водорода тем, что атом H имеет лишь один электрон и способен образовать лишь одну ковалентную связь; с ростом числа электронов во внешней оболочке растёт и возможность образования многих связей, необходимых для атомарной решётки. Однако весь материал, представленный на корреляциях, не поддаётся подобным объяснениям. Трудно так объяснить, например, рост степени молекулярности в рядах J2 , Br2, Cl2 , F2; GeCl4 , Si Cl4 , CCl4 и др.
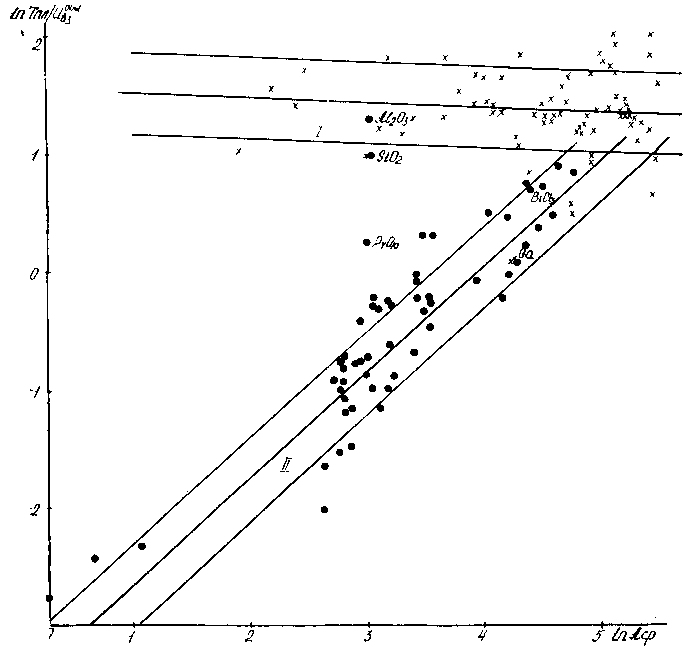
Рис. 6.19 Зависимость степени молекулярности (RTпл/Uвз) от среднего атомного веса. Видны две полосы корреляций соответственно для атомарных и молекулярных веществ.
Таким образом, степень молекулярности жидкости, которая характеризуется величинами , RTкип/Hат, RTпл/Hат даёт чёткую корреляцию с величинами, характеризующими степень квантовости системы: h/kT, S, Aср. Эта корреляция прослеживается на интервале более трёх порядков величины .
Образование резко обособленных молекул, с многократным превышением внутримолекулярного взаимодействия по сравнению с межмолекулярным, практически невозможно без участия первых 9-ти элементов периодической системы ( из её первой строки) или первого - второго периодов, без которых, как отмечалось выше, невозможно и стеклообразование. И в составе молекул ( как и в составе стекол ) только эти элементы ( и ещё S, Si ) имеют парциальную теплоёмкость, заметно пониженную по сравнению с классическим значением 3R вследствие квантового вымораживания части степеней свободы.
Естественно, наиболее сильным молекулообразователем является самый лёгкий элемент - водород. Если исключить все его соедиения, то совокупность молекулярных веществ сразу резко обедняется. Только соединения водорода с углеродом и их производные образуют целую органическую природу.
В расплавах, составленных из одних лишь тяжёлых элементов, часто вообще нет заметного молекулообразования и явно выраженных соединений, образуются лишь растворы. Нет, соответственно, и химических реакций; это “чисто физические” системы. Чтобы выявить и характеризовать химические свойства тяжёлых элементов, рассматривают, как известно, их реакции не с аналогичными тяжелыми элементами, но с лёгкими водородом и кислородом, дающие явно выраженные соединения.
Ещё Д.И. Менделеев отмечал, что химические свойства лёгких элементов более резко выражены [206]; их особые свойства многократно обсуждались, в частности, в связи с Периодической системой элементов. Однако в рамках традиционных представлений, естественно, не удаётся дать исчерпывающую теорию этого явления. В предлагаемой модели лёгкие элементы и их соединения - это вещества с наибольшими квантовыми эффектами и поэтому с наибольшей степенью молекулярности, с наиболее обособленными и стабильными молекулами.
