
Влияние условий на протекание овр
На протекание окислительно-восстановительных реакций оказывают
влияние следующие факторы:
– температура:
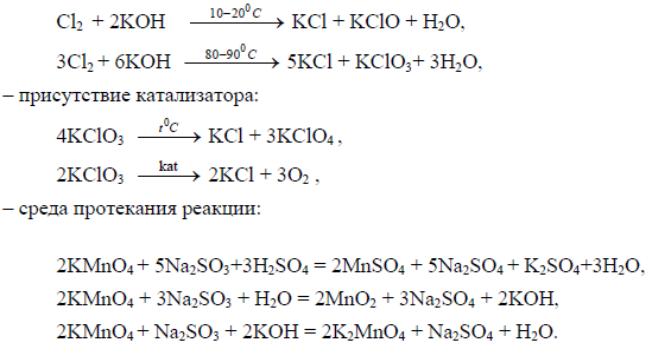
Приведенные выше реакции показывают, что перманганат калия в зависимости от среды восстанавливается в разной степени, что можно изобразить схемой:

Хром (III) окисляется до хрома (VI), который в кислой среде находится
в виде бихромат-ионов, а в щелочной – хромат-ионов
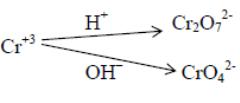
ОВР в различных средах чрезвычайно разнообразны, тем не менее, некоторые общие закономерности в них прослеживаются.
Так, в кислой среде:
– одно-, двух; трехзарядные ионы металлов с анионами кислот, использующимися для создания кислой среды, образуют соли
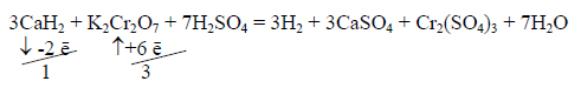
– атомы элементов со степенью окисления +4 и выше в различных средах
входят в состав кислотных остатков или оксидов
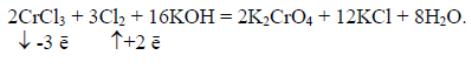
В щелочной среде амфотерные элементы образуют простые или комплексные соли собственных кислот
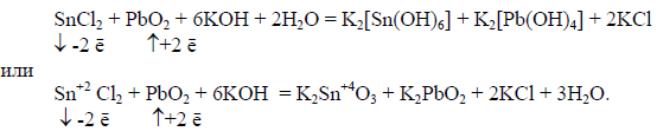
В нейтральной среде могут образовываться оксиды, гидроксиды или
кислоты, в зависимости от природы элемента, например,
3K2S + 2KMnO4 + 4H2O → 3S + 2MnO2 + 8KOH.
↓-2 ē ↑+3 ē
Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса.
Метод электронного баланса основан на сравнении степени окисления
атомов в исходных веществах и продуктах реакции. Коэффициенты подбираются на основе правила электронного баланса.
Расставим коэффициенты в уравнении окисления сульфата железа перманганатом калия в кислой среде.
Алгоритм составления уравнения
1. Определяют химические элементы, изменившие степень окисления:
KMn+7O4 + Fe+2SO4 + H2SO4 →Mn+2SO4 + Fe2+3(SO4)3 + K2SO4 + H2O.
2. Записывают процессы окисления и восстановления отдельно, указы-
вая при этом число отданных или принятых электронов:
окислитель Mn7+ + 5е¯ → Mn2+ восстановление,
восстановитель 2Fe2+ – 2е¯ → 2Fe3+ окисление.
2. Определяют общее число перемещающихся электронов по правилу
электронейтральности системы – общее число электронов, отдаваемых восстановителем, должно быть равно общему числу электронов, принимаемых окислителем. Таким образом, уравнения полуреакций принимают вид
Mn7+ + 5ē → Mn2+ 2
2Fe2+ – 2ē → 2Fe+3 5 .
3. Складывают два уравнения с учетом найденных коэффициентов и,
производя алгебраическое решение, получают суммарное уравнение
2Mn7+ + 10Fe2+ → 2Mn2+ + 10 Fe3+ .
Коэффициенты из суммарного уравнения переносят в молекулярное, а
затем подбором подводят баланс в левой и правой частях уравнения:
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
Метод электронного баланса универсален, позволяет составлять уравнения реакций, протекающих не только в растворе. Однако он менее нагляден и создает трудности при определении состава продуктов реакции.
Вопросы:
1. Наличие какого признака характерно для ОВР?
2. Назовите процессы, в которых степень окисления какого-либо вещества уменьшается или увеличивается.
3. Объясните роль в окислительно-восстановительных реакциях веществ NH3, NO2, HNO3? Приведите уравнения соответствующих реакций.
4. Разделите вещества H2SO4, HCl, КMnO4, FeSO4, Na, H2, HNO2,
HClO, H2O2, F2 на три группы:
а) вещества, проявляющие только окислительные свойства;
б) вещества, проявляющие только восстановительные свойства;
в) вещества, проявляющие как восстановительные, так и окислительные свойства;
5. Приведите два примера, в которых степень окисления кислорода
разная. Назовите эти соединения. Какими свойствами они обладают?
6. Определите роль пероксида водорода в реакциях
FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O,
Na2O2 + PbO2 + 4HNO3 = O2 + Pb(NO3)2 + 2NaNO3 + H2O.
7. Определите тип окислительно-восстановительной реакции:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH,
2Mg(NO3)2 = 2MgO + 4NO2 + O2 ,
PbS + 4H2O2 = PbSO4 + 4H2O.
Объясните изменения окислительной способности сульфат иона
SO42− │SO32− в кислой среде при рН = 10 и 0.
Литература:
Глинка Н.Л. Общая химия: Учеб. Пособие для вузов. 23-е изд. – Л.: Химия, 1983. 702 с.
Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1987. – 264 с.
Коровин Н.В. Химия. 3-е изд. испр. – М.: Высшая школа, 2002. – 558 с.
Зорькина О.В., Безручко Н.В. Химия: Методические указания к лабораторным работам. – Пенза: Изд-во ПТИ 2001. – 107 с.
Справочник химика. Т. 2. – Л.: Химия, 1971. – 651 с.
Руководство к лабораторным работам по общей и неорганической химии / Под ред. проф. Ф.Я. Кульба. – Л.: Химия, 1976. – 280 с.
Марьин В.К., Тарасова Л.И., Сельмаева М.В. Методические указания к лабораторным работам по химии. – Пенза: Изд-во ПВАИУ, 1997. – 98 с.
Руководство к лабораторным работам по общей химии / Под ред. А.Ф. Богоявленского. – М.: Высшая школа, 1972. – 192 с.
Хомченко И.Г. Общая химия: Учебник. – М.: Изд-во ООО Новая волна, 2002. 464 с.
10) Ляликов Ю.С. Физико-химические методы анализа. 5-е изд., перераб. и доп. – М.: Химия, 1973. – 536 с.
