
Лекция №5
Тема: Кислотно-основные свойства химических соединений. Теория окислительно-восстановительных реакций
Цель: рассмотреть эволюцию представлений о природе кислот и оснований, основные положения теории ОВР.
План лекции: 1) Современные представления о кислотах и основаниях
2) Основные положения теории Бренстеда-Лоури. Кислотно-основные сопряженные пары
3) Основные положения теории окислительно-восстановительных реакций, методика составления уравнений окислительно-восстановительных реакций.
![]()
Любое вещество в определенных условиях может проявлять свойства кислоты и основания по отношению к какому-либо другому веществу, включая и растворитель.
Со времен Аррениуса, по определению которого кислоты в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теория Бренстеда–Лоури и электронная теория Льюиса.
Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
|
|
|
По определению, HAn – кислота, An– – основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
|
|
|
Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.
|
Рисунок 1. |
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
В соответствии с законом действующих масс константы равновесия реакций протолиза сопряженных кислот и оснований в воде связаны между собой простым соотношением
|
|
|
|
|
|
|
|
|
|
|
|
Перемножив константы сопряженных кислот и оснований, получим
|
|
|
Заменив активности
![]() и
и
![]() на
равновесные концентрации, получим
на
равновесные концентрации, получим
|
|
|
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным KK(Kосн) можно легко найти значения сопряженных KВ.
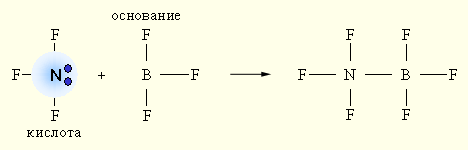
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары: NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
|
Рисунок 2. |
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:
|
|
|
Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз.
|
|
|
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
|
|
|
Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:
|
|
|
При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
|
K1 : K2 : K3 = 1 : 10–5 : 10–10. |
|
Теория окислительно-восстановительных реакций.
Окислительно-восстановительные реакции являются основой жизни на
Земле. С ними связано дыхание и обмен веществ в живых организмах, фотосинтез в зеленых частях растений и нервная деятельность человека и животных. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов и электролиза. С помощью окислительно-восстановительных реакций получают металлы, органические и неорганические соединения, проводят очистку различных веществ, природных и сточных вод и т. п.
Окислительно-восстановительные реакции (ОВР) – это реакции,
протекающие с изменением степени окисления элементов и сопровождающиеся переходом электронов.
Таким образом, любая окислительно-восстановительная реакция представляет собой совокупность процессов окисления и восстановления.
Окисление – это процесс отдачи электронов восстановителем:
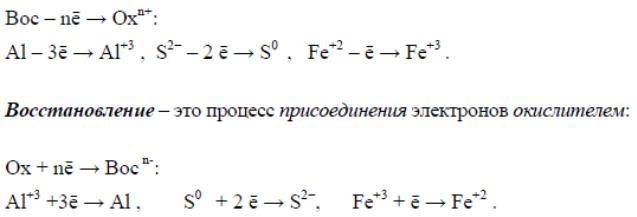
При окислении элемента степень окисления всегда увеличивается, а
при восстановлении – уменьшается.
Частицы (молекулы, атомы, ионы), которые содержат окисляющиеся
атомы, называются восстановителями.
Частицы (молекулы, атомы, ионы), которые содержат восстанавливающиеся атомы, называются окислителями.
В общем виде окислительно-восстановительную реакцию можно записать следующим образом:
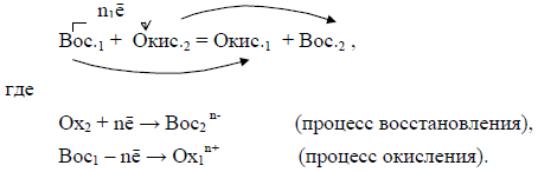
Из приведенных полуреакций видно, что окислитель превращается в
сопряженный восстановитель (продукт восстановления окислителя), а восстановитель – в сопряженный окислитель (продукт окисления восстановителя), образуя окислительно-восстановительную пару. Например, в реакции
HCl+1O + H2S2– = HCl–1 + S0↓ + H2O
окислитель – хлорноватистая кислота HCl+1O, которая восстанавливается до
Cl−1: Cl+1 + 2 ē → Cl−, а восстановитель – сероводород H2S, в котором сульфид-ион S2− окисляется до S0: S2− – 2 ē → S0.
Окислитель (HClO) образует окислительно-восстановительную пару
HClO/ Cl− , где HClO – окисленная форма, а Cl− – восстановленная форма.
Соответственно окислительно-восстановительная пара восстановителя (H2S)
S/H2S, где S – окисленная форма, а H2S – восстановленная форма.Для характеристики состояния элемента в молекуле введено понятие степени окисления.

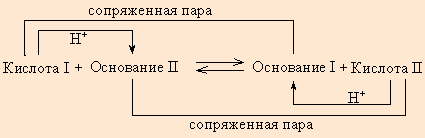 1
1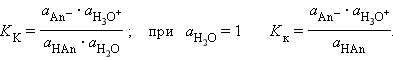
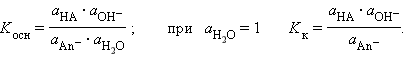
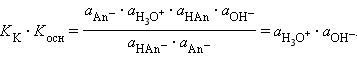
 2
2