- •«Моделирование объектов и систем управления отрасли»
- •Введение
- •Методы моделирования объектов и систем управления
- •Физическое моделирование объектов и систем управления
- •Метод подобия
- •Метод аналогий
- •Математическое моделирование химико-технологических процессов
- •Сущность, свойства и этапы математического моделирования химико-технологического процесса
- •Основные виды математических моделей химико-технологических процессов
- •Блочный принцип разработки математических моделей химико-технологических процессов
- •Основные подходы получения математических моделей химико-технологических процессов
- •Классификация экспериментальных методов. Виды математических моделей.
- •Модели динамики (статистические) химико-технологического процесса
- •Определение динамических характеристик химико-технологических процессов при активном эксперименте
- •Проведение эксперимента по снятию переходных функций
- •Обработка результатов эксперимента по снятию переходных функций
- •Получение динамических характеристик объекта по переходным функциям
- •Определение динамических характеристик объектов при входных воздействиях в виде случайных сигналов
- •Свойства и характеристики стационарных случайных процессов
- •Постановка эксперимента по определению статистических характеристик процессов
- •Определение динамических характеристик объектов и систем управления методом моментов
- •Применение метода модулирующих функций для определения динамических характеристик объектов и су
- •Получение модели статики объектов и су
- •Определение моделей статики (уравнения регрессии) при пассивном эксперименте
- •Регрессионный анализ в матричной форме
- •Получение модели статики при активном эксперименте
- •Детерминированные (аналитические) модели химико-технологических процессов
- •Использование уравнений материального и теплового баланса для описания стационарных и нестационарных режимов протекания химико-технологических процессов
- •Модели структуры потоков, как основа построения математических моделей гидромеханики химико-технологического процесса
- •Модель идеального перемешивания
- •Модель идеального вытеснения
- •Диффузионные модели
- •Однопараметрическая диффузионная модель (одм)
- •Двухпараметрическая диффузионная модель
- •Ячеечная модель
- •Математическое описание тепловых процессов
- •Прямоточные кожухотрубчатые теплообменники
- •Противоточный кожухотрубчатый теплообменник
- •Математические модели теплообменников с учетом накопления тепла в стенке
- •Прямоточный кожухотрубчатый теплообменник
- •Противоточный кожухотрубчатый теплообменник
- •Математическая модель конденсатора (паровой теплообменник)
- •Передаточные функции теплообменных аппаратов
- •4.5.1 Конденсатор без учета накопления тепла в станке
- •4.5.2 Конденсатор с учётом накопления тепла в стенке
- •4.5.3 Кожухотрубчатый противоточный теплообменник
- •Математическое моделирование массообменных аппаратов
- •Математическая модель процесса газоабсорбции
- •Математическая модель процесса ректификации
- •Передаточная функция ректификационной колонны
- •Математическое моделирование математических процессов
- •Математическая модель процесса химического превращения (кинетическая модель)
- •Математическая модель химического реактора идеального перемешивания
- •Математическая модель реактора идеального вытеснения
- •Передаточные функции химических реакторов
- •Передаточная функция реактора идеального перемешивания простого типа
- •Реактор идеального вытеснения
- •Математическое моделирование динамики типовых контуров регулирования технологических параметров объекта
- •Свойства, характеристики и классификация объектов регулирования
- •Регулирование уровня в резервуарах
- •Регулирование расхода жидких сред
- •Регулирование расхода сыпучего материала
- •Регулирование концентрации вещества в смесителях. Регулирование концентрации вещества в смесителях
- •Регулирование температуры в смесителях идеального перемешивания
- •Регулирование состава смеси в реакторе с мешалкой
- •Методы и алгоритмы идентификации динамических систем
- •Общая классификация задач идентификации
- •Постановка задачи идентификации
- •Идентификация непрерывных объектов в классе моделей с дискретным временем
- •Задача непараметрической идентификации
- •Задачи параметрической идентификации
- •Безпоисковые алгоритмы идентификации с адаптивной моделью (баиам)
- •8.6.1 Общая структура баиам в пространстве сигналов
- •8.6.2. Общая структура баиам с дискретным временем и операторным описанием
- •Оптимизация химико-технологических с использованием математических моделей
- •Постановка задач оптимизации
- •Поисковые модели идентификации с адаптивной моделью (пмиам)
- •Аналитические методы оптимизации
- •Метод классического анализа функций
- •Метод неопределенных множителей Лагранжа
- •Линейное программирование
- •Нелинейное программирование
- •Численные методы оптимизации. Постановка задачи оптимизации
- •Реализация методов оптимизации в пакете MatLab (toolbox)
- •Оптимизация (минимизация) функции
- •9.5.5. Использование метода наименьших квадратов для решения задач оптимизации
Передаточная функция ректификационной колонны
Передаточная функция -той тарелки:


где входные величины:
— расход жидкости;
 — расход
паре;
— расход
паре;
, .
Выходные величины:
, .





С индексом “ 0 ” — стационарные значения, с индексом “ ’ ” — приращение параметра в переходном режиме.
Запишем 5.3.1 для стационарного режима:

Запишем 5.3.2 для стационарного режима:

Получим
передаточную функцию по следующему
каналу
 в этом режиме все остальные переменные
принимаются в стационарном режиме,
кроме данного входа:
в этом режиме все остальные переменные
принимаются в стационарном режиме,
кроме данного входа:

 ,
,
 .
.
Решаем 5.3.1 для данных условий:


Запишем 5.3.2 для данных условий:
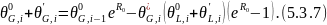
Вычитаем из 5.3.7 уравнение 5.3.4:

Вычитаем из 5.3.7 уравнение 5.3.5:


где

Перепишем 5.3.10 в виде:


С учетом 5.3.12 упростим 5.3.9:

Подставим 5.3.13 в 5.3.8:







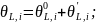




Вычитаем из 5.3.17 уравнение 5.3.5:
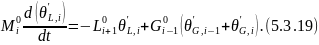
Вычитаем из 5.3.18 уравнение 5.3.5:


Подставляем 5.3.20 в 5.3.19:
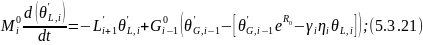




Канал

 ,
,
 — стационарные значения.
— стационарные значения.
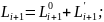

Запишем 5.3.1 стационарных условий:



Запишем уравнение 5.3.2:

Вычтем из 5.3.24 уравнение 5.3.4:

Преобразуем 5.3.26:


Так как приращения переменных принимаем равными небольшим переменным, следовательно, произведение небольших приращений приблизительно равно нолю.
Начальными условиями для 5.3.28 будут:

Преобразуем по Лапласу по времени уравнение 5.3.26:


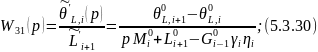
Канал

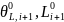 ,
— стационарные значения.
,
— стационарные значения.

Запишем 5.3.1 стационарных условий:


Запишем уравнение 5.3.1 для данных условий:

Вычтем из 5.3.32 уравнение 5.3.4:

Вычтем из 5.3.32 уравнение 5.3.5:


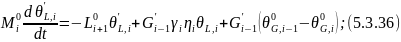

Преобразуем по Лапласу по времени 5.3.36:


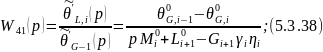




Процессы тепло- и массопередачи проходящие в кубе-испарителе и дефлегматоре протекают намного быстрее чем на тарелке, поэтому передаточная функция по каналам этих частей можно представить в виде усилительных звеньев для получения которых можно использовать вышеприведенные статические зависимости.
Математическое моделирование математических процессов
Математическая модель процесса химического превращения (кинетическая модель)
Протекание химической реакции можно описать следующим стехиометрическим уравнение:

— исходные компоненты реакции;
 — продукты
реакции;
— продукты
реакции;
 — стехиометрические
коэффициенты;
— стехиометрические
коэффициенты;
 — стехиометрические
коэффициенты.
— стехиометрические
коэффициенты.
Уравнение 6.1.1 можно представить в более общем виде:



Пусть в реакторе протекает -реакций:

в реакции участвуют веществ.
Уравнение 6.1.1 примет вид:
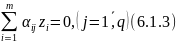
где
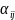 — стехиометрический коэффициент
-той
реакции по
— стехиометрический коэффициент
-той
реакции по
 -тому
компоненту.
-тому
компоненту.
 — для
исходных компонентов;
— для
исходных компонентов;
 — для
продуктов реакции.
— для
продуктов реакции.
Если
-тое
вещество не участвует в
 -той
реакции, то
-той
реакции, то
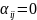 .
.
Основной характеристикой химической реакции является её скорость. Скорость. Химической реакции по -тому компоненту называется изменение компонента в единицу времени:
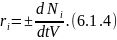
Зная скорость химической реакции по одному из компонентов можно определить скорость по остальным:

где — количество молей -того вещества участвующего в -той реакции;
 — скорость
стадии
-той
реакции.
— скорость
стадии
-той
реакции.
По закону действующих масс:

где
 — константа скорости
-той
реакции;
— константа скорости
-той
реакции;
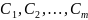 — концентрации.
— концентрации.
Общий порядок реакции равен;

где зависит от температуры:

где
 — предэкспоненциальный множитель,
зависящий от свойств компонентов;
— предэкспоненциальный множитель,
зависящий от свойств компонентов;
 — энергия
активации
-той
реакции;
— энергия
активации
-той
реакции;
Химические реакции по количеству стехиометрических уравнений описывающих их протекание подразделяются на простые и сложные.
Пример простых:


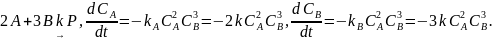
Константы скорости реакции по соответствующему компоненту равна константе стадии реакции на соответствующий стехиометрический коэффициент.
Сложные реакции делятся на параллельные, последовательные и смешанные и обратимые. Изменение концентрации -того вещества в сложной реакции равна скорости его образования (расходования) на всех стадиях в которых данное вещество участвует, то есть сложная реакция разделяется на отдельные стадии.
Пример:
Параллельная реакция:

Последовательная реакция:

Обратимая реакция:

Смешанная: