
1. Реакции присоединения
А. Гидрирование:
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем алканов (разрывается вторая π-связь):
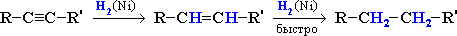
При использовании менее активного катализатора [Pd/CaCO3/Pb(CH3COO)2] гидрирование останавливается на стадии образования алкенов.
Б. Галогенирование:
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая π-связь разрывается труднее, чем вторая):
Алкины обесцвечивают бромную воду (качественная реакция).
![]()
В. Гидрогалогенирование
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:
![]()
Г. Гидратация (реакция Кучерова):
Присоединение воды в присутствии катализатора соли ртути (II) идет через образование неустойчивого енола, который изомеризуется в альдегид или кетон.
Если гидратации подвергается АЦЕТИЛЕН, то образуется уксусный альдегид.
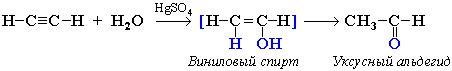
Из всех остальных алкинов при гидратации образуются кетоны (так как присоединение протекает по правилу Марковникова).
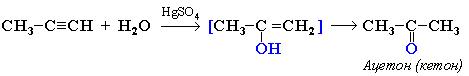
2. Димеризация и тримеризация алкинов
1) Димеризация под действием водно-аммиачного раствора CuCl:
![]()
2) Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
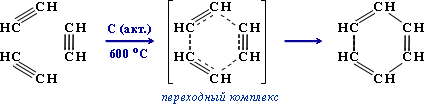
3. Кислотные свойства алкинов с концевой тройной связью.
Образование солей: концевые атомы водорода у ацетилена и алкинов-1 могут замещаться атомами металла. При этом образуются соли – ацетилениды:
СН3-С≡С-Н + NaNH2 СН3-С≡С-Na + NH3
амид натрия ацетиленид натрия
При взаимодействии ацетилена (или R–C≡C–H) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:

HC≡CH + 2[Cu(NH3)2]OH CuC≡CCu + 4NH3 + 2H2O
ацетиленид меди (I)
Образование серовато-белого осадка ацетиленида серебра (или красно-коричневого - ацетиленида меди) служит качественной реакцией на концевую тройную связь.
AgC≡CAg + Н2О – реакция не идет
AgC≡CAg + 2НСl НC≡CН + 2АgCl
Окисление алкинов:
Горение (полное окисление):
2 С2Н2 + 5 О2 →4 СО2 + 2 Н2О
CnH2n-2 + (3n-1)O2 = nCO2 + (n-1)H2O
2
Неполное окисление
Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения.
1) Ацетилен окисляется раствором перманганата калия до соли щавелевой кислоты – оксалата калия (в нейтральной среде) или до щавелевой кислоты (кислая среда):
3НС≡СН + 8KMnO4 3КООС-СООК + 8MnO2↓+ 2 KOH+ 2H2O
3 2C1 8e → 2C+3 окисление
восстановитель
8 Mn+7 + 3e → Mn+4 восстановление
oкислитель
2) Алкины окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот
В кислой среде:
5С2Н2 + 8KMnO4 + 12Н2SО4 5НООС-СООН + 8MnSO4 + 4K2SO4 + 12H2O
5СН3-C≡СН + 8KMnO4 + 12Н2SО4 5 СН3-СООН + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O
5СН3СН СНСН3 + 6KMnO4 + 9H2SO4→ 10CH3COOH + 6MnSO4 + 3K2SO4+4H2O
5 СН3- СН2 -C≡С- СН3 + 6KMnO4 + 9Н2SО4 5 СН3- СН2 -СООН + 5 СН3-COOH +6MnSO4 +3K2SO4 + 4H2O
В нейтральной или слабощелочной средах окисление гомологов ацетилена идёт с разрывом тройной связи и образованием солей карбоновых кислот
3СН3-C≡СН + 8KMnO4 3 СН3-СООК + К2СО3 + КНСО3 + 8MnO2↓+H2O
CH3C CH + 8KMnO4 + 11KOH → CH3COOK + K2CO3 + 8K2MnO4 + 6H2O
СН3- C≡С- СН3 + 2KMnO4 2 СН3-СООК +2 MnO2↓
