
- •Приборы качества (Анализаторы)
- •Тема 1. Погрешности градуировки анализаторов состава
- •Задачи к теме 1
- •Тема 2. Анализаторы состава газов
- •Задачи к теме 2
- •Тема 3. Анализаторы состава растворов
- •Задачи по теме 3
- •Тема 4. Измерение плотности и вязкости
- •Вопросы по теме 4
- •Тема 5. Анализ дисперсности суспензий и эмульсий
- •Вопросы по теме 5
- •Список рекомендуемой литературы
Тема 3. Анализаторы состава растворов
Принцип действия кондуктометров основан на измерении электропроводности анализируемого вещества, являющейся функцией концентрации какого-либо компонента. Основным элементом контактных кондуктометров является электродная ячейка (рисунок 3.1), включаемая в одно из плеч неуравновешенного моста.
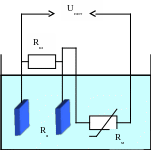
Рисунок 3.1 – Электродная ячейка кондуктометра
Каждая ячейка имеет свою постоянную К, т.е. коэффициент, определяющий соотношение между удельной электропроводностью χ0 анализируемого раствора и электропроводностью χ ячейки или ее сопротивлением Rя, под которым понимается сопротивление жидкости, заполняющей межэлектродное пространство:
![]() .
(3.1)
.
(3.1)
Размерность постоянной ячейки [K] = м-1.
Электропроводность раствора очень сильно зависит от температуры, поэтому последовательно с электродами включается медный терморезистор Rм. Для температурной компенсации необходимо, чтобы изменение сопротивления электродной ячейки ΔRя было равно по величине и противоположно по знаку изменению сопротивления медного терморезистора ΔRм. Для узкого интервала температур зависимость сопротивления ячейки от температуры имеет вид
![]() (3.2)
(3.2)
где t – текущее значение температуры в интервале t1 – t2; β – средний температурный коэффициент электропроводности раствора в этом интервале температур; Rяt и Rя1 – сопротивления ячейки при значениях температуры t и t1.
Изменение сопротивления ΔRя ячейки при изменении температуры от t1 до t2 равно
![]() (3.3)
(3.3)
т.е. сопротивление нелинейно уменьшается с ростом температуры.
Изменение сопротивления ΔRм медного резистора при изменении его температуры от t1 до t2 равно
![]() (3.4)
(3.4)
где Rм0 – сопротивление резистора при 0 0С; α = 0,00426 1/0С – температурный коэффициент сопротивления меди.
Таким образом, из-за нелинейного изменения ΔRя и линейного изменения ΔRм полная компенсация возможна не более чем в двух точках температурного диапазона t1 - t2.
При небольших концентрациях растворов их электропроводность χ мала, поэтому для уменьшения расчетного значения Rм0 электроды ячейки шунтируются манганиновым сопротивлением Rш. Их эквивалентное сопротивление называется сопротивлением измерительной ячейки, или приведенным сопротивлением электродной ячейки Rпр. Оно будет равно
![]() (3.5)
(3.5)
При изменении температуры раствора от первоначального значения t1 до текущего t приведенное сопротивление Rпрt станет равным
![]() (3.6)
(3.6)
Эта зависимость также нелинейная, поэтому полная температурная компенсация по-прежнему возможна только в двух точках.
Условием компенсации является равенство ΔRпр и ΔRм. Для Δt = t1 – t2 изменение ΔRпр равно
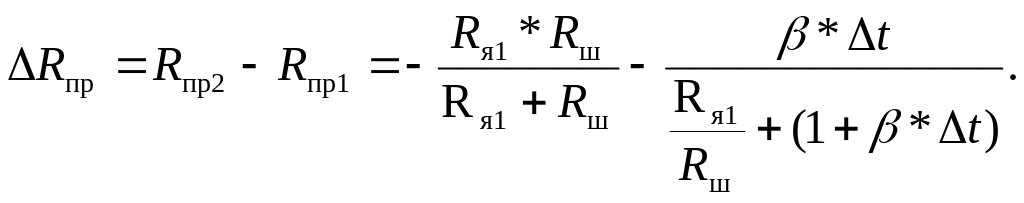 (3.7)
(3.7)
Значение температурной погрешности неодинаково в рабочем интервале температур. Максимальная погрешность будет иметь место, когда
![]() (3.8)
(3.8)
Эти производные можно найти следующим образом:
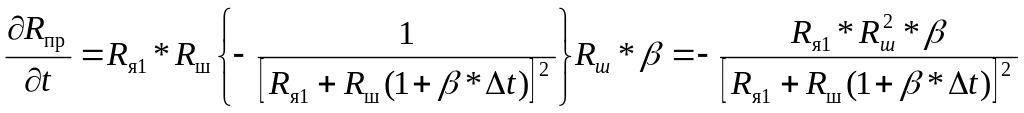 ;
;
![]() (3.9)
(3.9)
Для нахождения
значения t,
при котором имеет место наибольшая
разность
![]() ,
необходимо использовать равенство
(3.8):
,
необходимо использовать равенство
(3.8):
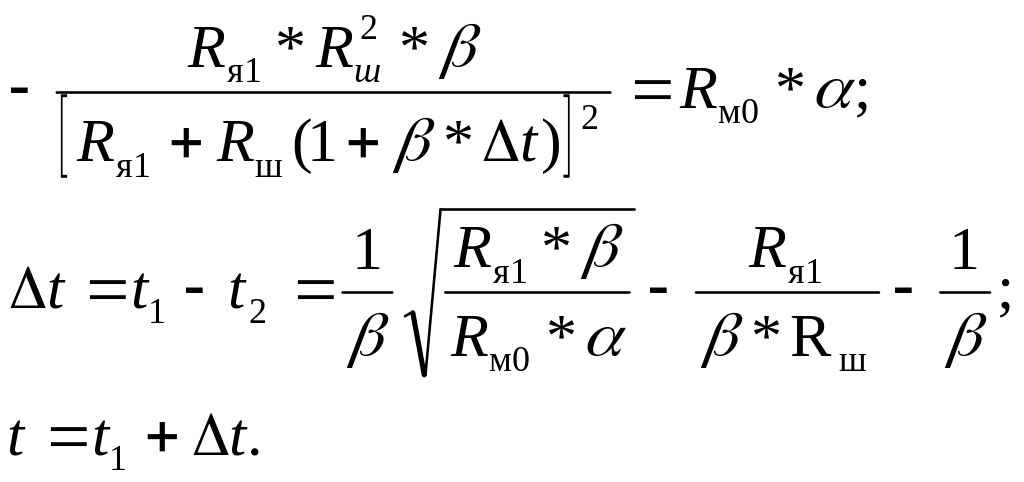 (3.10)
(3.10)
Погрешность компенсации равна
![]() (3.12)
(3.12)
На эту погрешность вторичный прибор будет реагировать как на уменьшение сопротивления электродной ячейки на значение ΔRя:
![]() (3.13)
(3.13)
Такое уменьшение сопротивления электродной ячейки эквивалентно увеличению удельной электропроводности раствора на значение
![]() .
(3.14)
.
(3.14)
Абсолютная ΔС и относительная δ погрешности прибора, отградуированного в процентах концентрации анализируемого компонента, находятся по заданной зависимости удельной электропроводности χ0 от концентрации:
![]() (3.15)
(3.15)
где С – действительное значение концентрации.
Принцип действия потенциометрических анализаторов основан на измерении потенциала специального электрода, размещаемого непосредственно в анализируемом растворе (он должен быть электролитом). Этот потенциал зависит от концентрации некоторого определенного иона в анализируемом растворе. Примером такого анализатора является рН-метр, измеряющий концентрацию в растворе водородных ионов Н+.
Электродный потенциал измеряется по ЭДС гальванического элемента (рисунок 3.2), составленного из измерительного (индикаторного) электрода 1 и сравнительного (вспомогательного, или опорного) электрода 2. Оба электрода погружены в гальваническую ячейку с анализируемым раствором. Потенциал измерительного электрода Еи изменяется при изменении концентрации определяемых ионов в растворе, а потенциал сравнительного электрода Еср остается постоянным, т.к. не зависит от нее. ЭДС Е такого гальванического элемента определяется разностью потенциалов электродов:
![]() (3.16)
(3.16)
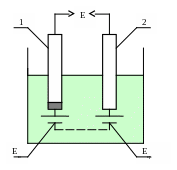
Рисунок 3.2 – Гальваническая ячейка потенциометрического анализатора
При измерении показателя рН разность потенциалов между измерительным и сравнительным электродами равна
![]() (3.17)
(3.17)
где t – температура раствора, 0С; Еи, рНи – координаты изопотенциальной точки (то есть точки, положение которой в координатах (Е; рН) не зависит от температуры). Она находится из условия равенства нулю частной производной функции Е = f(pH, t) по температуре.
Коэффициент преобразования электродной системы К равен
![]() (3.18)
(3.18)
Для измерения ЭДС Е электродных систем используются устройства с очень высоким входным сопротивлением, т.к. показания милливольтметра U связаны со значением Е выражением
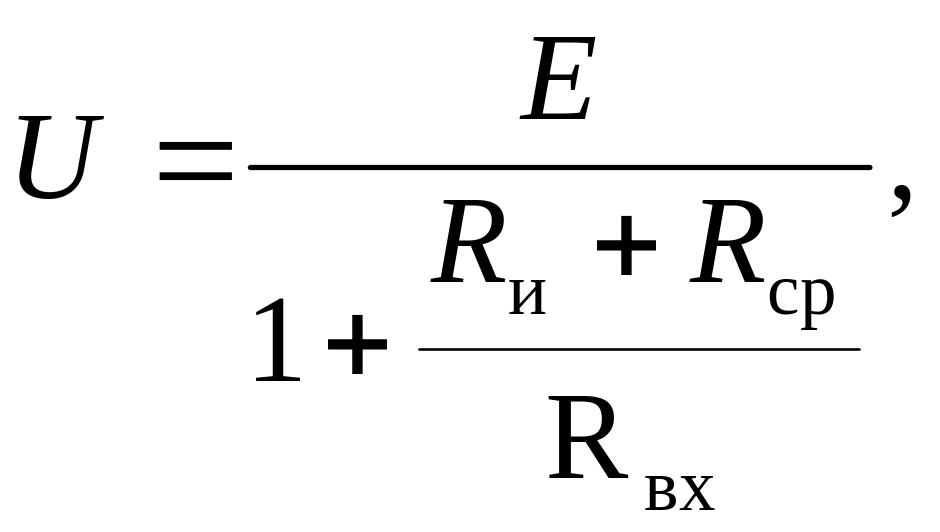 (3.19)
(3.19)
где Rи, Rср – сопротивления измерительного и сравнительного электродов; Rвх – входное сопротивление милливольтметра.
