
- •Спирты т Пособие для самостоятельной работы студентов
- •Оглавление Введение 2
- •Введение
- •1. Источники спиртов
- •2. Реакции спиртов
- •2.1. Кислотно-основные свойства спиртов
- •2.2. Реакции замещения гидроксильной группы
- •А. Реакции с галогенводородами
- •Б. Действием галогенидов фосфора
- •Дегидратация спиртов
- •Окисление спиртов
- •4. Реакции спиртов с кислотами
2. Реакции спиртов
Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя неподеленными парами электронов. В молекуле спиртов можно выделить следующие реакционные центры:

ОН-кислотный центр, обусловливающий возможность отщепления протона вследствие высокой полярности связи ОН;
нуклеофильный и n-основный центр атом кислорода, имеющий неподеленные пары электронов;
электрофилный центр -атом углерода, на котором дефицит электронов вызван I-эффектом соседней гидроксильной группы;
-С-кислотный центр, в котором поляризация связи. СН также обусловлена электроноакцепторным влиянием гидроксильной группы.
2.1. Кислотно-основные свойства спиртов
По кислотности спирты близки к воде. Кислотные свойства спиртов определяются способностью к протонизации атома водорода гидроксильной группы. Последняя обусловливается не только разницей в электроотрицательностях между атомами кислорода (3,5) и водорода (2,1), но и природой радикала. Метанол (pKa = 15,5), несколько более сильная кислота, чем вода (pKa = 15,7), но большинство спиртов являются более слабыми кислотами, чем вода. Причиной этого являются стерические препятствия, мешающие в разветвленных спиртах, сольватации образующегося алкоксид-аниона. Сольватация стабилизирует алкоксид-анион и, следовательно, усиливает кислотные свойства. В водном растворе кислотность спиртов уменьшается в ряду:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
pKa (в воде) 5.0 15,5 15,7 15,9 17,0 18,0
В жидкой фазе определяющим фактором стабилизации алкоксид-анионов является эффект сольватации, который тем больше, чем меньше стерические препятствия для сольватации, т.е. чем меньше в молекуле углеводородных радикалов и меньше их размер. Разветвленность алкильной группы снижает кислотность спиртов, а введение в их молекулы атомов галогена, наоборот повышает ее.
2.2. Реакции замещения гидроксильной группы
Многие важные реакции спиртов осуществляются путем замещения гидроксильной группы. Но гидроксид-анион является настолько сильным нуклеофилом, что вытеснение его из молекулы спирта невозможно.
![]()
Для
осуществления замещения гидроксильной
группы в спиртах, их нужно модифицировать
таким образом, чтобы гидроксильная
группа превратилась в хорошую уходящую
группу. Одним из способов такой модификации
является перевод атома кислорода
гидроксильной группы в оксониевую
форму.
![]()
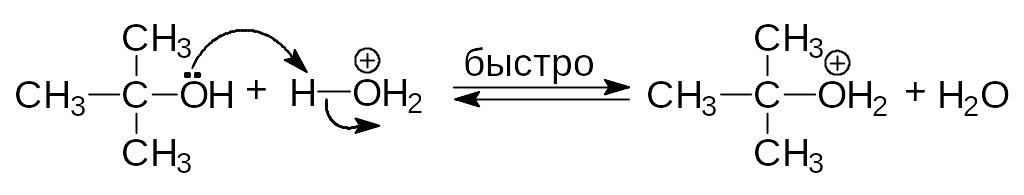
Протонирование спиртов превращает плохую уходящую группу (ОН) в хорошую уходящую группу (Н2О). Протонирование приводит и к увеличению положительного заряда на атоме углерода связанном с гидроксильной группой, т.к. ОН2+ сильнее оттягивает электроны, чем ОН.
А. Реакции с галогенводородами
Реакция спиртов с галогеноводородами приводит к замещению их гидроксильной группы на галоген. Условия протекания реакции зависят от строения спирта и природы галогеноводородной кислоты. Наибольшей активностью обладают спирты аллильного и бензильного типов, а также третичные спирты. Они реагируют с большей скоростью, чем вторичные, а последние превосходят первичные спирты. С увеличением длины углеводородного радикала реакционная способность спиртов каждого типа понижается. Реакционная способность галогеноводородных кислот, действующих как катализатор и источник нуклеофила, падает в последовательности HI > HBr > HCl >> HF, что связано с уменьшением силы кислоты и уменьшением нуклеофильности при переходе от иодид-иона к хлорид-иону.
Иод- и бромводородная кислоты легко взаимодействуют со всеми спиртами. Но иодводородная кислота способна также восстанавливать как исходные спирты, так и образующиеся иодпроизводные в углеводороды, что ограничивает ее применение.
Скорость реакции с HF слишком мала для прямого превращения спиртов в алкилфториды.
Для получения третичных алкилгалогенидов обычно достаточно насытить третичный спирт газообразным галогеноводородом при 0-10оС или обработать водной соляной, бромистоводородной или йодистоводородной кислотой в течение короткого промежутка времени при 0-20оС.
Первичные спирты реагируют, в основном, по механизму SN2, а третичные - SN1.
Третичные спирты реагируют с концентрированными HCl, HBr и HI очень быстро. При смешивании третичного спирта с концентрированной соляной кислотой при обычной температуре через несколько минут образуется, нерастворимый в воде, трет-бутилхлорид. Водорастворимые низкомолекулярные первичные и вторичные спирты в этих условиях не реагируют.
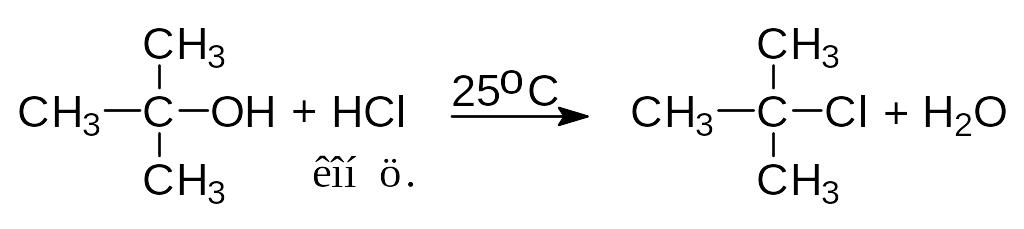
2-метил-2-пропанол 2-метил-2-хлорпропан
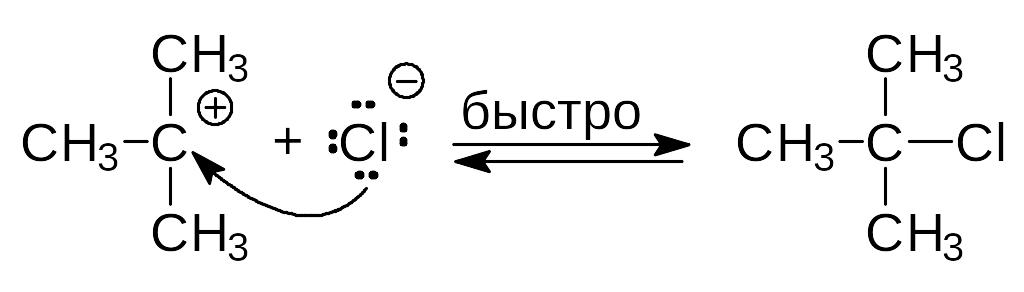
Реакция проходит по механизму SN1:

Для получения первичных и вторичных алкилбромидов и алкилиодидов обычно требуется нагревание смеси спирта и концентрированной бромистоводородной или йодистоводородной кислоты в течение нескольких часов или подачей сухого галогенводорода в спирт.
![]()
этанол этибромид
Первичные спирты реагируют по механизму SN2:
![]()

Во вторичных спиртах замещение гидроксильной группы происходит по обоим механизмам, что приводит к образованию основного и перегруппировочного продуктов.
