
- •Ответы к контрольной работе.
- •Определение качества.
- •Основные химические законы.
- •Гравиметрический метод анализа.
- •Титриметрический метод анализа.
- •Фотометрический метод анализа. (Фотоколориметрический)
- •Спектрофотометрические методы анализа.
- •Потенциометрические методы анализа
- •Полярографические методы анализа
- •Атомно-абсорбционный метод анализа
- •Эмиссионный спектральный анализ
- •Влияние газов на свойства металла
- •Метод восстановительного плавления
- •Влияние нв на свойства стали
- •Классификация неметаллических включений
- •Методы выделения неметаллических включений.
- •24. Изготовление шлифа.
- •25.Определение нв в металле металлографическим методом по эталонным шкалам.
- •Рентгеноспектральный метод
- •Контроль макроструктуры
- •Методы неразрушающего контроля макродефектов
Спектрофотометрические методы анализа.
СПЕКТРОФОТОМЕТРИЧЕСКИЕ МЕТОДЫ
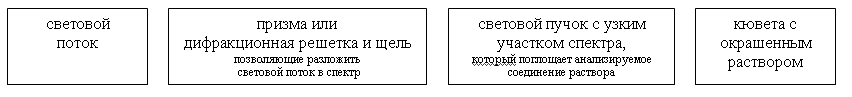
Спектрофотометрический метод – основан на измерении при помощи спектрофотометра светопоглощения раствора в монохроматическом потоке света т.е. в потоке света определенной длины волны.
В спектрофотометре светопоглощение раствора также измеряется при помощи фотоэлементов. Но в нем имеется призма или дифракционная решетка и щель, позволяющие разложить световой поток в спектр, отобрать и направить на кювету с анализируемым раствором свет необходимой длины волны или световой пучок с узким участком спектра.
Потенциометрические методы анализа
Потенциометрический метод анализа основан на измерении в анализируемом растворе потенциала электрода, изменяющегося в процессе протекания химической реакции и зависящего от концентрации и температуры раствора.
Момент окончания химической реакции (титрования) определяют по скачкообразному изменению потенциала электрода, опущенного в анализируемый раствор.
Электрод реагирующий на изменение концентрации ионов при титровании, наз.индикаторным, второй электрод- электрод сравнения.
Индикаторный электрод должен быстро реагировать на изменение концентрации титруемых ионов, электрод сравнения – вообще не реагировать на изменение концентрации определяемого элемента.
Для измерения потенциала индикаторного электрода составляют электродную пару т.е. гальванический элемент (индикаторный + электрод сравнения).
Изменение электродвижущей силы (ЭДС) электродной пары в процессе точно соответствует изменению потенциала индикаторного электрода.
Ход анализа: Титрованный раствор из бюретки добавляют к анализируемому раствору, периодически измеряя ЭДС элемента (индикаторный + электрод сравнения). По полученным данным строят кривую зависимости потенциала индикаторного электрода (величина которого равна ЭДС элемента) от добавленного обьема титрованного раствора. Получается кривая потенциометрического титрования с резким изменением потенциала электрода в эквивалентной точке определяющей конец титрования.
Полярографические методы анализа
Полярографический анализ основан на процессе электролиза, сопровождающегося восстановлением или окислением анализируемого вещества на поверхности одного из электродов.
Особенность метода – использование электродов с различной поверхностью. Поверхность одного из электродов должна быть во много раз меньше другого наз. МИКРОЭЛЕКТРОДОМ (ртутные капли), второй электрод ЭЛЕКТРОД СРАВНЕНИЯ, поверхность которого во много раз больше (ртуть, налитая на дно электролитической ячейки).
На эти электроды от источника тока подают напряжение. Плотность тока на электроде сравнения мала (т.к. большая поверхность электрода), на микроэлектроде – высока. В таких условиях изменяет свой равновесный потенциал лишь микроэлектрод т.е. происходит его поляризация. Данный метод связан с изучением поляризации микроэлектрода на основе поляризационных кривых (полярограмм) в координатах ток-напряжение. Между концентрацией анализируемого вещества в растворе и предельной силой тока, определяемой из полярограммы, существует зависимость, позволяющая установить концентрацию анализируемого вещества. Схема установки и полярограмма на рис.
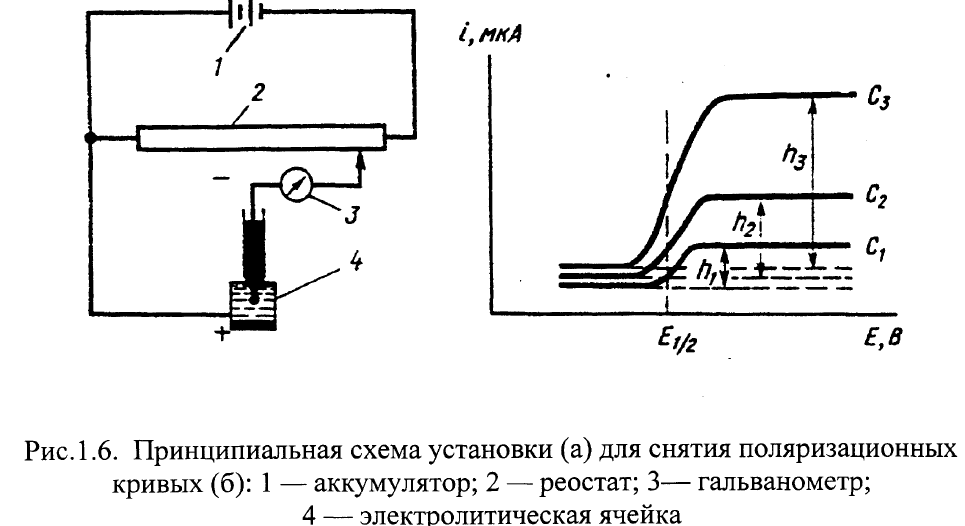
Ток от аккумулятора поступает на реостат, при помощи которого через гальванометр подается плавно повышающееся напряжение на элетролитическую ячейку (ртутный анод, ртутно-капельный катод, анализируемый раствор). Фиксируя силу тока проходящую через ячейку, в зависимости от поданного напряжения, получают поляризационные кривые-полярограммы. Приборы наз. полярографами.
Форма поляризационной кривой:
первый участок – начальный момент процесса – протекает остаточный ток, связанный с расходом электричества на заряжение электрического слоя поверхности каждой капли ртути, резкий скачок силы тока – восстановление ионов на микроэлектроде, т.е. достижение напряжения, равного потенциалу восстановления ионов.
Высота полярографической волны – прямо пропорциональна концентрации вещества в процессе. Определив потенциал полуволны Е ½ по полярограмме и воспользовавшись справочными полярографическими таблицами - можно определить природу вещества и установить присутствие этого вещества в растворе.
Преимущества: Быстрота выполнения анализа, чувствительность – 10-5 моль/литр, погрешность 1-5%.
