
- •Самостоятельная работа № 8
- •§ 1. Обучающие примеры с алгоритмами решения по теме «Квантовая теория химической связи» Пример 1. Определение основных характеристик химической связи
- •Пример 2. Описание химической связи методом валентных связей
- •Пример 4. Свойства химической связи
- •§ 2. Домашнее задание для закрепления темы «Квантовая теория
- •Приложения Приложение №1. Значения энергии связи между различными атомами ( ) в молекулах при температуре 298 к.
- •Приложение № 2. Значения длины химической связи ( ) между отдельными атомами в молекуле
- •Приложение № 3. Значения величин относительных электроотрицательностей (эо) и первых потенциалов ионизации ( , эВ)
Пример 2. Описание химической связи методом валентных связей
1.Определите
вид гибридизации электронных орбиталей
в молекуле германа
 и пространственную конфигурацию этой
молекулы.
и пространственную конфигурацию этой
молекулы.
Решение.
Переход в возбужденное состояние
внешнего энергетического уровня атома
германия под действием энергии активации
химической реакции осуществляется по
схеме: Ge:
4s2
4p2
+ ħν → Ge*: 
↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
|
↑↓ |
При
этом возникают четыре гибридных
 -электронных
орбитали (вид гибридизации -
),
с которыми образуют четыре σ-связи
s-орбитали четырех атомов водорода, их
ядра располагаются по вершинам тетраэдра:
-электронных
орбитали (вид гибридизации -
),
с которыми образуют четыре σ-связи
s-орбитали четырех атомов водорода, их
ядра располагаются по вершинам тетраэдра:
 *:
+
*:
+
 :
: →
:
→
:
 .
.
↑ |
↑ |
↑ |
↑ |
↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
→
+ 4
+  →
→
 Схема
пространственного расположения ядер
атомов германия и водорода в молекуле
германа имеет вид:
Схема
пространственного расположения ядер
атомов германия и водорода в молекуле
германа имеет вид:
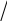



○ Ge



 ●Н
●Н


H● ● H
●H
Ответ: в молекуле вид гибридизации , пространственная конфигурация – тетраэдр с ядром атома германия в его вершине.
2.Объясните,
в чем причина различной пространственной
структуры молекул
 и
.
и
.
Решение.
В возбужденном состоянии внешний
энергетический уровень атома бора
представляет собой систему с тремя
 -
гибридизованными орбиталями, направленными
к вершинам плоского треугольника под
углом 1200
друг к другу:
-
гибридизованными орбиталями, направленными
к вершинам плоского треугольника под
углом 1200
друг к другу:
↑ |
↑ |
↑ |
|
 *:
*:

В
каждом из трех атомов хлора имеется по
одному валентному 3 -
не спаренному электрону, но несмотря
на наличие вакантной d-орбитали,
гибридизации р- и d-орбиталей не происходит:
-
не спаренному электрону, но несмотря
на наличие вакантной d-орбитали,
гибридизации р- и d-орбиталей не происходит:
↑↓ |
↑↓ |
↑↓ |
↓ |
Cl :
В
молекуле бора хлорида валентные электроны
атомов хлора ориентируются по осям
координат, занимая соответственно
положения
 ,
,
 и
и
 ,
позволяющие им образовывать электронные
пары с гибридными орбиталями атома
бора. Таким образом, молекула
,
позволяющие им образовывать электронные
пары с гибридными орбиталями атома
бора. Таким образом, молекула
 имеет треугольное плоскостное строение,
в центре располагается ядро атома бора,
а по вершинам треугольника – ядра атомов
хлора:
имеет треугольное плоскостное строение,
в центре располагается ядро атома бора,
а по вершинам треугольника – ядра атомов
хлора:

 ●
Cl
●
Cl

○B
 Cl
● ● Cl
Cl
● ● Cl
В молекуле аммиака атом азота, обладая тремя не спаренными электронами на внешнем валентном уровне, направленными к вершине треугольной пирамиды, где размещается ядро атома азота со свободной электронной парой на внешнем валентном уровне, способен образовать три полярные σ-связи с тремя электронными орбиталями трех атомов водорода:
 :
:
 +
+  :
→
:
:
→
: 
↑↓ |
↑↓ |
↑↓ |
↑ |
↑ |
↑ |
↑↓ |
↓ |
N + 3 H → NH3
Пространственное строение молекулы – треугольная пирамида, в вершине – ядро атома азота, в вершинах треугольника - основания размещаются ядра атомов водорода: ○N

 ●H
●H


H● ●H
Подтверждением
такого различия в пространственном
строении молекул аммиака и бора хлорида
является высокое значение полярности
молекулы
( = 16,32 D)
и отсутствие полярности в молекуле
(
= 0),
хотя связь
= 16,32 D)
и отсутствие полярности в молекуле
(
= 0),
хотя связь
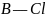 является
полярной (ΔЭО = 1,0, см. Приложение № 3).
является
полярной (ΔЭО = 1,0, см. Приложение № 3).
Ответ:
различие пространственной структуры
молекул
и
объясняется
-
гибридизацией электронных орбиталей
атома бора, обеспечивающей их более
выгодное перекрывание с орбиталями
атомов хлора и образование неполярной
молекулы, в отличие от атома азота, где
 - гибридные АО азота, перекрываясь с
орбиталями атомов водорода, образуют
взаимно не компенсирующиеся полярные
связи.
- гибридные АО азота, перекрываясь с
орбиталями атомов водорода, образуют
взаимно не компенсирующиеся полярные
связи.
3.Объясните,
почему существует соединение фосфора
пентафторид
 ,
но никогда не образуется азота пентафторид
,
но никогда не образуется азота пентафторид
 .
.
Решение.
Азот и фосфор, располагаясь в главной
подгруппе V группы Периодической системы
элементов Д. И. Менделеева, обладают
одинаковой конфигурацией внешнего
электронного уровня
 .
Но азот находится во II периоде и,
следовательно, его внешний энергетический
уровень состоит только из s- и р- подуровней:
.
Но азот находится во II периоде и,
следовательно, его внешний энергетический
уровень состоит только из s- и р- подуровней:
↑ |
↑ |
↑ |
↑↓ |
 :
:

Валентные
возможности атома азота ограничиваются
тремя не спаренными p-электронами,
которые с тремя атомами фтора могут
образовать только соединение азота
трифторид
 .
.
Фосфор находится в III периоде, следовательно, его внешний энергетический уровень состоит из s-, p- и d- подуровней:
|
|
|
|
|
↑ |
↑ |
↑ |
↑↓ |
 :
:

3s2 3p3 3d0
↑ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
При
возбуждении атома фосфора возможен
переход одного 3s-электрона
на 3d-подуровень,
при этом валентность фосфора становится
равной пяти: Р*
 .
Он её и проявляет в соединении фосфора
пентафторид
:
.
Он её и проявляет в соединении фосфора
пентафторид
:
4.
Определите. какие σ- и π- связи образуются
в молекулах этилена
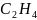 и ацетилена
и ацетилена
 .
Выясните, как это влияет на пространственное
строение и химические свойства молекул.
.
Выясните, как это влияет на пространственное
строение и химические свойства молекул.
Решение.
Уникальность бесчисленного множества
соединений, в которых участвует атом
углерода, заключается в его возможности
образовывать различные типы связей
четырьмя своими валентными
 -
и
-
и
 -
электронами. При этом для углерода, в
зависимости от партнеров по связям,
возможны три типа гибридизации электронных
орбиталей:
-
электронами. При этом для углерода, в
зависимости от партнеров по связям,
возможны три типа гибридизации электронных
орбиталей:
 -
,
-
и
-
гибридизация.
-
,
-
и
-
гибридизация.
Рассмотрим,
например, химические связи в молекуле
этилена
.
Анализ возможных вариантов образования
связей в данной молекуле показывает,
что наибольшее перекрывание орбиталей,
а, следовательно, формирование системы
с наименьшей потенциальной энергией,
возникает, когда одна s-орбиталь и две
p-орбитали
атомов углерода образуют три
-
гибридные орбитали, а третья p-орбиталь
остаётся «чистой». Как показано на Рис.3
(а), при
-
гибридизации электронные орбитали
каждого из двух атомов углерода
располагаются в одной плоскости под
углом 1200
друг к другу. Эти гибридные орбитали
образуют пять σ-связей: одну связь
 и четыре связи
и четыре связи
 ,
которые лежат в одной плоскости под
углами 1200
друг к другу.
,
которые лежат в одной плоскости под
углами 1200
друг к другу.
Экспериментальное исследование показывает, что молекула этилена действительно имеет плоскостное строение. Очевидно, что оставшиеся негибридизированными - орбитали атомов углерода образуют между собой π- связь. Для выполнения условия максимальной удаленности орбиталей друг от друга π- связь располагается в плоскости, перпендикулярной σ-взаимодействию.

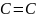 неодинаковы. Этим и объясняются
особенности двойной связи в органических
соединениях. Ввиду меньшей прочности
π- связи по сравнению с σ- связью энергия
двойной связи
меньше удвоенного значения энергии
одинарной связи
.
неодинаковы. Этим и объясняются
особенности двойной связи в органических
соединениях. Ввиду меньшей прочности
π- связи по сравнению с σ- связью энергия
двойной связи
меньше удвоенного значения энергии
одинарной связи
.
Рис.3. Схема пространственного строения молекул этилена (а) и ацетилена (б).
Вот почему последующее образование из двойной связи двух одинарных σ- связей приводит к выигрышу энергии, что объясняет ненасыщенный характер органических соединений с двойной связью и их высокую реакционную способность.
В
молекуле ацетилена
или
 только два электрона углеродного атома
образуют гибридные орбитали – происходит
-
гибридизация. Две
- гибридные орбитали располагаются под
углом 1800
друг к другу (см. Рис.3, б). Эти орбитали
образуют две σ-связи: одна между атомами
углерода и вторая связь
.
только два электрона углеродного атома
образуют гибридные орбитали – происходит
-
гибридизация. Две
- гибридные орбитали располагаются под
углом 1800
друг к другу (см. Рис.3, б). Эти орбитали
образуют две σ-связи: одна между атомами
углерода и вторая связь
.
Молекула ацетилена имеет линейное строение. Две негибридизированные - и - орбитали у каждого из атомов углерода располагаются под углом 900 друг к другу. Эти орбитали образуют две π-связи, электронные орбитали которых располагаются во взаимно и относительно σ-взаимодействия перпендикулярных плоскостях.
Тройная
связь
 в молекуле ацетилена еще более
ненасыщенная, чем двойная связь
в молекуле этилена, а поэтому ацетилен
проявляет большую химическую активность,
чем этилен.
в молекуле ацетилена еще более
ненасыщенная, чем двойная связь
в молекуле этилена, а поэтому ацетилен
проявляет большую химическую активность,
чем этилен.
5.
Объясните механизм образования молекулы
 [
[ ]
с позиций метода валентных связей.
Выясните, может ли подобное соединение
образовать атом углерода.
]
с позиций метода валентных связей.
Выясните, может ли подобное соединение
образовать атом углерода.
Решение. Химизм процесса образования комплексного соединения водорода гексафторосиликата легко представить в виде реакции:
 +
+ 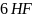 =
[
] +
=
[
] +  ↑.
↑.
Для
выяснения механизма образования связей
в полученном комплексном соединении
представим, что в действительности
окисление кремния реализуется в две
стадии: через образование промежуточного
соединения – кремния тетрафторида
 по реакции
по реакции
+  =
=  +
↑,
+
↑,
с последующим присоединением к двум молекулам фтороводорода:
+  =
[
].
=
[
].
В
основном состоянии атом кремния имеет
электронную конфигурацию
 :
:
 .
Графическая схема внешнего валентного
уровня свидетельствует о наличии в
атоме Si двух не спаренных электронов и
6 вакантных орбиталей:
.
Графическая схема внешнего валентного
уровня свидетельствует о наличии в
атоме Si двух не спаренных электронов и
6 вакантных орбиталей:
-
↑↓
↑
↑



При
возбуждении атом кремния переходит в
состояние Si*:…
 (
-гибридизация)
и графическая схема его валентного
состояния становится иной:
(
-гибридизация)
и графическая схема его валентного
состояния становится иной:
↑ |
↑ |
↑ |
↑ |
|
|
|
|
|
Четыре
не спаренных электрона возбужденного
атома кремния, как более электроотрицательного,
оттягивают на себя валентные
 -электроны
4-х атомов фтора, образуя с ними 4
ковалентные связи по обменному механизму
(так образуется молекула
).
На вакантные места в структуре внешнего
валентного уровня кремния могут быть
приняты электронные пары связанных (в
линейной молекуле
-электроны
4-х атомов фтора, образуя с ними 4
ковалентные связи по обменному механизму
(так образуется молекула
).
На вакантные места в структуре внешнего
валентного уровня кремния могут быть
приняты электронные пары связанных (в
линейной молекуле
 )
атомов фтора (их электронное строение
соответствует формуле
)
атомов фтора (их электронное строение
соответствует формуле
 )
по донорно-акцепторному механизму.
Теоретически таких пар могло бы быть
четыре, однако в силу пространственной
ограниченности вблизи атома кремния
может разместиться не более 6 атомов
фтора. Вот почему на вакантные гибридные
q-орбитали
атома кремния переходят две
)
по донорно-акцепторному механизму.
Теоретически таких пар могло бы быть
четыре, однако в силу пространственной
ограниченности вблизи атома кремния
может разместиться не более 6 атомов
фтора. Вот почему на вакантные гибридные
q-орбитали
атома кремния переходят две
 -пары
электронов двух связанных в полярных
молекулах
атомов фтора, образуя комплексную
молекулу
[
],
в которой электронные пары 6 ковалентных
связей кремния располагаются в
пространстве тетрагональной бипирамиды
(
-пары
электронов двух связанных в полярных
молекулах
атомов фтора, образуя комплексную
молекулу
[
],
в которой электронные пары 6 ковалентных
связей кремния располагаются в
пространстве тетрагональной бипирамиды
( – гибридизация), как представлено на
следующей схеме (Рис. 4).
– гибридизация), как представлено на
следующей схеме (Рис. 4).
Что
же касается атома углерода ( ),
то он может, также как и кремний, вступать
в реакцию окисления с образованием в
молекуле
),
то он может, также как и кремний, вступать
в реакцию окисления с образованием в
молекуле
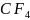 четырех
ковалентных связей по обменному
механизму. Но при этом валентные
возможности углерода будут исчерпаны,
так как на его валентном уровне не
остаётся ни не спаренных электронов,
ни вакантных орбиталей. Следовательно,
дальнейшая реакция присоединения для
молекулы
становится
невозможной.
четырех
ковалентных связей по обменному
механизму. Но при этом валентные
возможности углерода будут исчерпаны,
так как на его валентном уровне не
остаётся ни не спаренных электронов,
ни вакантных орбиталей. Следовательно,
дальнейшая реакция присоединения для
молекулы
становится
невозможной.




● ●






○ ● ○ ● ○
● ●
Рис. 4. Схема размещения ядер взаимодействующих атомов в молекуле [ ].
Пример 3. Описание химической связи методом молекулярных орбиталей
1.
С позиций метода молекулярных орбиталей
обоснуйте существование молекулы
 и невозможность образования молекулы
и невозможность образования молекулы
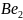 .
.
Решение.
Литий и бериллий – элементы II-го периода
Периодической системы элементов Д. И.
Менделеева. Валентными орбиталями для
них являются по одной 2s- и по три 2p-атомных
орбитали (АО). Следовательно, в двухатомных
молекулах
и
 должно образоваться по восемь молекулярных
орбиталей (МО), из которых четыре являются
связывающими (
должно образоваться по восемь молекулярных
орбиталей (МО), из которых четыре являются
связывающими ( )
и четыре – анти связывающими или
разрыхляющими (МО*), причем, одинаковых
для обеих молекул (см. Рис. 5). Отличие
состоит в числе электронов на этих МО.
)
и четыре – анти связывающими или
разрыхляющими (МО*), причем, одинаковых
для обеих молекул (см. Рис. 5). Отличие
состоит в числе электронов на этих МО.
Электроны
внутреннего невалентного уровня 1s
между
собой не взаимодействуют и переходят
в состав молекулы в виде молекулярных
орбиталей не связывающих ( или
или
 ).
).
 Заметим
также, что некоторые авторы отмечают
для молекул, образованных атомами конца
II-го
периода (начиная от азота), расположение
Заметим
также, что некоторые авторы отмечают
для молекул, образованных атомами конца
II-го
периода (начиная от азота), расположение
 -
МО ниже π
–
МО, объясняя это большей прочностью σ-
связи.
-
МО ниже π
–
МО, объясняя это большей прочностью σ-
связи.
Таким образом, число МО всегда равно числу исходных АО, сколько бы их ни было. И количество электронов, размещающихся на МО, всегда равно количеству исходных электронов на АО.









Е  Е
Е




 π*y π*z
π*y π*z









 2p
2р
2p
2р
 pz
py
px
px
py
pz
pz
py
px
px
py
pz

 πy
πz
πy
πz






 2s
σ*2s
2s
2s
σ*2s
2s

 1s
1s
 1s
1s


АО МО АО
Рис. 5. Энергетическая диаграмма расположения МО двухатомных молекул II-го периода.
Можно предположить, что молекула образуется в результате взаимодействия двух атомов лития согласно последовательности (9) по следующей схеме:
 +
→
[2(
+
→
[2( (
( ].
].
Как
видим, в молекуле
четыре электрона с 1s-АО от двух атомов
лития образуют две не связывающие
молекулярные орбитали
 ,
их, как правило, можно не указывать в
формулах. Два электрона с 2s-АО займут
–
(Рис.6, а), энергия которой становится
меньше энергии всех
,
их, как правило, можно не указывать в
формулах. Два электрона с 2s-АО займут
–
(Рис.6, а), энергия которой становится
меньше энергии всех
 .
В молекуле формируется одинарная связь
(порядок связи, согласно формуле 10, n
=
.
В молекуле формируется одинарная связь
(порядок связи, согласно формуле 10, n
=
 =
1), она осуществляется одной парой
электронов.
=
1), она осуществляется одной парой
электронов.
В атоме бериллия на втором энергетическом уровне располагаются два 2s электрона в одной энергетической ячейке, они спаренные. Схема образования молекулы имеет вид:
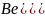 )
+
)
+
 )
→
[2(
(
)
→
[2(
( (
( ].
].
При
образовании этой молекулы четыре
электрона с 2s-АО двух атомов бериллия
занимают две МО – связывающую и анти
связывающую – σ2s
и σ*2s
(Рис. 6, б). В гипотетической молекуле
число электронов на связывающей и анти
связывающей молекулярных орбиталях
одинаково. Это означает, что выигрыш в
энергии от перехода электронов с 2s-АО
на σ2s-МО
полностью компенсируется проигрышем
от перехода еще двух 2s-электронов с АО
на σ*2s-МО,
изменение энергии системы равно нулю,
связь не образуется. Об этом же
свидетельствует и расчет порядка связи
в
:
n =
 =
0.
=
0.



 Е
Е

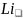 E E
E E
 E
E



 ●●
●●








 2s
● ● 2s 2s ●● ●● 2s
2s
● ● 2s 2s ●● ●● 2s




 1s
●● ●● ●● ●●
1s
1s ●● ●● ●● ●● 1s
1s
●● ●● ●● ●●
1s
1s ●● ●● ●● ●● 1s

σ2s ●● ●● σ2s
АО МО АО АО МО АО
а) б)
Рис. 6. Энергетические диаграммы молекулы лития (а) и несуществующей молекулы бериллия (б).
Поскольку на 2р-подуровнях нет электронов, то эта часть диаграмм на рисунке не обозначена.
Как видим, двухатомные молекулы щелочных металлов существуют (при высокой температуре в парах), а двухатомные молекулы щелочноземельных металлов не образуются.
2.
В ряду
 -
-
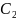 -
-
 выберите частицу с наибольшей энергией
связи. Обоснуйте ваш выбор.
выберите частицу с наибольшей энергией
связи. Обоснуйте ваш выбор.
Решение.
Молекула
образуется в результате взаимодействия
АО двух атомов углерода, имеющих
электронное строение
 ).
).
При
этом следует учесть два момента.
Во-первых, два подуровня 2s
, как и 2 подуровня 1s
от двух атомов углерода образуют 4 не
связывающие МО
 .
Во-вторых, на подуровне 2р в атомах С
орбиталь
остается вакантной, заняты неспаренными
электронами орбитали
.
Во-вторых, на подуровне 2р в атомах С
орбиталь
остается вакантной, заняты неспаренными
электронами орбитали
 и
и
 ,
которые при взаимодействии образуют
связывающие МО
,
которые при взаимодействии образуют
связывающие МО
 и
и
 с двумя парами электронов. Следовательно,
схема образования двухатомной молекулы
углерода
будет следующей:
с двумя парами электронов. Следовательно,
схема образования двухатомной молекулы
углерода
будет следующей:
)
+
)
→
 [2(
[2( (
( (
( (
(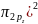 ].
].
По
аналогии, для образования частицы
необходим атом углерода и ион
 ,
лишенный электрона с подуровня
.
Теперь при размещении трех валентных
электронов на 3-х связывающих МО вероятнее
всего реализация варианта по одному
электрону с параллельными спинами на
каждой
(правило Хунда). Схема взаимодействия
С и С+
будет такая:
,
лишенный электрона с подуровня
.
Теперь при размещении трех валентных
электронов на 3-х связывающих МО вероятнее
всего реализация варианта по одному
электрону с параллельными спинами на
каждой
(правило Хунда). Схема взаимодействия
С и С+
будет такая:
)
+ C+ )→
)→
 [2(
(
(
[2(
(
( )(
)( )(
)( )].
)].
Для
образования частицы
потребуется атом углерода и ион
 ,
у которого занят неспаренными электронами
весь 2р подуровень. Размещение 5 валентных
электронов на 3-х связывающих МО также
соответствует правилу Хунда, а поэтому
схема образования отрицательного иона
будет следующей:
,
у которого занят неспаренными электронами
весь 2р подуровень. Размещение 5 валентных
электронов на 3-х связывающих МО также
соответствует правилу Хунда, а поэтому
схема образования отрицательного иона
будет следующей:
)+
 )→
)→
 [2(
(
[2(
( (
)].
(
)].
Энергетические диаграммы образования молекулы и частиц и представлены на Рис.7, а, б, в. Как видно из Рис.7, а, в молекуле на связывающих орбиталях размещены шесть электронов, а на разрыхляющих – два. Следовательно, порядок связи в двухатомной молекуле углерода , равен 2:
(n
=
 ).
).
В
ионной частице
(Рис. 15, б) на связывающих орбиталях
размещены пять электронов, а на
разрыхляющих – по-прежнему два. Порядок
связи в этой ионной частице уменьшается:
n
=
 = 1,5.
= 1,5.



 E σ
E σ С2 E
С2 E
 С
С
С
С




π π
π











 2p
● ● ● ● 2p
2p
● ● ● ● 2p
 pz
py
px
рх
ру
рz
pz
py
px
рх
ру
рz



 2s
●●
2s
●●
 ●●
●●
●● 2s
●●
●●
●● 2s


 1s
●● σ01s●●
●● σ01s
●● 1s
1s
●● σ01s●●
●● σ01s
●● 1s


 ●●
●●
●●
●●
АО MO АО
а)
Рис. 7, а. Энергетическая диаграмма образования молекулы .
 E
E
 С2+ E
С2+ E





 С
π
С
π π
π






 2p
● ● ● 2p
2p
● ● ● 2p
pz py px px py pz


 2s
●● σ02s
●● ●● σ02s
●● 2s
2s
●● σ02s
●● ●● σ02s
●● 2s




 1s
●● σ01s
●● ●● σ01s
●● 1s
1s
●● σ01s
●● ●● σ01s
●● 1s
 ●
●


 ● ●
● ●
АО МО АО
б)
Рис. 7, б. Энергетическая диаграмма образования иона

E σ*x E


 С
π
π
С
π
π










 2p
● ● ● ● ● 2p
2p
● ● ● ● ● 2p
pz py px px py pz


 2s
●● σ02s
●●
●●
σ02s
●●
2s
2s
●● σ02s
●●
●●
σ02s
●●
2s



 1s
●● σ01s
●● ●● σ01s
●● 1s
1s
●● σ01s
●● ●● σ01s
●● 1s
 ●
●

 ●● ●●
●● ●●
АО МО АО
в)
Рис. 7, в. Энергетическая диаграмма образования иона .
В
ионной частице С2-
(Рис. 7, в) на связывающих орбиталях
размещаются семь электронов, а на
разрыхляющих остаются два. Порядок
связи в этой частице выше, чем в молекуле
С2:
n =  = 2,5.
= 2,5.
Таким
образом, ионная частица
,
характеризующаяся более высоким порядком
связи между атомами, является более
прочной. А это, в свою очередь, означает,
что в ряду
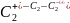 наибольшей
энергией связи обладает отрицательный
ион
,
а наименьшей - положительный ион
.
наибольшей
энергией связи обладает отрицательный
ион
,
а наименьшей - положительный ион
.
Учитывая наличие неспаренных электронов на связывающих орбиталях в ионных частицах и , следует предположить проявление ими парамагнитных свойств (способность притягиваться магнитным полем), в отличие от молекулы , которая, не имея не спаренных электронов, выталкивается магнитным полем, т. е. является диамагнетиком.
Ответ: в ряду наибольшей энергией связи обладает отрицательная парамагнитная частица .
3.
Определите порядок и полярность связи
в молекуле
 ,
если энергия ионизации атома лития
составляет 0,52 эВ, а фтора – 17,42 эВ.
,
если энергия ионизации атома лития
составляет 0,52 эВ, а фтора – 17,42 эВ.
Решение. При выборе положения уровней энергии взаимодействующих атомных орбиталей на оси АО энергетической диаграммы следует помнить, что чем легче оторвать электрон от атома (ионизация), т.е. чем ниже ионизационный потенциал, тем выше располагаются соответствующие АО на оси энергий. Поскольку энергия ионизации атома фтора значительно больше энергии ионизации атома лития, то это означает, что валентные 2р-орбитали фтора отвечают меньшему уровню энергии, чем валентные 2s-и 2р-орбитали лития. Рис.8 отражает эту разницу в энергиях на осях АО лития и фтора.
В отличие от гомоядерных молекул в гетероядерных молекулах связывающие МО располагаются ближе к АО того атома, у которого они ниже. Появляется асимметрия в распределении электронной плотности между ядрами, что поляризует молекулу. Особенно ярко это проявляется у соединений металлов с неметаллами, как в нашем примере.
Вследствие значительной разницы в энергиях между собой не комбинируются 2s-AO лития и 2s-AO фтора, а также 2р-АО и 2р-АО . Из-за различной симметрии относительно оси связи орбитали 2py и 2pz атома фтора также не комбинируются с 2s-орбиталью атома лития. В результате 2s-, 2py- и 2pz-орбитали фтора переходят без изменений в молекулу , превращаясь в несвязывающие молекулярные орбитали (σ0 и π0), такие же, как и две несвязывающие орбитали уровней 1s-АО лития и фтора. Молекулярные орбитали связывающие σsр и антисвязывающие σ*sр образуются из 2s-орбитали лития и 2pх-орбитали фтора (см. Рис.8). Схема их взаимодействия может быть представлена следующим образом:
 Li
LiF
F
Li
LiF
F
E E

 2p σ*sp
2p σ*sp
pz py px
 2s
●
2s
●

 1s
●● ●●
1s
●● ●●

 ●● ●● ● ●● ●● 2p
●● ●● ● ●● ●● 2p


●● ●● 2s
 ●●
●● 1s
●●
●● 1s
●●
σsp
АО МО АО
Рис. 8. Энергетическая диаграмма молекулы LiF.
( )
+
(
)
+
( )
→
[
)
→
[ ]
]
Из Рис.8 видно, что МО связывающая располагается ближе к АО фтора и она стала практически принадлежать этому ядру. В поле действия ядра оказались также 4 МО несвязывающие с 8-ю электронами. Оба указанных фактора привели к появлению отрицательного заряда на атоме фтора и положительного - на атоме лития, что свидетельствует об образовании ионной связи.
Этот
вывод согласуется с разностью
электроотрицательностей фтора и лития:
 = 4,0;
= 4,0;
 = 1,0; ΔЭОLi-F
=
3,0, характеризующей ионный тип связи
(значения ЭО приведены в Приложении 3),
и с величиной порядка связи в соединении:
n =
=
1.
= 1,0; ΔЭОLi-F
=
3,0, характеризующей ионный тип связи
(значения ЭО приведены в Приложении 3),
и с величиной порядка связи в соединении:
n =
=
1.
Правда, надо заметить, что молекулярное строение возможно только в парообразном состоянии, а в конденсированной форме (твердой или жидкой) кристаллическая структура ионного соединения имеет немолекулярное строение.
Ответ: в молекуле ионный тип связи, порядок связи n = 1.
Составьте энергетическую диаграмму молекулы воды , предскажите её полярные и магнитные свойства, а также пространственное строение.
Решение. Для построения энергетической диаграммы многоатомной (содержащей больше двух атомов) молекулы необходимо вначале уяснить, какой из атомов в ней является центральным, так как именно с него начинается построение диаграммы. Для этого атома выделяется одна энергетическая ось (удобнее, чтобы она располагалась слева), а энергетические диаграммы других атомов (их называют лигандами) объединяются на второй (правой) оси.
Для нашего случая центральным атомом в молекуле воды будет, понятно, атом кислорода, а лиганды – два атома водорода. На Рис. 9 показано расположение электронов на первом и втором энергетических уровнях атома кислорода и единственном первом энергетическом уровне двух атомов водорода на осях АО.
На энергетической оси атома кислорода отмечены все его АО, а не только валентные. Но внимание! Все 2р-АО у атома кислорода одинаковые, однако, в целях экономии места на рисунке они изображены на разных уровнях и объединены фигурной скобкой (такая скобка является стандартным обозначением одинаковости АО). На правой оси отмечены энергии двух АО двух атомов водорода, тоже одинаковых по величине Е.
А откуда мы знаем, что энергии1s-AO атомов водорода и 2р-АО атома кислорода одинаковые? На это нам указывают значения энергии ионизации этих атомов:
 =
13,6 эВ;
=
13,6 эВ;
 = 13,62 эВ (см. таблицу Приложения № 3).
= 13,62 эВ (см. таблицу Приложения № 3).

 О Н2О
2Н
О Н2О
2Н
Е Е
σs*




σp*



 ●
●
1s
●
●
1s

 2p
● ● 1s
2p
● ● 1s
●● ●● πop
 2s
●● ●● σos
2s
●● ●● σos
1s ●● ●● σоs
●●
 ●● σp
●● σp
АО МО АО
Рис. 9. Энергетическая диаграмма молекулы воды.
Теперь приступим к построению энергетической диаграммы молекулярных орбиталей. Обращаем внимание на то, что в образовании связей между атомом кислорода и двумя атомами водорода принимают участие пять валентных АО, занятые 6-ю электронами (три АО и 4 ē атома кислорода и две АО с 2 ē двух атомов водорода). Не забываем также, что две АО от атома кислорода с 4-я электронами, а именно 1s2 и 2s2, в образовании связей не участвует из-за значительного расхождения в энергии с 1s-орбиталью атомов водорода и переходят в состав молекулы в виде несвязывающих МО и .
Поскольку вступают во взаимодействие 5 валентных АО, то должно получиться и 5 МО. Запомним, что число связывающих МО всегда определяется по числу атомных орбиталей того партнера, у которого их меньше. Таковыми выступают атомы водорода. Следовательно, в молекуле Н2О образуются две связывающие МО и, учитывая их энергетическую последовательность, такими орбиталями будут σ1s2px и σ1s2py (на рис.9 они отмечены как σs и σр). Соответственно числу связывающих МО число антисвязывающих или разрыхляющих МО также равно двум, это σ*1s2px и σ*1s2py (на Рис.9 они отмечены как σ*s и σ*р).
Поскольку
для оставшихся валентных 2pz-АО
атома кислорода партнёров больше нет,
то эти орбитали также как орбитали 1s и
2s,
перейдут в молекулу воды в виде
несвязывающей МО -
 (на Рис.9 она отмечена как МО
(на Рис.9 она отмечена как МО
 ).
По диаграмме видно, что все несвязывающие
МО находятся между связывающими и
антисвязывающими МО, т.е. не дают вклада
в энергию связи, отсюда их название.
Образование молекулы воды может быть
представлено следующим уравнением:
).
По диаграмме видно, что все несвязывающие
МО находятся между связывающими и
антисвязывающими МО, т.е. не дают вклада
в энергию связи, отсюда их название.
Образование молекулы воды может быть
представлено следующим уравнением:
О
(1s22s22p4)
+ 2H
(1s2)
→ H2O
[( (
( (
(
)2
(
(
(
)2
( ].
].
Порядок
связи в молекуле
определяется по формуле (10): n =  = 2.
Поскольку в молекуле отсутствуют МО с
неспаренными электронами, то такая
молекула будет диамагнитной (выталкивается
из магнитного поля).
= 2.
Поскольку в молекуле отсутствуют МО с
неспаренными электронами, то такая
молекула будет диамагнитной (выталкивается
из магнитного поля).
Диаграмма
на Рис. 9 позволяет нам сделать вывод о
полярности молекулы воды (смещение
электронной плотности к атому кислорода)
и предсказать пространственное строение
молекулы. О смещении электронной
плотности в молекуле можно судить по
разности электроотрицательностей
атомов кислорода и водорода (см. Приложение
№ 3):
 = 3,5;
= 3,5;
 = 2,1;
ΔЭ
= 2,1;
ΔЭ = 1,4,
что свидетельствует о наличии в молекуле
двух ковалентных полярных связей.
= 1,4,
что свидетельствует о наличии в молекуле
двух ковалентных полярных связей.
В молекуле воды имеется четыре максимума электронной плотности (4 занятых электронами МО) на внешнем 2-м энергетическом уровне, но из них только две МОсвяз и две МОнесвяз. В силу неодинаковости электронных орбиталей молекула воды имеет не тетрэдрическое пространственное строение, а пирамидальное с искаженными углами между ядрами (искаженная треугольная пирамида с ядром атома кислорода в центре).
Ответ: молекула воды полярная, диамагнитная, пространственное строение – неправильная треугольная пирамида с ядром атома кислорода в её центре.
