
- •Самостоятельная работа № 8
- •§ 1. Обучающие примеры с алгоритмами решения по теме «Квантовая теория химической связи» Пример 1. Определение основных характеристик химической связи
- •Пример 2. Описание химической связи методом валентных связей
- •Пример 4. Свойства химической связи
- •§ 2. Домашнее задание для закрепления темы «Квантовая теория
- •Приложения Приложение №1. Значения энергии связи между различными атомами ( ) в молекулах при температуре 298 к.
- •Приложение № 2. Значения длины химической связи ( ) между отдельными атомами в молекуле
- •Приложение № 3. Значения величин относительных электроотрицательностей (эо) и первых потенциалов ионизации ( , эВ)
Самостоятельная работа № 8
§ 1. Обучающие примеры с алгоритмами решения по теме «Квантовая теория химической связи» Пример 1. Определение основных характеристик химической связи
1. Ковалентные радиусы атомов брома и водорода равны, соответственно, 1,14·10-10 м и 0,30·10-10 м. Определите длину химической связи в молекулах брома и бромоводорода.
Решение.
Поскольку длиной связи
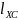 (м)
называют расстояние между ядрами в
химическом соединении и для двухатомной
молекулы
(м)
называют расстояние между ядрами в
химическом соединении и для двухатомной
молекулы
 или АВ
равна приближенно сумме атомных радиусов
взаимодействующих атомов, то для молекулы
или АВ
равна приближенно сумме атомных радиусов
взаимодействующих атомов, то для молекулы
 длина химической связи
длина химической связи
 Br-Вr
=
Br-Вr
=
 =
=
 м =
м =
 м.
Для молекулы HBr длина химической связи
равна
м.
Для молекулы HBr длина химической связи
равна
Н-Вr
=
 =
=
 = 1,44·10-10
(м).
= 1,44·10-10
(м).
Ответ: ℓBr-Вr = 2,28·10-10 м, ℓН-Вr = 1,44·10-10 м.
2.
Дипольные моменты молекул
 и
и
 равны соответственно 1,45D и 1,84D. Вычислите
длину диполя каждой из этих молекул и
определите, в какой из них связь наиболее
полярная.
равны соответственно 1,45D и 1,84D. Вычислите
длину диполя каждой из этих молекул и
определите, в какой из них связь наиболее
полярная.
Решение.
Электрический момент диполя ( )
служит мерой полярности связи и он равен
произведению эффективного заряда |δ|
диполя на длину диполя (
)
служит мерой полярности связи и он равен
произведению эффективного заряда |δ|
диполя на длину диполя ( ):
):
= |δ|· . (1)
В этом выражении величина эффективного заряда диполя |δ| приравнивается к заряду электрона, т.е. |δ| = 1,6·10-19 Кл, электрические моменты диполей ( ), равны соответственно
 =
1,45D = 1,45·
=
1,45D = 1,45·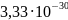 Кл·м = 4,83·10-30
Кл·м;
Кл·м = 4,83·10-30
Кл·м;
 =
1,84D = 1,84·3,33·10-30
Кл·м = 6,13·10-30
Кл·м.
=
1,84D = 1,84·3,33·10-30
Кл·м = 6,13·10-30
Кл·м.
Преобразовав формулу (1) относительно длины диполя, получим:
∂(NH3)
=
 =
=
 =
=
 м;
м;
ℓ∂(Н2О)
=
 =
=
 =
=
 м.
м.
Согласно теории химической связи, в молекуле с бóльшим значением длины диполя полярность связи будет выше. Сравнив значения ℓ∂(NH3) и ℓ∂(Н2О), приходим к выводу, что наиболее полярной является молекула воды.
Ответ: ℓ∂(NH3) = м; ℓ∂(Н2О) = м. Более полярной является молекула воды.
3.
Энергия химической связи в молекуле
хлора составляет 243 кДж/моль, а в молекуле
фтора – 159 кДж/моль. Объясните причину
большей прочности молекулы
 ,
несмотря на то, что размер её атомов
больше, чем в молекуле
,
несмотря на то, что размер её атомов
больше, чем в молекуле
 .
.
Решение.
Сравнивая длину химической связи в
молекулах фтора
и хлора
(Приложение №1), мы видим, что
Cl-Cl
=
 м больше ℓF-F
=
м больше ℓF-F
=
 м. Логично предположить, что чем длиннее
связь, тем она менее прочная. Однако,
анализируя механизм образования
ковалентной неполярной связи в молекулах
фтора и хлора, можно заметить существенные
отличия.
м. Логично предположить, что чем длиннее
связь, тем она менее прочная. Однако,
анализируя механизм образования
ковалентной неполярной связи в молекулах
фтора и хлора, можно заметить существенные
отличия.
Образование
молекул фтора
и хлора C из атомов
из атомов
 и
и
 с учетом электронной структуры каждого
атома [
:
с учетом электронной структуры каждого
атома [
:
 ]
и [
]
и [ :
:
 ]
по уравнениям
]
по уравнениям
+ = и + =
происходит
по-разному. Имея на внешнем валентном
уровне по одному не спаренному
 -электрону,
два атома фтора объединяют их по
обменному механизму
с образованием ковалентной неполярной
σ-связи (см. Рис. 1):
-электрону,
два атома фтора объединяют их по
обменному механизму
с образованием ковалентной неполярной
σ-связи (см. Рис. 1):








+
 [ ]
[ ]
Рис.1. Схема образования σ-связи в молекуле фтора по обменному механизму.
 Взаимодействие
двух атомов хлора, обладающих не
спаренными
Взаимодействие
двух атомов хлора, обладающих не
спаренными
 -электронами
и вакантными d-орбиталями на 3-ем
энергетическом уровне, происходит по
дативному механизму
таким образом, что при этом создается
не одна ковалентная неполярная связь,
а три. Два атома хлора в молекуле
образуют
(Рис. 2) одну ковалентную связь по обменному
механизму, объединяя не спаренные
-электронами
и вакантными d-орбиталями на 3-ем
энергетическом уровне, происходит по
дативному механизму
таким образом, что при этом создается
не одна ковалентная неполярная связь,
а три. Два атома хлора в молекуле
образуют
(Рис. 2) одну ковалентную связь по обменному
механизму, объединяя не спаренные
 электроны (σ-связь); и две донорно-акцепторные
связи, отдавая один другому по электронной
3р паре и вакантной 3d
орбитали ( 2 π –связи):
электроны (σ-связь); и две донорно-акцепторные
связи, отдавая один другому по электронной
3р паре и вакантной 3d
орбитали ( 2 π –связи):
Рис. 2. Схема перекрывания р-электронов и d-орбиталей атомов хлора при образовании связей по дативному механизму.
Действие дативного механизма приводит к увеличению прочности связи. Поэтому молекула является более прочной, чем молекула , в которой ковалентная связь образуется только по обменному механизму.
Ответ: Вследствие разных механизмов образования ковалентной неполярной связи молекула хлора обладает большей энергией связи, чем молекула фтора.
4.
Определите энергию связи кислород-водород
ЕО-Н
в
молекуле
 ,
если энергии связей водород-водород и
кислород-кислород соответственно равны
ЕН-Н = - 435,9
и ЕО-О = - 498,7 кДж/моль,
а при сгорании 1 моля водорода выделяется
241,8 кДж теплоты.
,
если энергии связей водород-водород и
кислород-кислород соответственно равны
ЕН-Н = - 435,9
и ЕО-О = - 498,7 кДж/моль,
а при сгорании 1 моля водорода выделяется
241,8 кДж теплоты.
Решение. Используя условия задачи, можно записать такие уравнения процессов:
Н + Н = Н2; ЕН-Н = - 435,9 кДж/моль, (1)
О + О = О2; ЕО-О = - 498,7 кДж/моль. (2)
В свою очередь, энергия химической связи ЕО-Н, в реакции синтеза воды из атомов
2Н + О = Н2О,
( =
?) (3)
=
?) (3)
будет
равна половине энергии образования
молекулы воды ЕО-Н = 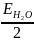 .
.
Для
определения энергии образования молекулы
воды ( О)
используем энергию сгорания газообразного
водорода. Горение, как известно,
представляет собой процесс взаимодействия
вещества с кислородом. В данном случае
речь идет о реакции
О)
используем энергию сгорания газообразного
водорода. Горение, как известно,
представляет собой процесс взаимодействия
вещества с кислородом. В данном случае
речь идет о реакции
Н2 + ½О2 = Н2О; Есгор = - 241,8 кДж/моль (4).
Примечание: мы имеем право использовать в этом уравнении дробный коэффициент, т.к. по условию задачи в реакции горения участвует 1моль Н2.
Сравнивая между собой уравнения (1), (2), (3) и (4), легко убедиться, что искомое уравнение (3) можно получить сложением уравнений (1), (2) и (4), предварительно умножив уравнение (2) на коэффициент ½. Ту же операцию можно проделать и со значениями энергии, указанными в этих уравнениях. Тогда получим следующее выражение:
О = ЕН-Н + ½ ЕО-О + Есгор.
Подставив значения энергий и произведя расчеты, найдем энергию образования молекулы воды из двух атомов водорода и одного атома кислорода по уравнению (3):
О = [(- 435,9) + ½(- 498,7) + (- 241,8)] кДж/моль = - 927,1 кДж/моль.
Тогда энергия химической связи ЕО-Н определится как
ЕО-Н =
= -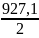 = - 463,6 (кДж/моль).
= - 463,6 (кДж/моль).
Ответ: энергия химической связи ЕО-Н = - 463,6 кДж/моль.
5.Энергия
диссоциации молекулы азота на отдельные
атомы равна 225 ккал/моль. Определите
среднее значение энергии связи
 в расчете на одну связь в эВ/связь.
в расчете на одну связь в эВ/связь.
Решение.
Как известно, в молекуле азота три
электронные пары образуют тройную связь
 .
Очевидно, что усредненное значение
энергии связи
составит ⅓ от энергии тройной связи,
т.е.
.
Очевидно, что усредненное значение
энергии связи
составит ⅓ от энергии тройной связи,
т.е.
 =
⅓
=
⅓ .
(На самом деле в молекуле азота связи
неравноценные: 1σ и 2π связи обладают
разными значениями энергии, но в условии
задачи это не учитывается).
.
(На самом деле в молекуле азота связи
неравноценные: 1σ и 2π связи обладают
разными значениями энергии, но в условии
задачи это не учитывается).
Известно,
что
= -
 ,
и тогда ЕN-N = ⅓(-
).
,
и тогда ЕN-N = ⅓(-
).
Подставим в полученное выражение значение энергии диссоциации молекулы азота на атомы и произведем соответствующие вычисления:
ЕN-N = ⅓(- 225 ккал/моль) = - 75,0 ккал/моль.
Для
перевода полученного значения энергии
в единицы измерения эВ/моль используем
коэффициенты пересчета: 1 ккал = 4,184 кДж
и 1 эВ =  кДж.
кДж.
Следовательно,
ЕN-N = -  эВ/моль = - 19,6∙1023 эВ/моль.
эВ/моль = - 19,6∙1023 эВ/моль.
Так
как в количестве вещества 1 моль азота
содержится число Авогадро молекул
 ,
то в пересчете на одну связь искомое
значение энергии определится из выражения
,
то в пересчете на одну связь искомое
значение энергии определится из выражения
ЕN-N = -  = - 3,26
= - 3,26  .
.
Ответ: ЕN-N = - 3,26 .
