
- •5.Опишите принципиальный подход к клонированию…
- •3.Диагностическое значение определения активности аминотрансфераз в сыворотке крови:
- •3.Диагностическое значение определения активности аминотрансфераз в сыворотке крови:
- •Оценка кислотообразующей функций желудка имеет большое значение при диагностике язвенной болезни, гастрита, злокачественных новообразований и др.
- •Уровни упаковки генетического материала:
- •У детей незаменимыми являются заменимые у взрослых ак: гис и арг. Аргинин:
Уровни упаковки генетического материала:
Нуклеосомный. Нуклеосома состоит из октамера гистонов (содержит 8 молекул гистонов — по два каждого класса, кроме Н1), вокруг этого ядра молекула ДНК делает 1,5–2 оборота.
Соленоидный — обеспечивается гистоном Н1.
Петлевой — в образовании петель принимают участие негистоновые белки.
Уровень метафазной хромосомы — высший уровень спирализации хроматина.
Модификации гистонов (фосфорилирование, ацетилирование) приводят к уменьшению их заряда, в результате чего гистоны легче отсоединяются от ДНК, и она становится доступна ферментам репликации и транскрипции.
Третичная структура — у тРНК формируется самостоятельно и похожа на объемную букву L; у рРНК и иРНК образуется в связи с белками (рРНК+белок = рибосома, иРНК+белок = информосома).
№5
В настоящее время в основе большинства методов ДНК-диагностики лежит полимеразная цепная реакция (ПЦР). Она позволяет быстро получить большое количество копий молекул ДНК (или их фрагментов), достаточное для их даль-нейшего анализа.
Этапы проведения:
нагревание до 90С (денатура-ция ДНК);
добавление праймера и охлаж-дение до 55С (присоединение или «от-жиг» праймера);
добавление нуклеотидов (суб-стратов для синтеза) и ДНК-полимеразы, которая проводит удвоение ДНК; затем цикл повторяется.
Метод широко используется для диагностики инфекционных заболеваний (туберкулез, хламидиоз, цитомегаловирусная инфекция, СПИД и др.). ПЦР позволяет обнаружить возбудителя в биологическом материале даже тогда, когда другие методы оказываются неэффективны. Второе направление использования метода ПЦР — генетическое тестирование (обнаружение мутаций в генах и диагностика наследственной патологии).
№6
Да, нет, нет
Задание:
У детей незаменимыми являются заменимые у взрослых ак: гис и арг. Аргинин:
(ответ писать до образования аргинина)
Роль арг: 1) участвует в синтезе креатина в почках 2) в составе белков аргинин как полярная положительно заряженная аминокислота участвует в образовании ионных связей и в формировании гидратной оболочки белков 3) участник орнитинового цикла мочеобразования
Белки, особенно богатые аргинином: прогамины и гистоны.
Возможные пути использования безазотистых остатков АК - кетокислот в кл:
1) источник энергии (a-кетоглутаровая к-та, ЩУК ® ЦТК)
2) синтез новых АК
3) образование кетогенных тел
4) обезвреживание аммиака (глутаматдегидрогеназная реакция)
Кетокислоты обеспечивают интеграцию метаболизма АК, углеводов и липидов.
Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
3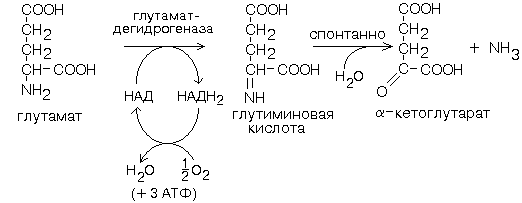 .
.
4.Синтез пуриновых нуклеотидов путем: а) повторного использования готовых азотистых оснований (характерно для размножающихся тканей) б) de novo из низкомолекулярных предшественников (источники N – аспартат, глицин, глутамин, источники С – СО2, глицин, двухуглеродные фрагменты метенил-ТГФК и формил-ТГФК). Синтез пиримидиновых нуклеотидов. Сначала образуется циклическая структура пиримидинового азотистого основания, и только затем присоединяется рибозо-5-фосфат. Источники атомов – СО2, аспартат, глутамин.
Дефицит фолиевой кислоты (витамина В9) может привести к нарушению синтеза пуринов и пиримидинов ® нарушение синтеза НК, процессов репарации.
5.Метод Сэнджера использует дидезоксинуклеотиды для всех четырех нуклеотидов. Есть четыре набора реагентов, каждый из которых содержит все четыре нуклеотида в нормальной дезокси-форме и один из нуклеотидов в дидезокси-форме. Копии одной и той же одноцепочечной ДНК инкубируют в каждом наборе. В каждом из четырех наборов синтез ДНК останавливается по всем соотвествующим сайтам фрагмента ДНК. Электрофорез проводится во всех четырех наборах раздельно. Поскольку длина пути передвижения в геле при электрофорезе зависит от размера молекулы, фрагменты ДНК будут распределяться линейно в соответствии со своим размером. Если взять, например, набор с ддАТФ, то мы увидим, что в образце будут присутствовать фрагменты ДНК, укороченные по каждой из позиций, где в синтезируемой цепи находился аденозин. Некоторые фрагменты, в цепи которых аденозин появляется рано, будут короткими. Другие (аденозин появляется позже в последовательности ДНК) — длиннее. Вы можете определить локализацию аденозина по длине этих фрагментов. Затем можно сравнить данные, полученные после электрофореза в каждом наборе. Так вы определите локализацию каждого нуклеотида в исследуемой последовательности ДНК.
6.
Задание: 1. Для доставки аммиака в периферических тканях образуются транспортные формы аммиака.
Это глутамин и аспарагин.
Глутамин и аспарагин выделяются с мочой в небольшом количестве. Было высказано предположение, что они выполняют скорее транспортную функцию переноса аммиака в нетоксичной форме. Ниже приводится химическая реакция синтеза глутамина, катализируемого глутаминсинтетазой.
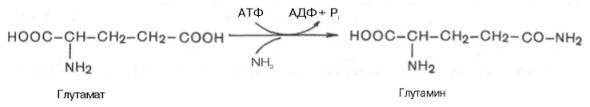
Часть аммиака легко связывается с α-кетоглутаровой кислотой благодаря обратимости глутаматдегидрогеназной реакции. Если учесть связывание одной молекулы аммиака при синтезе глутамина, то нетрудно видеть, что в организме имеется хорошо функционирующая система, связывающая две молекулы аммиака:
![]()
Глутамин, кроме того, используется почками в качестве резервного источника аммиака (образуется из глутамина под действием глутаминазы), необходимого для нейтрализации кислых продуктов обмена при ацидозе и защищающего тем самым организм от потери с мочой используемых для этих целей ионов Na+.
2. Возможные пути использования безазотистых остатков АК - кетокислот в кл:
1) источник энергии (a-кетоглутаровая к-та, ЩУК ® ЦТК)
2) синтез новых АК
3) образование кетогенных тел
4) обезвреживание аммиака (глутаматдегидрогеназная реакция)
Кетокислоты обеспечивают интеграцию метаболизма АК, углеводов и липидов
3. Аллергические реакции нередко сопровождаются падением АД, т.к. гистамин, выделяемый тучными кл, является вазодилятатором.
Пути синтеза серотонина (катализируется декарбоксилазой ароматических АК)
Роль гистамина: 1) участник аллергических реакций 2) сильный вазодилятатор 3) расширяет капилляры и увеличивает сосудистую проницаемость 4) понижает артериальное давление 5) повышает тонус (спазм) гладких мышц (бронхи) 6) усиливает секрецию желудочного сока
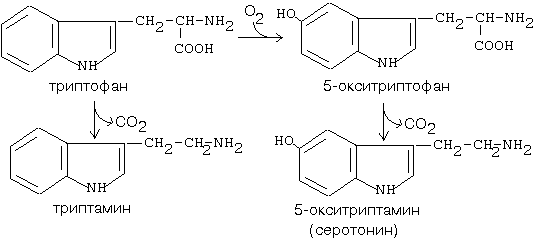
Роль серотонина: 1) сужает сосуды 2) регулирует свертывание крови 3) обладает антиаллергическим действием.
Образование гистамина из гистидина катализируется гистидиндекарбоксилазой.
4. Репарация – внутриклеточный процесс восстановления поврежденной из-за неблагоприятных воздействий структуры ДНК. Различают: а) дорепликативную б) репликативную в) пострепликативную репарации. Прямая репарация – химическая реакция, направленная на восстановление структуры поврежденного нуклеотида, эксцизионная репарация – вырезание поврежденного фрагмента с участием ряда ферментов:
1) эндонуклеазы – узнает поврежденный участок и разрывает рядом с ним нить ДНК
2) экзонуклеазы – вырезает поврежденный участок
3) ДНК-полимеразы – комплементарно достраивает фрагмент ДНК на месте разрушенного
4) лигаза – сшивает концы ресинтезированного участка с основной нитью ДНК.
Роль репарации: обеспечение постоянства генетического материала.
5. Метод Сэнджера использует дидезоксинуклеотиды для всех четырех нуклеотидов. Есть четыре набора реагентов, каждый из которых содержит все четыре нуклеотида в нормальной дезокси-форме и один из нуклеотидов в дидезокси-форме. Копии одной и той же одноцепочечной ДНК инкубируют в каждом наборе. В каждом из четырех наборов синтез ДНК останавливается по всем соотвествующим сайтам фрагмента ДНК. Электрофорез проводится во всех четырех наборах раздельно. Поскольку длина пути передвижения в геле при электрофорезе зависит от размера молекулы, фрагменты ДНК будут распределяться линейно в соответствии со своим размером. Если взять, например, набор с ддАТФ, то мы увидим, что в образце будут присутствовать фрагменты ДНК, укороченные по каждой из позиций, где в синтезируемой цепи находился аденозин. Некоторые фрагменты, в цепи которых аденозин появляется рано, будут короткими. Другие (аденозин появляется позже в последовательности ДНК) — длиннее. Вы можете определить локализацию аденозина по длине этих фрагментов. Затем можно сравнить данные, полученные после электрофореза в каждом наборе. Так вы определите локализацию каждого нуклеотида в исследуемой последовательности ДНК
6.
Задание:
1. Другие органы, кроме почек и печени также могут обезвреживать аммиак
Пути обезвреживания аммиака в организме и в клетке:
а) временное связывание – в тканях, интенсивно продуцирующих аммиак – в нервной и мышечной:
1) связывание NH3 с глутаминовой, реже аспарагиновой кислотами с образованием глн и асн
2) аминирование остатков глу и асп в составе белков
3) восстановительное аминирование a-кетоглутарата в глутамат, который в реакции трансаминирования с ПВК образует ала – резервный и транспортный источник аммиака.
б) общее (конечное) обезвреживание
1) выведение в виде солей аммония
2) синтез мочевины
2. Эндопептидазы – расщепляют пептидные связи внутри целой молекулы белка. Работают при оптимальных рН и концентрации электролитов. Синтезируются в виде неактивных проферментов, затем активируются путем ограниченного протеолиза. Каждая эндопептидаза специфична по отношению к определенным пептидным связям, продукт действия одного фермента может быть субстратом для другого.
Основные эндопептидазы желудка и поджелудочной железы:
1)пепсин – гидролиз пептидных связей, образованных карбоксильными группами ароматических и больших алифатических АК с образованием больших пептидных фрагментов.
2) трипсин – гидролизует пептидные связи, образованные карбоксильными группами основных АК – лиз и арг.
3) химотрипсин – гидролизует пептидные связи, образованные карбоксильными группами ароматических АК (фен, тир, три)
4)эластаза – гидролизует пептидные связи, образованные карбоксильными группами маленьких алифатических АК (гли, ала, сер)
3. Диагностическое значение определения активности аминотрансфераз в сыворотке крови:
а) увеличенный уровень может свидетельствовать о: инфаркте миокарда, гепатите, алкогольном повреждении печени, раке печени, мышечной дистрофии печени.
б) сниженный уровень – о пищевой недостаточности пиридоксина, при беременности, состоянии после гемодиализа.
Например, при инфаркте миокарда активность АсАТ в крови резко возрастает (в 5—10 раз по сравнению с нормой) через 4—6 ч после начала заболевания, а затем постепенно снижается, достигая нормы примерно через 5 дней. Повторное повышение активности АсАТ в крови говорит о продолжающемся процессе некротического распада ткани миокарда.
В клетках сердечной мышцы (миокарда) содержится гораздо больше АсТ, чем АлТ, а в клетках печени - наоборот: АлТ намного больше, чем АсТ. Поэтому ПРИ ИНФАРКТЕ МИОКАРДА АКТИВНОСТЬ АСТ в крови БУДЕТ ЗНАЧИТЕЛЬНО ВЫШЕ, ЧЕМ АЛТ, А ПРИ ВИРУСНОМ ГЕПАТИТЕ АКТИВНОСТЬ АЛТ БУДЕТ ВЫШЕ, ЧЕМ АСТ.
4. Синтез пуриновых нуклеотидов путем: а) повторного использования готовых азотистых оснований (характерно для размножающихся тканей) б) de novo из низкомолекулярных предшественников (источники N – аспартат, глицин, глутамин, источники С – СО2, глицин, двухуглеродные фрагменты метенил-ТГФК и формил-ТГФК).
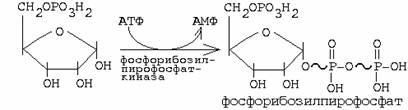
ФРПФ + глутамин -------> глутамат + ФФ + фосфорибозиламин (катализируется ключевым ферментом фосфорибозиламидотрансферазой)
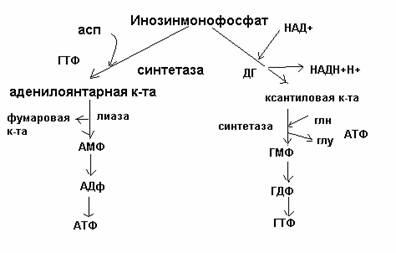
Основные промежуточные продукты: фосфорибозиламин, инозинмонофосфат, аденилоянтарная, ксантиловая кислоты.
5. Расшифровав нуклеотидную последовательность гена, можно установить последовательность АК в кодируемом белке, однако следует помнить что ген содержит некодирующие последовательности – интроны и спейсеры, которые удаляются в ходе процессинга и сплайсинга и не отражаются в структуре конечного белка. Поэтому, чтобы достоверно установить последовательность АК в белке, можно методами генетической инженерии синтезировать белок, а затем подвергнуть его биохимическому анализу (электрофорезу).
Задание:
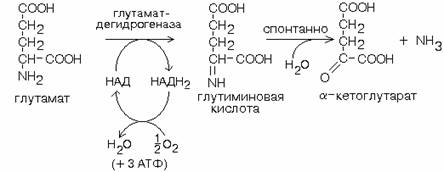
1. Глутаматдегидрогеназа – играет ключевую роль в обмене АК:
Глутамат-ДГ - никотинамидная, отнимаемые протоны и электроны не передаются сразу на кислород, а транспортируются по полной цепи МтО с образованием воды и параллельным образованием трех молекул АТФ. Регуляторным ферментом - ингибируется избытком АТФ, и активируется избытком АДФ.
2. Оценка кислотообразующей функций желудка имеет большое значение при диагностике язвенной болезни, гастрита, злокачественных новообразований и др.
Общую кислотность желудочного сока в основном определяют:
а) свободная НCl – это НСl, которая выделяется обкладочными клетками в чистом виде (20-40 ммоль/л)
б) связанная с белками НCl
в) кислые фосфаты
г) органические кислоты.
Содержание в норме 40-60 ммоль/л у взрослых, 2,8 ммоль/л у детей.
Принцип определение: титрование желудочного сока с помощью р-ра NaOH в присутствии фенолфталеина и последующий расчет общей кислотности.
3. . Пути обезвреживания аммиака в организме и в клетке:
а) временное связывание – в тканях, интенсивно продуцирующих аммиак – в нервной и мышечной:
1) связывание NH3 с глутаминовой, реже аспарагиновой кислотами с образованием глн и асн
2) аминирование остатков глу и асп в составе белков
3) восстановительное аминирование a-кетоглутарата в глутамат, который в реакции трансаминирования с ПВК образует ала – резервный и транспортный источник аммиака.
б) общее (конечное) обезвреживание
1) выведение в виде солей аммония
2) синтез мочевины
4. . Нуклеотиды – мономеры нуклеиновых кислот – состоят из:
1) азотистого основания (у всех нуклеиновых кислот)
2) пентозы (рибозы у РНК или дезоксирибозы у ДНК)
3) остатка фосфорной кислоты
Азотистое основание + пентоза = нуклеозид.
Свойства нуклеотидов: 1) отрицательно заряжены (за счет фосфатных групп) 2) циклические соединения 3) гидрофобны 4) поглощают свет при 260 нм (УФ область).
Функции нуклеотидов:
1) структурная – мономеры нуклеиновых кислот, входят в состав коферментов
2) энергетическая (АТФ - это универсальный аккумулятор энергии, энергия УТФ используется для синтеза гликогена, ЦТФ - для синтеза липидов, ГТФ - для движения рибосом в ходе трансляции (биосинтез белка) и передачи гормонального сигнала (G-белок)
3) регуляторная - аллостерические эффекторы многих ключевых ферментов, цАМФ и цГМФ являются посредниками в передаче гормонального сигнала при действии многих гормонов на клетку и активаторами протеинкиназы
5. Метод Сэнджера использует дидезоксинуклеотиды для всех четырех нуклеотидов. Есть четыре набора реагентов, каждый из которых содержит все четыре нуклеотида в нормальной дезокси-форме и один из нуклеотидов в дидезокси-форме. Копии одной и той же одноцепочечной ДНК инкубируют в каждом наборе. В каждом из четырех наборов синтез ДНК останавливается по всем соотвествующим сайтам фрагмента ДНК. Электрофорез проводится во всех четырех наборах раздельно. Поскольку длина пути передвижения в геле при электрофорезе зависит от размера молекулы, фрагменты ДНК будут распределяться линейно в соответствии со своим размером. Если взять, например, набор с ддАТФ, то мы увидим, что в образце будут присутствовать фрагменты ДНК, укороченные по каждой из позиций, где в синтезируемой цепи находился аденозин. Некоторые фрагменты, в цепи которых аденозин появляется рано, будут короткими. Другие (аденозин появляется позже в последовательности ДНК) — длиннее. Вы можете определить локализацию аденозина по длине этих фрагментов. Затем можно сравнить данные, полученные после электрофореза в каждом наборе. Так вы определите локализацию каждого нуклеотида в исследуемой последовательности ДНК
