
- •5.Опишите принципиальный подход к клонированию…
- •3.Диагностическое значение определения активности аминотрансфераз в сыворотке крови:
- •3.Диагностическое значение определения активности аминотрансфераз в сыворотке крови:
- •Оценка кислотообразующей функций желудка имеет большое значение при диагностике язвенной болезни, гастрита, злокачественных новообразований и др.
- •Уровни упаковки генетического материала:
- •У детей незаменимыми являются заменимые у взрослых ак: гис и арг. Аргинин:
3.Диагностическое значение определения активности аминотрансфераз в сыворотке крови:
а) увеличенный уровень может свидетельствовать о: инфаркте миокарда, гепатите, алкогольном повреждении печени, раке печени, мышечной дистрофии печени.
б) сниженный уровень – о пищевой недостаточности пиридоксина, при беременности, состоянии после гемодиализа.
Например, при инфаркте миокарда активность АсАТ в крови резко возрастает (в 5—10 раз по сравнению с нормой) через 4—6 ч после начала заболевания, а затем постепенно снижается, достигая нормы примерно через 5 дней. Повторное повышение активности АсАТ в крови говорит о продолжающемся процессе некротического распада ткани миокарда.
В клетках сердечной мышцы (миокарда) содержится гораздо больше АсТ, чем АлТ, а в клетках печени - наоборот: АлТ намного больше, чем АсТ. Поэтому ПРИ ИНФАРКТЕ МИОКАРДА АКТИВНОСТЬ АСТ в крови БУДЕТ ЗНАЧИТЕЛЬНО ВЫШЕ, ЧЕМ АЛТ, А ПРИ ВИРУСНОМ ГЕПАТИТЕ АКТИВНОСТЬ АЛТ БУДЕТ ВЫШЕ, ЧЕМ АСТ.
4. При гиперурикемии повышается образование мочевой кислоты под действием ксантиноксидазы:
Хроническая гиперурикемия — фактор риска сердечно-сосудистой патологии и заболеваний почек, неблагоприятный прогностический признак при ишемической болезни сердца, АГ, хронической сердечной недостаточности. В подобных ситуациях формируются многочисленные порочные круги.
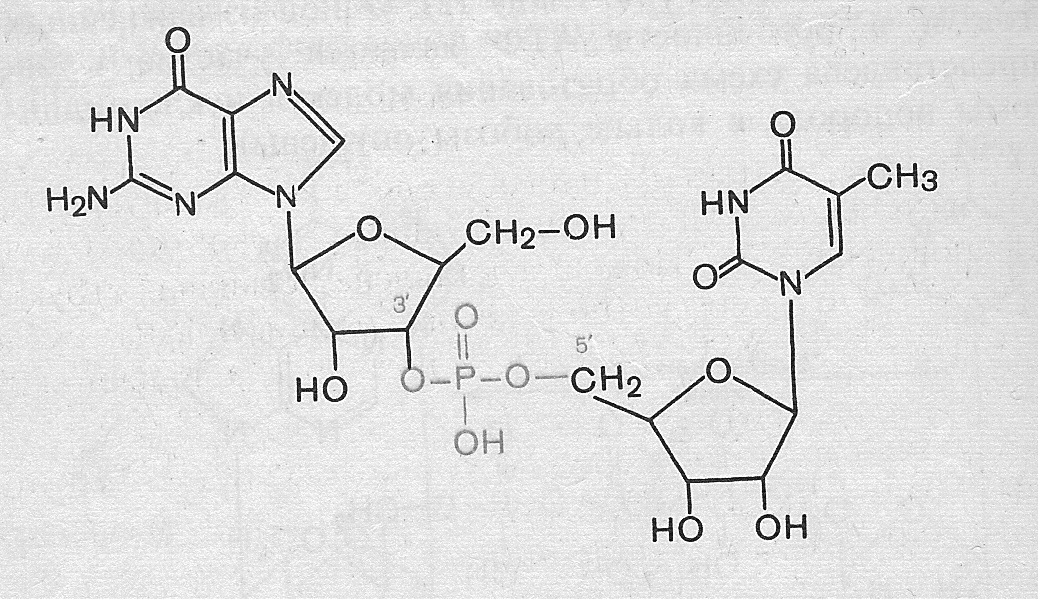
5. В дидезокси-форме нуклеотида отсутствует гидроксильная группа в определяющей позиции (3′-позиция). Используются дидезоксинуклеотиды, чтобы прервать синтез ДНК.
Поэтому, если вы снабдите синтезирующуюся молекулу ДНК, к примеру, дидезоксиаденозином (ддАТФ) в смеси с дезоксиаденозином (дАТФ) и другими тремя дезоксинуклеотидами, то синтез второй цепочки остановится там, где в цепочку встроится дидезоксиаденозин вместо дезоксиаденозина. По теории вероятности в части синтезируемых ДНК репликация прервется в каждой точке, где необходим аденозин.
ГААГЦААЦТТТТ
6. да ,нет ,нет. Они не соответствуют ни одной тРНК ,распознаются рилизинг-ферментами ,которые вызывают отсоединение синтезированного белка и диссоциацию рибосомы.
Задание;
Протеолитические ферменты вовлекаются в большое число разнообразных физиологических процессов. Протеолиз (гидролиз белков) может протекать вне клеток и внутриклеточно. Действие протеолитических ферментов может быть разделено на 2 категории:
Ограниченный протеолиз, в котором протеаза специфически расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны.
Неограниченный, или тотальный протеолиз, при котором белки распадаются до своих аминокислот. Такому протеолизу, например, подвергаются белки в ЖКТ, в цитозоле при участии протеосом с затратой АТФ (после предварительного взаимодействия гидролизуемого белка со специальным белком убиквитином) или в лизосомах.
В ЖКТ под действием протеолитических ферментов происходит расщепление белков. Они имеют различную специфичность и рН оптимум, например:
пепсин (эндопептидаза желудочного сока) – гидролиз пептидных связей, образованных карбоксильными группами ароматических и больших алифатических АК с образованием больших пептидных фрагментов. Оптимум действия наблюдается в сильнокислой среде, при рН около 1,5 – 2,5;
трипсин (эндопептидаза поджелудочной железы)– гидролизует пептидные связи, образованные карбоксильными группами основных АК – лиз и арг. Оптимум действия – в щелочной среде;
химотрипсин (эндопептидаза поджелудочной железы) – гидролизует пептидные связи, образованные карбоксильными группами ароматических АК (фен, тир, три).
эластаза (эндопептидаза поджелудочной железы) – гидролизует пептидные связи, образованные карбоксильными группами маленьких алифатических АК (гли, ала, сер).
Карбоксипептидаза А (экзопептидаза поджелудочной железы)– отщепляет нейтральные аминокислоты от С-конца пептидов.
Карбоксипептидаза В (экзопептидаза поджелудочной железы) – отщепляет основные аминокислоты от С-конца пептидов.
Протеолитические ферменты синтезируются в виде неактивных предшественников (проферментов) и затем активируются в полости ЖКТ. Проферменты активируются путём ограниченного протеолиза.
Реакции образавания биогенных аминов:
Серотонин:
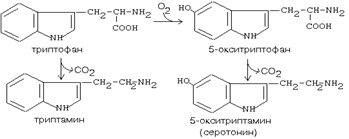
Роль серотонина:
1) сужает сосуды; 2) регулирует свертывание крови; 3) обладает антиаллергическим действием.
Гистамин
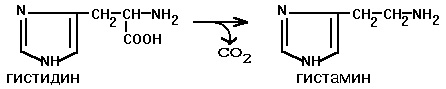
Роль гистамина:
1)участник аллергических реакций 2) сильный вазодилятатор 3) расширяет капилляры и увеличивает сосудистую проницаемость 4) понижает артериальное давление 5) повышает тонус (спазм) гладких мышц (бронхи) 6) усиливает секрецию желудочного сока.
ГАМК
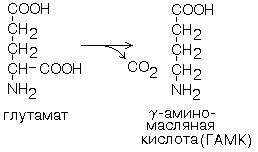
Роль ГАМК: 1) оказывает тормозящий эффект на деятельность ЦНС; 2) её препараты используют для лечения заболеваний, сопровождающихся возбуждением коры головного мозга.
Схема образования мочевины:
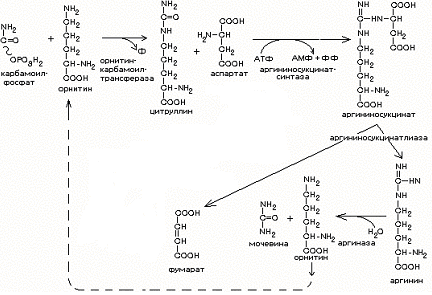
Содержание мочевины в крови в норме 2,5-8,3 ммоль/л.
Значение определения мочевины в крови в клинической практике:
а) повышение уровня мочевины в крови может свидетельствовать о:
нарушении функции почек (хронической и острой почечной недостаточности),
внепочечные причины: обезвоживание организма, усиленный распад белков (острая желтая дистрофия печени, злокачественные опухоли и др.).
б) понижение концентрации мочевины в крови:
повышенная скорость клубочковой фильтрации (у беременных молодых женщин, при нагрузке чрезмерным объемом внутривенных вливаний)
патологическое изменении значительной части паренхимы печени
недостаточности белка в питании, продолжительном голодании
врожденное нарушение нормального протекания цикла мочевины (у детей).
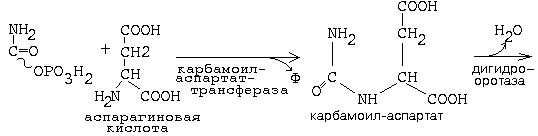
Синтез пиримидиновых нуклеотидов.
Сначала образуется циклическая структура пиримидинового азотистого основания, и только затем присоединяется рибозо-5-фосфат. Источники атомов – СО2, аспартат, глутамин.
Карбамоилфосфатсинтетаза II является ключевым ферментом
![]()
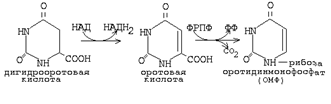
Основные промежуточные продукты: карбомоилфосфат, оротовая к-та, дигидрооротовая к-та
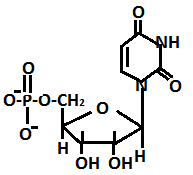
Уридин-5’-монофосфат
Клонирование – получение большого количества молекул (в нашем случае молекула ДНК), клеток, организмов – потомков одного предка. Для клонирования бактериальных и вирусных генов необходимы носители генетической информации – плазмиды, ДНК (РНК) бактериофага, нуклеоид, хромосомы дрожжей.
Этапы: 1) получение генетического материала
2) включение гена в векторную молекулу, создание рекомбинантной ДНК
3) введение рекомбинантной ДНК в клетку хозяина 4) отбор трансформированных клеток на селективных средах.
Применение: 1) получение разнообразных вакцин и иммунологических диагностикумов
2) синтез ряда БАВ: СТ, инсулин, эритропоэтин, интерфероны, факторы свертывания крови
3) получение ферментов в промышленности
4) получение относительно недорогого пищевого белка для животных и т.д.
Нет, нет, нет
Задание:
Фермент, использующий АЛА в качестве субстрата, это аланиновая аминотрансфераза (АлАТ).
Активность АлАТ широко исследуется в медицинской практике, т.к.повышение активности АлАТ в крови позволяет распознавать патологические состояния (пример: гепатит, рак печени, мышечная дистрофия). АлАТ в мышцах обеспечивают удаление азота АК при их усиленном катаболизме. При повреждении мышц уровень АлАТ и АсАТ (аспарагиновая трансаминаза) увеличивается, что может служить дополнительным диагностическим критерием.
Особенно важна диагностическая ценность определения АлАТ при безжелтушных формах болезни Боткина и в инкубационном периоде.
Реакция, катализируемая АлАТ:
АЛА + αКГ аланиновая аминотрансфераза (АлАТ) глу + Пируват
Остаточный азот сыворотки крови – азотсодержащие небелковые вещества (промежуточные или конечные продукты обмена простых и сложных белков) – мочевина, мочевая кислота, креатин, креатинин, аммиак, индикан, билирубин и т.д. Азот этих веществ называют остаточным, т.к. он остается в фильтрате после осаждения белков плазмы крови.
Основная часть остаточного азота крови – азот мочевины (50%), азот АК (25%) и азот других азотсодержащих соединений(25%). Норма остаточного азота крови для взрослых 14,3-25,0 ммоль/л.
Остаточный азот определяют в безбелковом фильтрате после осаждения белков с последующей минерализацием фильтрата концентрированной серной кислотой. При этом образуется сульфат аммония, который образует с реактивом Несслера соединение желто-оранжевого цвета. Интенсивность окрашивания пропорциональна содержанию азота.
Значение метода:
диагностика поражения почек (исследование выделительной функции)
диагностика нарушения мочевинообразовательной функции печени.
Нуклеопротеины под действием желудочного сока (НCl) распадаются на белки и нуклеиновые кислоты. Белки катаболизируются до АК, затем всасываются, НК – до нуклеозидов, которые также всасываются. В клетках с ними происходит распад либо до АО и пентозы, либо до АО и фосфопентозы:
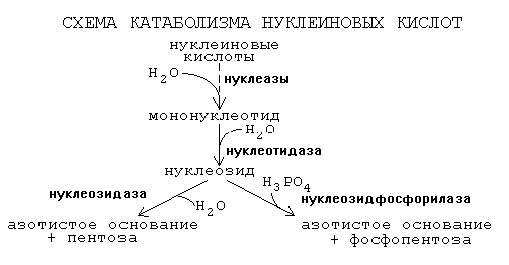
фосфодиэстераза

Транскрипция – переписывание информации с ДНК на иРНК.
Синтез иРНК начинается в определённых последовательностях, которые называют промотерами, и завершается в терминирующих участках (сайты терминации). Участок ДНК, ограниченный промотором и сайтом терминации, представляет собой единицу транскрипции (у прокариот – оперон, у эукариот – транскриптон). Для прокариот в этом процессе участвует только РНК-полимераза (олигомерный фермент, состоящий из нескольких субъединиц), а для эукариот:
РНК-полимераза I – синтезирует р-РНК,
РНК-полимераза II – синтезирует и-РНК,
РНК-полимераза III – т-РНК.
Субстраты синтеза иРНК:
матрица(одна из цепей ДНК, которая называется матричной);
рибонуклеозидтрифосфаты, которые являются источниками энергии (ЦТФ, ГТФ, АТФ,УТФ);
для прокариот обязательным является праймер, для эукариот его отсутствие.
Синтез идет антипараллельно от 5’ к 3‘ концу.
У прокапиот с ДНК сразу синтезируется иРНК. А у эукариот, в начале, синтезируется и-РНК в виде предшественника – пре-иРНК, потом пре-иРНК претерпевает процессинг (вырезание неинформативной зоны) и сплайсинг (сшивание полученных фрагментов в единую молекулу иРНК), затем идет кэпирование (присоединение 7-метилгуанозина к 5’-концу полиаденилового конца для защиты этого конца от нуклеаз), помогает присоединиться к рибосомам. На 3’- конце идет полиаденилирование – для защиты от нуклеаз, участвует в транспорте из ядра в цитоплазму.
Одним из эффективных методов идентификации определенных молекул ДНК (или их последовательностей) среди электрофоретически разделенных фрагментов является классический метод блот-гибридизации по Саузерну.
Этапы проведения Саузерн-блот-анализа:
экстракция ДНК из клеток;
разрезание молекулы рестриктазами;
разделение в геле (обычно агарозном);
денатудация ДНК щелочью;
перенос на нитроцеллюлозу (обычно посредством капиллярности);
блокирование избытком ДНК;
гибридизация с меченым ДНК-зондом;
вымывание несвязанного зонда (использование «контролируемой строгости»);
ауторадиография.
Радиоактивный зонд для Саузерна-блота. В качестве зонда используют радиоактивную копию фрагмента исследуемой ДНК. В начале выделяют ген или фрагмент молекулы ДНК, последовательность нуклеотидов которых будет в последующим открываться на электрофореграммах. Полученные двухцепочечные молекулы денатурируют и, используя в качестве затравок меченные гексамерные последовательности нуклеотидов, проводят ДНК- полимеразную реакцию, которая позволяет синтезировать меченные копии используемой матрицы. После денатурации синтезированных ДНК-полимеразой молекул ДНК образуются радиоактивные одноцепочечные копии обеих цепей выделенного фрагмента ДНК, которые и используются в качестве зонда.
Да, нет (т.к. превращение цитруллина и аспартата в аргинино-сукцинат катализирует аргинино-сукцинатсинтетаза)
Задание:
Продуктом обмена глутамата является ГАМК. Реакция образования ГАМК катализируется
глутаматдекарбоксилазой в клетках серого вещества головного мозга.
Другими биологически активными веществами являются, например, норадреналин и адреналин. Их образование включает следующие этапы: тирозин (АК) - диоксифенилаланин (ДОФА) - диоксифенилэтиламин (дофамин) - норадреналин - адреналин;
В шишковидной железе синтезируется производное АК триптофана - мелатонин и серотонин; Гистамин из гистидина.
