
- •5.Опишите принципиальный подход к клонированию…
- •3.Диагностическое значение определения активности аминотрансфераз в сыворотке крови:
- •3.Диагностическое значение определения активности аминотрансфераз в сыворотке крови:
- •Оценка кислотообразующей функций желудка имеет большое значение при диагностике язвенной болезни, гастрита, злокачественных новообразований и др.
- •Уровни упаковки генетического материала:
- •У детей незаменимыми являются заменимые у взрослых ак: гис и арг. Аргинин:
Задание.
1.синтез карбамоилфосфата может осуществляться двумя путями. Напишите эти реакции, укажите ферменты и их клеточную локализацию. В каких метаболических процессах используется карбомоилфосфат? Биологическая роль этих процессов?
а) для пиримидинов (карбамоилфосфатсинтетаза II):
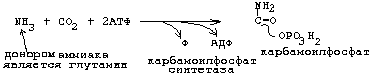
б) для мочевины:
![]()
Карбомоилфосфат синтезируется в митохондриях в комплексной реакции, которая катализируется карбомоилфосфатсинтетазой 1. Синтез карбомоилфосфата является необратимой реакцией.
2.Какие биохим. Проц. Понимают под гниением белков? Какие токсичные продукты образуются в результате этого процесса? Механизмы их обезвреживания.
Гниение белков – совокупность превращений белков, вызванные деятельностью микроорганизмов кишечника. При гниении образуется ряд токсических продуктов распада: фенол, крезол, индол, скатол, сероводород, меркаптаны. Данные продукты попадают в портальную систему и обезвреживаются в печени путем конъюгации с глюкуроновой кислотой или с другими веществами с образованием нетоксичных и растворимых соединений – эфироглюкуроновых парных кислот
3.Окислительное дезаминирование аминокислот – ферменты, коферменты, биологическое значение глутаматдегидрогеназной реакции.
Окисл дезамин некоторых ак катализируется флавинзависимыми дегидрогеназами. Окисл дезаминоров. – это один из типов реакций прямого дезаминирования.
Глутаматдегидрогеназа – играет ключевую роль в обмене АК:
Аммиак, высвобождаемый в этой реакции, протекающей в печени, используется для синтеза мочевины. Обратная реакция Способствует механизмам обезвреживания аммиака и позволяет использовать азот аммиака для синтеза аминокислот.
4. постсинтетическая модификация белков. Виды, биол роль.
Многие белки синтезируюися в неактивном виде ( в виде предшественников) и после схождения с рибосомами подвергаются постсинтетической модификации. Виды модификации белков:
Частичный протеолиз
Объединение протомеров и формирование четвертичной структуры белков.
Образование внутри- и межцепочечных S-S связей.
Ковалентное присоединение кофакторов к ферментам (пиридоксальфосфат, биотин).
Гликозилирование (гормоны, рецепторы)
Модификация остатков ак: гидроксилирование про и лиз (коллаген), йодирование тир (тиреоидные гормоны), карбоксилирование глу и асп (факторы свертывания крови).
Фосфорилирование (казеин молока, активация ферментов)
Ацетилирование (гистоны)
Пренилирование (G-белки)
5.Опишите поэтапно метод отпечатков пальцев. Для чего он используется?
После выделения ДНК и разрез ее рестриктазами обр фрагменты различной величины. Эти фрагменты раздел методом электрофореза в агарозном геле и проводят гибридизацию с пробами радиоктивной ДНК( обычно используется неск зондов). Каждый зонд специфически присоединяется только в одном или в двух местах. Конечная картина состоит из ряда полосок, расположение которых уникально и характерно только для одного человека.
«Метод отпечатков пальцев» ДНК используется для: 1) идентификации личности в судебной медицине 2) комплексной диагностики наследственных заболеваний 3) поиске участков ДНК, отвечающих за развитие патологии 4) установления отцовства.
В основе метода – принцип гибридизации на основе комплементарности.
6. Эритромицин стимулирует…
1 часть нет, т.к. эритромицин блокирует биосинтез белков, 2 часть нет, вся фраза нет.
Задание.
1.Незаменимые ак….
Незаменимые АК: арг, вал, гис, иле, лей, лиз, мет, тре, три, фен. Арг и гис частично заменимы (незаменимы для детей). Данные АК называются незаменимыми, т.к. в организме не синтезируются углеродные скелеты этих АК и невозможно их образование с помощью реакций трансаминирования. Последствия недостаточности незаменимых АК в пище: отрицательный азотистый баланс, остановка роста и истощение, нарушения со стороны НС, неполное усвоение других АК.
Коэффициент изнашивания – количество азота, теряемое человеком, находящимся на безбелковой диете (примерно 20 г белка в сутки).
Виды дезаминирования ак…
Бывает прямое, непрямое.
. Роль непрямого дезаминирования АК:
1) Обеспечивает образование новых АК из числа заменимых.
2) Образование необходимых клетке кетокислот из заменимых АК
3) Обеспечивают синтез мочевины
4) Главный путь удаления азота у АК при их интенсивном катаболизме
Суть процесса: перенос аминогруппы одной АК на -кетокислоту с образованием другой АК и другой -кетокислоты.
Асп + альфа КГ = Оксалоацетат + ГЛУ
Напишите конечные продукты распада…
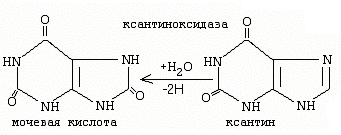
Конечные прод распада пуриновых соед. Мочевая кислота
Пиримидиновых – бета аминокислоты, аммиак, диоксид углерода.
Причины повышения уровня мочевой кислоты в крови:
1) нечувствительность к регуляторам ферментов синтеза пуринов de novo
2) снижение активности ферментов реутилизации пуринов
3) почечная патология
4) нехватка витамина B9
Последствия: гиперурикемия и подагра (накопление кристаллов мочевой кислоты в суставах).
4.Транскрипция у эукариот…
. Единица транскрипции у эукариот – транскриптон: неинформативная зона (промотор) и информативная (структурные гены – экзоны – информативны, интроны – нет + спейсеры – вставки, разделяющие структурные гены). В отличие от прокариот у эукариот работу транскриптона регулируют несколько генов-репрессоров, а индукторами являются сложные молекулы (гормоны и т.д.), часто требуется несколько индукторов – ступенчатый процесс. Образуемая в процессе транскрипции и-РНК содержит неинформативные участки и подвергается процессингу (вырезание неинформативных участков) и сплайсингу (склеиванию оставшихся фрагментов).
– транскрипция – переписывание информации с ДНК на и-РНК. Для эукариот в этом процессе участвуют: РНК-полимераза I – синтезирует р-РНК, РНК-полимераза II – синтезирует и-РНК, РНК-полимераза III – т-РНК. Субстраты синтеза: матрица, рибонуклеозидтрифосфаты, праймер не требуется. Синтез идет антипараллельно, от 5’ к 3‘ концу. Вначале и-РНК образуется в виде предшественника – пре-и-РНК, затем идет кэпирование – присоединение 7-метилгуанозина к 5’-концу полиаденилового конца для защиты этого конца от нуклеаз, помогает присоединиться к рибосомам. На 3’- конце идет полиаденилирование – для защиты от нуклеаз, участвует в транспорте из ядра в цитоплазму.
Единица транскрипции у эукариот – транскриптон: неинформативная зона (промотор) и информативная (структурные гены – экзоны – информативны, интроны – нет + спейсеры – вставки, разделяющие структурные гены). В отличие от прокариот у эукариот работу транскриптона регулируют несколько генов-репрессоров, а индукторами являются сложные молекулы (гормоны и т.д.), часто требуется несколько индукторов – ступенчатый процесс. Образуемая в процессе транскрипции и-РНК содержит неинформативные участки и подвергается процессингу (вырезание неинформативных участков) и сплайсингу (склеиванию оставшихся фрагментов).
5.Какие ферменты и для чего исп в молек биологии…
Используют рестриктазы (эндонуклеазы, которые узнают специфические последовательности в ДНК и разрезают молекулу ДНК в этом месте), ДНК-полимеразы, ДНК-лигазы, экзонуклеазы и другие.
6.при почечной недостаточности…
Да, да, да.
Повышение остаточного азота крови (азотемия), может возникать в результате нарушения азотвыделительной функции почек, т.е. вследствие почечной недостаточности.
Задание.
1. Реакции образования новых АК:
1) переаминирование (трансаминирование)
2) прямое гидролитическое дезаминирование (асн асп)
3) аминирование (глу глн)
4) -декарбоксилирование (асп ала)
асп + αКГ asparaginovaja transaminaza глу + оксалоацетат
2.нарушение какого процесса…
К настоящему времени описаны врожденные дефекты каждого фермента, учавствующего в синтезе мочевины. Все дефекты ( за исключением дефицита аргиназы) сопровождаются тяжелой гипераммонийемией.
Синтез 1 моля мочевины требует 3 молей атф.
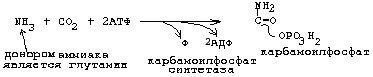 ключевая
реакция синтеза мочевины.
ключевая
реакция синтеза мочевины.
3.азотистое основания…
Гуанозин - нуклеозид. Формула в книге.
. Нуклеотиды – мономеры нуклеиновых кислот – состоят из:
1) азотистого основания (у всех нуклеиновых кислот)
2) пентозы (рибозы у РНК или дезоксирибозы у ДНК)
3) остатка фосфорной кислоты
Азотистое основание + пентоза = нуклеозид.
Свойства нуклеотидов: 1) отрицательно заряжены (за счет фосфатных групп) 2) циклические соединения 3) гидрофобны 4) поглощают свет при 260 нм (УФ область).
Функции нуклеотидов:
1) структурная – мономеры нуклеиновых кислот, входят в состав коферментов
2) энергетическая (АТФ - это универсальный аккумулятор энергии, энергия УТФ используется для синтеза гликогена, ЦТФ - для синтеза липидов, ГТФ - для движения рибосом в ходе трансляции (биосинтез белка) и передачи гормонального сигнала (G-белок)
3) регуляторная - аллостерические эффекторы многих ключевых ферментов, цАМФ и цГМФ являются посредниками в передаче гормонального сигнала при действии многих гормонов на клетку и активаторами протеинкиназы
4.биосинтез белка на рибосомах…
Трансляция – синтез полипептида с последовательностью АК, отвечающей последовательности триплетов нуклеотидов в молекуле и-РНК. Этапы трансляции: 1) кодирование 2) рекогниция 3) собственно трансляция: инициация, элонгация, терминация.
Участники трансляции: и-РНК, рибосомы, аминоацилтРНК, активированные формы АК, ГТФ, факторы инициации, элонгации, терминации.
Перед началом синтеза белка рибосомы диссоциированы. На этапе инициации к малой субъединицы рибосомы 3’ концом присоединяется и-РНК. К первому инициирующему кодону присоединяется 1 аминоацил-тРНК, несущая метионин. Затем присоединяется к образованному комплексу большая субъединица рибосомы с затратой ГТФ – образование инициирующего комплекса. В рибосоме образуется два центра – аминоацильный и пептидильный. В свободный А-центра поступает следующая аминоацил-тРНК ® фермент пептидил трансфераза образует пептидную связь между АК, дипептид остается в А-центре® транслоказа перемещает рибосому на 1 кодон и-РНК ® дипептид при этом оказывается в П-центре ® в освободившийся А-центр поступает следующая АК.
Элонгация заканчивается терминацией – наступает, когда в А-центр оказывается один из трех нонсенс-кодонов (стоп-кодонов): УАА, УАГ, УГА. Они не соответствуют ни одной тРНК, распознаются рилизинг-ферментами, которые вызывают отсоединение синтезированного белка и диссоциацию рибосомы.
5.Опишите принципиальный подход к клонированию…
. Клонирование – получение большого количества молекул, клеток, организмов – потомков одного предка. Для клонирования бактериальных и вирусных генов необходимы носители генетической информации – плазмиды, ДНК (РНК) бактериофага, нуклеоид, хромосомы дрожжей.
Этапы: 1) получение генетического материала 2) включение гена в векторную молекулу, создание рекомбинантной ДНК 3) введение рекДНК в кл хозяина 4) отбор трансформированных кл на селективных средах.
Применение: 1) получение разнообразных вакцин и иммунологических диагностикумов 2) синтез ряда БАВ: СТ, инсулин, эритропоэтин, интерфероны, факторы свертывания крови 3) получение ферментов в промышленности 4) получение относительно недорогого пищевого белка для животных и т.д.
69. Вектор – природный ген определенного микроорганизма с внедренным в него участком чужеродного гена. В качестве векторов применяется: 1) плазмида – небольшая кольцевидная молекула ДНК бактерий, реплицируемая независимо от нуклеоида 2) бактериофаг лямбда 3) хромосомы дрожжей 4) космидные векторы - гибрид фага лямбда и плазмиды.
6. Дефицит триптофона в пище…
Да, нет, нет
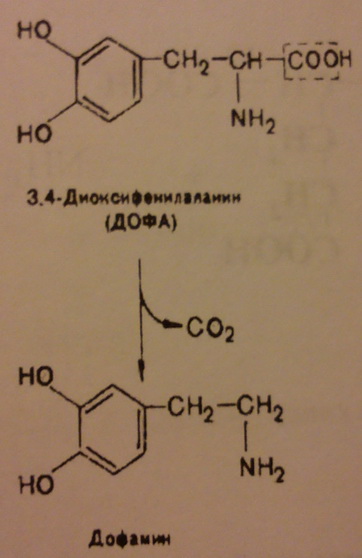
Т.к. адреналин синтезируется из дофамина.
1. Окислительное дезаминирование глутаминовой кислоты с образованием а-кетоглутарата и аммиака (глутаматдегидрогеназная реакция):
ГЛУ + НАД+ а-кетоглутарат + НАДН*Н+ + NH3
2. Протеолиз может протекать вне клеток и внутриклеточно.
Также различают два действия протеолитических ферментов:
- ограниченный протеолиз - расщепление пептидных связей в белке-мишени приводит к изменению его функционального состояния (ферменты, гормоны)
Его функции: деление клетки, процессинг белков, апоптоз, система свертывания и фибринолиза, система комплемента, кининовая система, образование активных гормонов, активирование ферментов ЖКТ, канцерогенез и др.
- неограниченный или тотальный протеолиз – белки распадаются до аминокислот (ЖКТ, лизосомы, цитозоль)
Его функции: снижение иммуногенности белков, реутилизация белков, пополнение аминокислотного фонда клеток в крови.
3. Нуклеиновые кислоты – биополимеры, мономерами которых являются нуклеотиды, которые соединены между собой при помощи фосфодиэфирной связи между 3’-углеродным атомом пентозы одного нуклеотида и 5’-углеродным атомом пентозы другого нуклеотида. К ним относятся ДНК и РНК. В их основе лежит однообразно повторяющаяся последовательность из пентозы и остатка фосфорной кислоты, а также основания, которое находится на внешней части цепей.
Уровни структурной организации:
- первичная структура: последовательность нуклеотидов
- вторичная (молекулы ДНК): двойная спираль (комплементарная, антипараллельная), стабилизируется водородными, гидрофобными связями, есть три типа структуры (A-, B-, Z-формы)
- третичная: формируется только в связи с белками (гистонами и негистонами)
Связь между нуклеотидами:
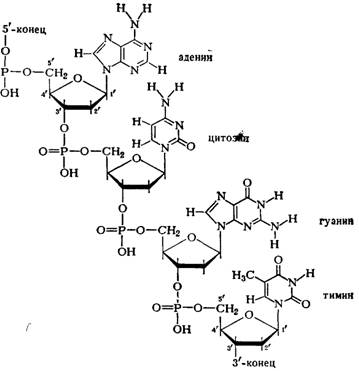
4. Механизм трансляции:
активирование аминокислот => образование аминоацил-тРНК => инициация (иРНК соединяется с рибосомной субъединицей) => образование инициирующего комплекса => элонгация (циклично происходит:связывание аминоацил-тРНК, образование пептидной связи, транслокация рибосомы) => терминация (присоединение к терминирующим кодонам фактора освобождения).
Генетический код — способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов. Его свойства: триплетность, непрерывность, неперекрываемость, однозначность (специфичность), вырожденность (избыточность), универсальность.
5. Метод Сэнжера – метод определения первичной последовательности нуклеотидов молекулы нуклеиновых кислот, также известен как метод обрыва цепи. Метод основан на присоединении к однонитчатой молекуле ДНК прямого или обратного секвенирующего праймера и на синтезе de novo молекулы НК с применение ддНТФ. При этом синтезируются молекулы разной длинны с определенным дидезоксинуклеотидом на конце. После разделения синтезированных молекул ДНК электрофорезом возможно определение первичной последовательности.
4 полосы означают, что в исследуемой молекуле ДНК имеется 4 адениновых азотистых основания.
Последовательность: ААЦ-ЦЦТ-АТГ-АГГ
6. - - -
Серин – заменимая АК, серотонин образуется из триптофана.
1. Аммиак является нейротоксином.
Аммиак => биосинтез глутамина, иногда аспарагина (образование нетоксичной формы для транспортировки)
Реакция образования транспортной формы (фермент – глутаминсинтетаза):

Реакция высвобождения из транспортной формы (фермент – глутаматдегидрогеназа):
ГЛУ + НАД+ а-кетоглутарат + НАДН*Н+ + NH3
Образование и выведение аммиака через почки резко усиливается при ацидозе (т. е. отклонении рН крови в кислую сторону).
2. Катехоламины - группа биогенных аминов производных пирокатехина (катехола), осуществляющая регуляцию ф-ций эндокринных желез (надпочечники, щитовидная железа и др.) и передачу нервных импульсов.
Дофамин - вызывает чувство удовольствия, влияет на процессы мотивации и обучения, используется при процессах переключения внимания.
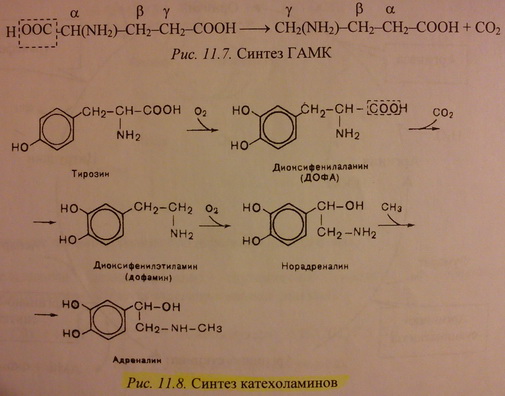
Основной механизм обезвреживания биогенных аминов - окислительному дезаминированию этих аминов с образованием соответствующих альдегидов и освобождением аммиака.
3. ДНК:
- первичная структура: последовательность нуклеотидов(А,Г,Т,Ц)
- вторичная (молекулы ДНК): двойная спираль (комплементарная, антипараллельная), стабилизируется водородными, гидрофобными связями, есть три типа структуры (A-, B-, Z-формы)
РНК:
- первичная структура: последовательность нуклеотидов(А,Г,У,Ц)
- вторичная: однонитеваямолекула, отдельные участки комплементарны друг другу (двунитевые «шпильки»), типы: тРНК, рРНК, иРНК.
Связь между нуклеотидами:
4. Дезоксирибонуклеотида в ДНК: аденин, гуанин, тимин цитозин; состоит из дезоксирибозы, одного из азотистых оснований (пурина или пиримидина) и 1-3 остатков фосфорной кислоты.
дАДФ:
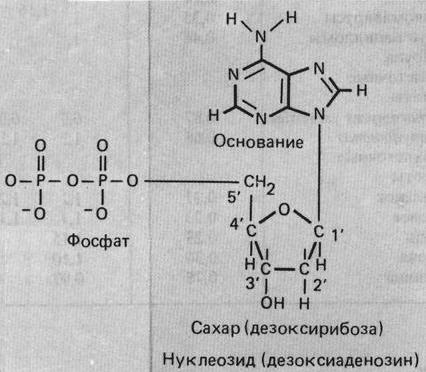
Схема строения:
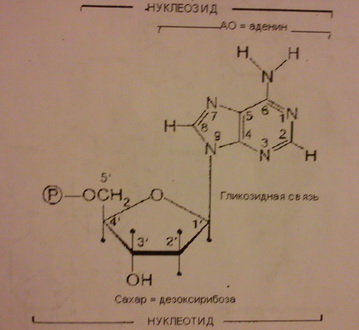
5. Метод Сэнжера – метод определения первичной последовательности нуклеотидов молекулы нуклеиновых кислот, также известен как метод обрыва цепи. Метод основан на присоединении к однонитчатой молекуле ДНК прямого или обратного секвенирующего праймера и на синтезе de novo молекулы НК с применение ддНТФ. При этом синтезируются молекулы разной длинны с определенным дидезоксинуклеотидом на конце. После разделения синтезированных молекул ДНК электрофорезом возможно определение первичной последовательности.
Полосы соответствуют расположению синтезированных молекул ДНК (с разными концевыми азотистыми основаниями) после проведения электрофореза.
Последовательность: ГЦГ-ЦТТ-АЦА-ТГФ
6. - + -
В результате непрямого дезаминирования аланин превращается в пируват. Восстановительное аминирование альфа-кетоглутарата – завершающий этап непрямого дезаминирования.
Задание:
1.Относительно незаменимыми являются аспарагин ,глутамин ,аргинин ,глицин ,пролин и серин. Потребность в этих аминокислотах может опережать возможности клеток по их синтезу .Например ,потребность в аргинине резко увеличивается при приеме больших количеств белка и у детей в период ускоренного роста ,потребность в глицине увеличивается при поступлении большого количества ксенобиотиков ,а в пролине – после тяжелой обширной травмы.
Аминокислоты фонда клетки используются для синтеза белков и небелковых органических азотсодержащих соединений. Некоторые аминокислоты распадаются до конечных продуктов и служат источниками энергии. Серосодержащие аминокислоты служат источником серы в составе органических и неорганических соединений. Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов.
2.Эндопептидазы – расщепляют пептидные связи внутри целой молекулы белка. Работают при оптимальных рН и концентрации электролитов. Синтезируются в виде неактивных проферментов, затем активируются путем ограниченного протеолиза. Каждая эндопептидаза специфична по отношению к определенным пептидным связям, продукт действия одного фермента может быть субстратом для другого.
Основные эндопептидазы желудка и поджелудочной железы:
пепсин – гидролиз пептидных связей, образованных карбоксильными группами ароматических и больших алифатических АК с образованием больших пептидных фрагментов.
трипсин – гидролизует пептидные связи, образованные карбоксильными группами основных АК – лиз и арг.
химотрипсин – гидролизует пептидные связи, образованные карбоксильными группами ароматических АК (фен, тир, три)
эластаза – гидролизует пептидные связи, образованные карбоксильными группами маленьких алифатических АК (гли, ала, сер).
Экзопептидазы – удаляют АК последовательно от N- или C-конца белковой молекулы.
а) Карбоксипептидазы (вырабатываются в поджелудочной железе): карбоксипептидаза А – отщепляет нейтральные АК с С-конца пептида, карбоксипептидаза В – основные АК с С-конца пептида.
б) Аминопептидазы (вырабатываются на границе тощей и подвздошной кишки): аланинаминопептидазы (отщепляют ала с N-конца), лейцинаминопептидазы (отщепляют все остальные АК с N-конца).
Одним из механизмов переноса аминокислот через клеточные мембраны является процесс,получивший название у-глутамиловый цикл,в основе его лежит реакция катализируемая y-глутамилтранспептидаза---фермент структурный компонент мембран ,он обеспечивает взаимодействие глутатиона с поступающей в клетку аминокислотой.
