
- •1. Химия р-элементов III группы 3
- •1. Химия р-элементов III группы
- •1.1. Способы получения
- •1.2. Химические свойства
- •1.3. Бинарные соединения
- •1.3.1. Соединения с водородом
- •1.3.2. Соединения с кислородом
- •1.3.3. Галогениды
- •1.3.4. Соединения с другими элементами
- •1.4. Кислоты бора и их производные
- •1.5. Гидроксиды и их производные
- •1.6. Применение
- •2. Химия d – элементов III группы
- •2.1. Способы получения металлов
- •2.2. Химические свойства
- •2.3.4. Соединение с другими элементами
- •2.4. Гидроксиды и их производные
- •2.5. Лантаноиды
- •2.6. Актиноиды
- •2.7. Применение
- •3. Контрольные задания по теме «свойства элементов III группы»
- •4. Химия р– элементов ivгруппы
- •4.1. Способы получения
- •4.2. Химические свойства
- •4.3. Бинарные соединения
- •4.3.1. Соединения с водородом
- •4.3.2. Соединения с кислородом
- •4.3.3. Галогениды
- •4.3.4. Соединения с другими элементами
- •4.4. Кислоты, гидроксиды и их производные
- •4.5. Применение
- •5. Химия d – элементов IV группы
- •5.1. Способы получения
- •5.2. Химические свойства
- •5.3. Бинарные соединения
- •5.3.1. Соединения с водородом
- •5.3.2. Соединения с кислородом
- •5.3.3. Галогениды
- •5.3.4. Соединения с другими элементами
- •5.4. Гидроксиды, кислоты и их производные
- •5.5. Применение
- •6. Контрольные задания по теме “свойства элементов
- •IV группы”
- •7. Правила техники безопасности при работе в лаборатории
- •8. Лабораторная работа “элементы III и IV групп периодической системы” Опыт 1. Гидролиз тетрабората натрия (буры)
- •Опыт 2. Получение малорастворимого метабората
- •Опыт 3. Изучение свойств алюминия
- •Опыт 5. Гидролиз солей алюминия
- •Опыт 6. Получение дигидроксидов олова и свинца и изучение их свойств
- •Опыт 8. Нерастворимые соединения свинца и олова
- •Библиографический список
2.7. Применение
Применение скандия ограниченно из-за его дороговизны. В силу своей теплостойкости, легкости, высокой прочности и химической стойкости скандий является перспективным материалом для авиа- и ракетостроения. Sc используется в электровакуумной технике как геттер (поглотитель газов). Металлы подгруппы скандия используются в качестве добавок к сплавам. Оксиды этих элементов применяются в качестве катализаторов в производстве огнеупорной керамики, ферритов, лазерных материалов.
Оксиды иттрия и лантана используются в производстве высокотемпературных сверхпроводящих материалов.
Основная область применения лантаноидов – металлургия, где они используются как добавки к различным сплавам. Оксиды этих элементов применяются в качестве катализаторов, входят в состав многих лазерных и ферромагнитных материалов, используются в оптической промышленности.
Актиноиды и их соединения применяются в основном в атомной энергетике.
3. Контрольные задания по теме «свойства элементов III группы»
Вариант 1
1.Напишите уравнения реакций, позволяющих получить алюминий и серу из сульфата алюминия.
2.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
![]()
Вариант 2
1.Какой объем 40 %
раствора гидроксида калия
![]() следует
добавить к 50 г 10 % раствора хлорида
алюминия для того, чтобы первоначально
выпавший осадок полностью
растворился?
следует
добавить к 50 г 10 % раствора хлорида
алюминия для того, чтобы первоначально
выпавший осадок полностью
растворился?
2.Напишите уравнения реакций (в молекулярной и ионной формах) получения гидроксидов скандия, иттрия и лантана. Как изменяется сила оснований в этом ряду?
Вариант 3
1.Для полного перевода в раствор сплава Al+Cu+Mg следует использовать разбавленный раствор кислоты: а) HCl; б) H2SO4; в) HNO3; г) CH3COOH. Выберите кислоту, напишите уравнения реакций.
2.Гидроксид скандия получают осаждением из растворов солей скандия тиосульфатом натрия:
![]()
Какова масса полученного гидроксида скандия (III), если в результате реакции
выделилось 84 л оксида серы (IV) (н.у.)?
Вариант 4
1. Составьте уравнения реакций, протекающих по схеме:
![]()
2.Окислительно –
восстановительный потенциал сопряженной
пары ![]() составляет 1,252 В. Может ли сульфат
таллия (III)
окислить а) соляную кислоту; б) иодид
калия?
составляет 1,252 В. Может ли сульфат
таллия (III)
окислить а) соляную кислоту; б) иодид
калия?
Вариант 5
1.Напишите уравнения реакций, при помощи которых можно осуществить следующие переходы:
![]()
Назовите все указанные соединения таллия.
2.Имея в распоряжении сульфат алюминия и уголь, получите карбид алюминия.
Вариант 6
1.Составьте уравнения реакций, отвечающих схеме
![]()
2.Оксид лантана массой 25 г «погасили» водой. После длительного стояния на воздухе первоначально образовавшийся слизистый белый осадок превратился в плотный осадок карбоната лантана. Вычислите его массу.
Вариант 7
1.Какой объем 15,5%
раствора азотной кислоты
![]() потребуется
для растворения скандия, если в результате
реакции образовалось 0,03 моль соли
амммония?
потребуется
для растворения скандия, если в результате
реакции образовалось 0,03 моль соли
амммония?
2.Имея в распоряжении нитрид алюминия, воду и хлор, получите хлорид алюминия.
Вариант 8
1. Какие последовательные изменения претерпевает борная кислота при нагревании? Что образуется при нейтрализации борной кислоты: а) эквивалентным количеством щелочи; б) избытком щелочи?
2. В 0,1 н. растворе степень гидролиза хлорида скандия (III) равна 9 %, хлорида натрия (III) – 0,01 %, хлорида лантана – 0,003 % . Какой из гидроксидов: скандия иттрия или лантана обладает более сильными основными свойствами?
Вариант 9
1.К осадку гидроксида алюминия добавляют водный раствор гидроксида натрия. Наблюдают растворение осадка, который выпадает снова при насыщении образовавшегося раствора диоксидом серы. Напишите уравнения реакций.
2.Образец газообразного борана ВхНу массой 1,11 г создает в сосуде объемом 0,8 л давление 6,66∙104 Па при 100 0С. Определите формулу борана.
Вариант 10
1.Сульфат церия (III) окисляется в щелочной среде кислородом воздуха в гидроксид церия (VI). Как ведет себя полученный гидроксид по отношению к концентрированной соляной кислоте?
2.Рассчитайте суммарную массу осадков в реакции взаимодействия сульфата алюминия с гидроксидом бария, если взято по 100 мл 0,15 м растворов обоих реагентов.
Вариант 11
1.Растворимость сульфата алюминия 36,4 г/100г Н2О, сульфата калия – 11,1г/100г Н2О. Какие массы насыщенных растворов этих веществ надо смешать, чтобы путем выпаривания получить 237 г алюмокалиевых квасцов KAl (SO4)2∙12 Н2О?
2.Диоксид урана взаимодействует с концентрированной H2SO4 c образованием сульфата урана (IV), а в концентрированной HNO3 и царской водке окисляется, образуя соли диоксоурана (IV), т.е. соответственно нитрат и хлорид. Напишите уравнения реакций.
Вариант 12
1. К раствору, содержащему 35,24 г хлорида галлия (III) прилили раствор, содержащий 22 г сульфида калия. Определите массу образовавшегося осадка.
2. Скандий и его аналоги предельно понижают степень окисления азота в очень разбавленной азотной кислоте. Напишите уравнения реакций в ионно-молекулярной и молекулярной формах.
Вариант 13
1. Составьте уравнения реакций, протекающих по схеме:
![]()
2. Газообразный хлорид бора объемом 0,102 л (н.у.) подвергают полному гидролизу. Образовавшийся осадок отфильтровывают, а фильтрат разбавляют водой до 6 л. Определите рН конечного раствора.
Вариант 14
1. Сопоставьте, не производя вычислений, степень гидролиза: а) Ce(SO4)2 и Ce(SO4)3; б) хлоридов церия (III) и лютеция (III).
2. Составьте уравнения реакций, протекающих по схеме:
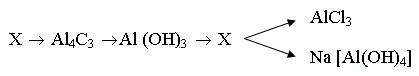
Вариант 15
1. Сульфат диоксоурана (VI) восстанавливается цинком с образованием соли урана (IV); последняя при действии сильных окислителей вновь образует сульфат диоксоурана (VI). Закончите уравнения реакций:
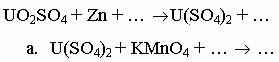
2. Напишите уравнения реакций, протекающих при постепенном добавлении раствора гидроксида натрия к раствору сульфата галлия.
Вариант 16
1.
Рассчитайте
массы продуктов, полученных при
электролизе 2,5 л раствора хлорида
алюминия с массовой долей AlCl3
15 %
![]()
2. Оксид скандия при сплавлении со щелочами образует скандиаты. Напишите уравнение реакций. Сходство, с какими оксидами проявляет при этом оксид скандия?
Вариант 17
1. Почему алюминий растворяется в концентрированных Na2CO3 и NH4Cl? Приведите уравнения реакций.
2. Рассчитайте объем газа, образующегося при взаимодействии 89,16 г гидрида лантана с водой.
Вариант 18
1. Осуществите следующие превращения:
![]()
2. К раствору хлорида лантана (III) с нормальной концентрацией 0,5 моль/л добавили избыток оксалата калия. Определите массу образующегося малорастворимого декагидрата оксалата лантана (III).
Вариант 19
1. Вычислите нормальность соляной кислоты, если на реакцию с 0,19 г Na2B4O7∙10H2O израсходовано 0,02 л раствора HCl.
2. Как и почему меняется основный характер гидроксидов при переходе от скандия к лантану и от лантана к лютецию?
Вариант 20
1. Что получится при взаимодействии фосфида алюминия: а) с водой; б) с H2SO4; в) с NaOH?
2. Фторид бора получают нагреванием оксида бора с фторидом кальция и концентрированной серной кислотой. Напишите уравнение реакций.
