
- •1. Химия р-элементов III группы 3
- •1. Химия р-элементов III группы
- •1.1. Способы получения
- •1.2. Химические свойства
- •1.3. Бинарные соединения
- •1.3.1. Соединения с водородом
- •1.3.2. Соединения с кислородом
- •1.3.3. Галогениды
- •1.3.4. Соединения с другими элементами
- •1.4. Кислоты бора и их производные
- •1.5. Гидроксиды и их производные
- •1.6. Применение
- •2. Химия d – элементов III группы
- •2.1. Способы получения металлов
- •2.2. Химические свойства
- •2.3.4. Соединение с другими элементами
- •2.4. Гидроксиды и их производные
- •2.5. Лантаноиды
- •2.6. Актиноиды
- •2.7. Применение
- •3. Контрольные задания по теме «свойства элементов III группы»
- •4. Химия р– элементов ivгруппы
- •4.1. Способы получения
- •4.2. Химические свойства
- •4.3. Бинарные соединения
- •4.3.1. Соединения с водородом
- •4.3.2. Соединения с кислородом
- •4.3.3. Галогениды
- •4.3.4. Соединения с другими элементами
- •4.4. Кислоты, гидроксиды и их производные
- •4.5. Применение
- •5. Химия d – элементов IV группы
- •5.1. Способы получения
- •5.2. Химические свойства
- •5.3. Бинарные соединения
- •5.3.1. Соединения с водородом
- •5.3.2. Соединения с кислородом
- •5.3.3. Галогениды
- •5.3.4. Соединения с другими элементами
- •5.4. Гидроксиды, кислоты и их производные
- •5.5. Применение
- •6. Контрольные задания по теме “свойства элементов
- •IV группы”
- •7. Правила техники безопасности при работе в лаборатории
- •8. Лабораторная работа “элементы III и IV групп периодической системы” Опыт 1. Гидролиз тетрабората натрия (буры)
- •Опыт 2. Получение малорастворимого метабората
- •Опыт 3. Изучение свойств алюминия
- •Опыт 5. Гидролиз солей алюминия
- •Опыт 6. Получение дигидроксидов олова и свинца и изучение их свойств
- •Опыт 8. Нерастворимые соединения свинца и олова
- •Библиографический список
2.3.4. Соединение с другими элементами
Скандий и его аналоги образуют с бором, углеродом, кремнием, азотом, фосфором, серой тугоплавкие соединения, часто с металлическими свойствами, например LaB6, ScN, LaC2, Sc5Si3, Sc3Si5, ScSi2, YB2. Многие из них нестехиометрического состава.
Сульфиды металлов группы III В Э2S3 образуются при взаимодействии этих металлов с серой или сульфатов Э2(SO4)3 с углеродом при нагревании.
Нитриды ЭN образуются при взаимодействии металлов, гидридов карбидов или оксидов этих металлов с азотом (иногда при сильном нагревании). Нитриды иттрия и лантана разлагаются водой:
ЭN + 3Н2О = Э(ОН)3 + NН3
Карбид лантана LaC2 получают как и другие карбиды взаимодействием La2О3 с углеродом при высокой температуре. Он легко разлагается водой с образованием La(ОН)3, Н2, C2Н2 и других углеводородов.
2.4. Гидроксиды и их производные
Студнеобразные белые осадки гидроксидов Э(ОН)3 образуются при обработке солей Э3+ растворами щелочей или аммиака. При нагревании они постепенно теряют воду и превращаются в оксиды:
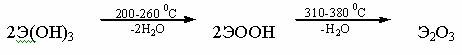
От Sc(OH)3 к Ac(OH)3 усиливаются основные свойства. Так, Sc(OH)3 амфотерен, а La(OH)3 – довольно сильное основание.
Sc(OH)3 + 3NаОН = Nа3 [Sc(OH)6]
2Sc(OH)3 + 3Н2SО4 = Sc(SО4)3 + 6Н2О
Подобно алюминию, скандий и его аналоги образуют двойные соли, чем объясняется растворение карбонатов элементов группы III В в насыщенных растворах карбонатов щелочных металлов и аммония:
La2 (СО3)3 + К2СО3 = 2К[La(СО3)2]
На рис. 7 приведена схема взаимосвязи между основными типами соединений элементов группы III В на примере Sc.
2.5. Лантаноиды
Лантаноиды – типичные металлы. Т.к. у элементов этого семейства происходит заполнение электронами третьей снаружи оболочки (4f - подуровня), а строение внешних оболочек остается неизменным, то лантаноиды очень близки по химическим свойствам. Поэтому выделение их из природных смесей сопряжено с определенными трудностями. В настоящее время это осуществляется с помощью ионообменных методов.
Лантаноиды проявляют устойчивую степень окисления в соединениях +3, а некоторые из них также +2 и +4.
Лантаноиды весьма реакционноспособны: легко окисляются на воздухе (Э2О3), реагируют с водородом (ЭН2, ЭН3), углеродом (Э2С3, ЭС2), серой (ЭS, Э2S3), кремнием (ЭSi2), фосфором (ЭР, ЭР2), галогенами (ЭГ) и другими неметаллами при повышенных температурах.
Все лантаноиды реагируют с водой и кислотами (кроме НF и Н3РО4):
2Се + 6Н2О(гор.) = 2Се(ОН)3 + 3Н2
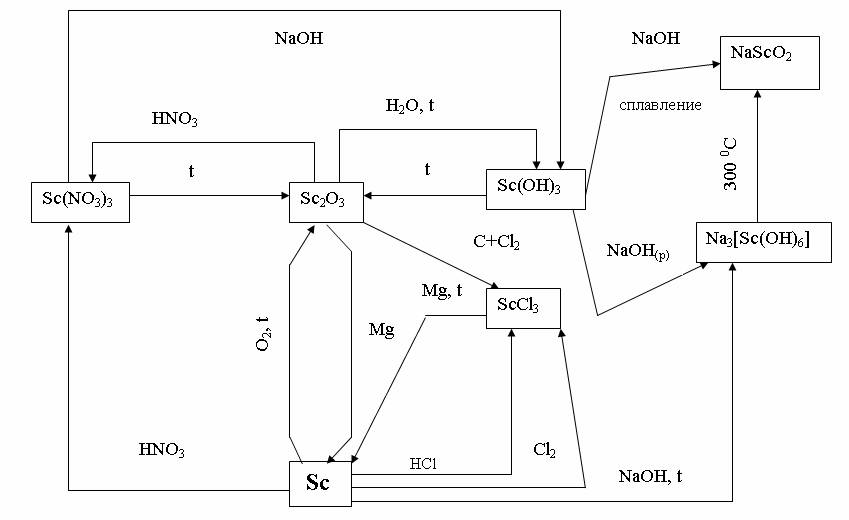
Рис. 7. Взаимопревращения основных соединений скандия
2Се + 6НCl = 2СеCl 3 + 3Н2
Се + 4НNO3 (разб.) = Се(NO3)3 + NO + 2Н2О
Взаимосвязь между основными типами соединений на примере церия показана на рис. 8.
2.6. Актиноиды
Все актиноиды радиоактивны. Торий, протактиний и уран встречаются в природе и поэтому могут быть получены из их соединений электролизом расплавов или методом металлотермии:
UF4 + 2Ca = 2Ca F2 + U
Остальные актиноиды получаются с помощью различных ядерных превращений.
Актиноиды способны проявлять в соединениях степени окисления от +3 до +7, что обусловлено легкостью перехода электронов с 5f на 6d – подуровень.
Актиноиды химически активны. На воздухе они быстро окисляются кислородом (ЭО2) и азотом (ЭN, Э2N3, Э3N4, ЭN2), взаимодействуют с водородом (ЭН2, ЭН3, ЭН4), фосфором (ЭР, Э3Р4), серой (ЭS, Э2S3, ЭS2), углеродом ( ЭС, Э2С3, ЭС2), галогенами (ЭГ3, ЭГ4, ЭГ5, ЭГ6). Со щелочами при обычных условиях не взаимодействуют; довольно легко окисляются водой и кислотами:
Th + 4Н2О(пар) = Th(ОН)4 + 2Н2
Th + 4НCl = ThCl4 + 2Н2
3Th + 4НNO3 + 12HCl = 3ThCl4 + 4NO + 8Н2O
На рис. 9 показана схема взаимосвязи между основными типами соединений на примере урана.
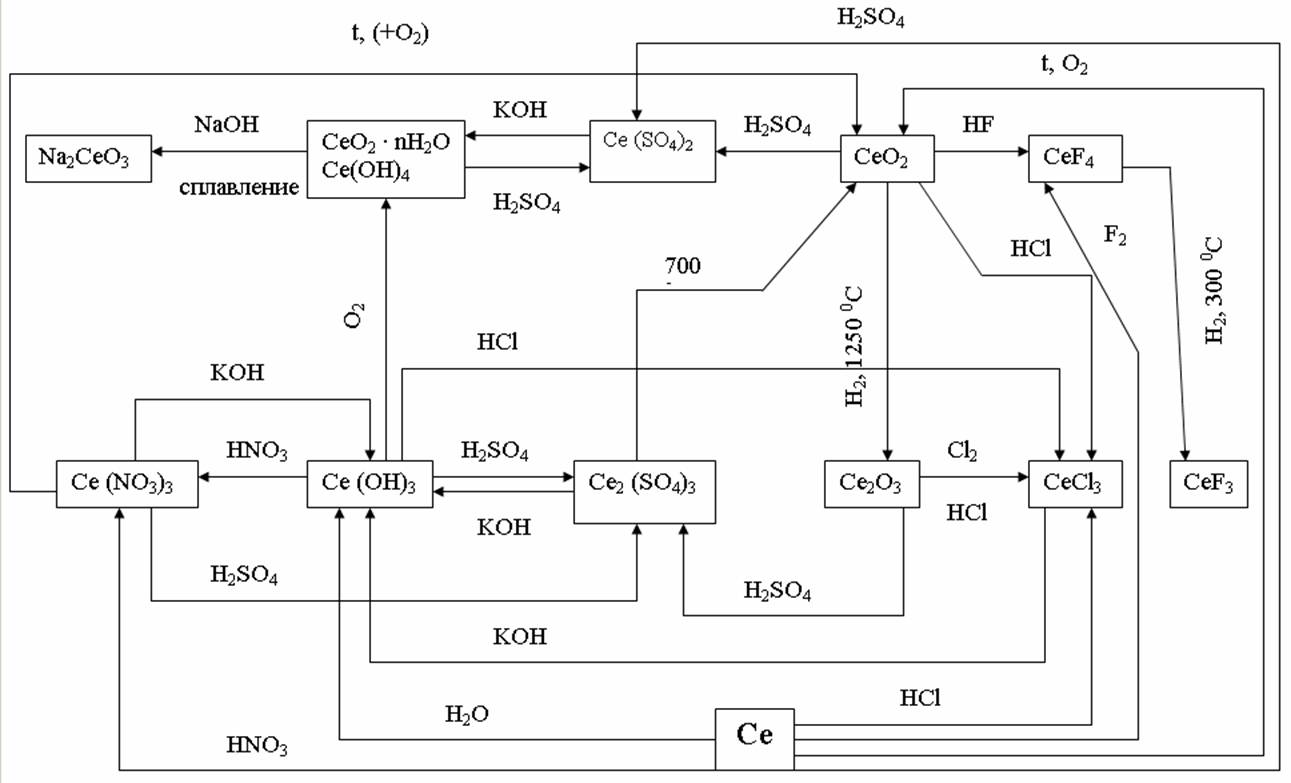
Рис. 8. Взаимопревращения основных соединений церия
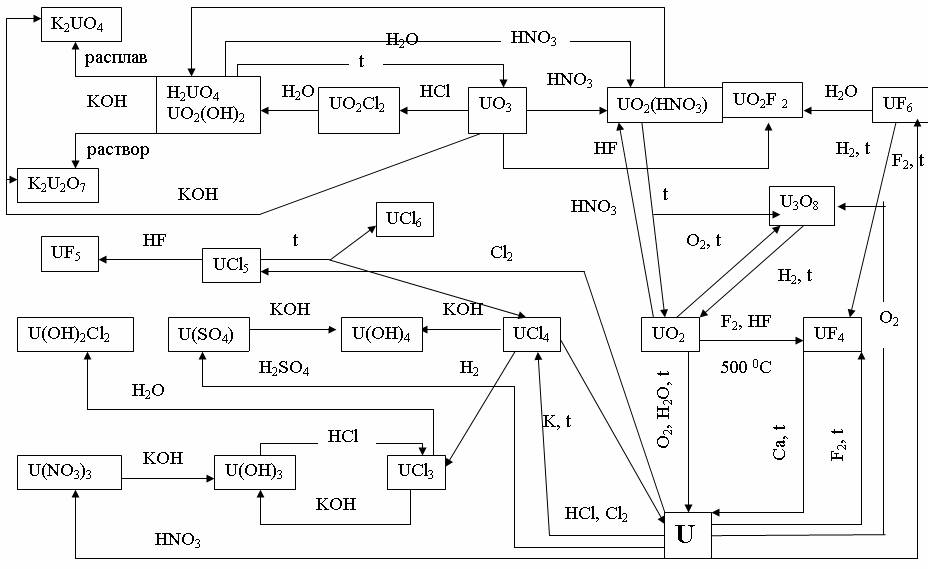
Рис. 9. Взаимопревращение основных соединений урана
