
- •1. Химия р-элементов III группы 3
- •1. Химия р-элементов III группы
- •1.1. Способы получения
- •1.2. Химические свойства
- •1.3. Бинарные соединения
- •1.3.1. Соединения с водородом
- •1.3.2. Соединения с кислородом
- •1.3.3. Галогениды
- •1.3.4. Соединения с другими элементами
- •1.4. Кислоты бора и их производные
- •1.5. Гидроксиды и их производные
- •1.6. Применение
- •2. Химия d – элементов III группы
- •2.1. Способы получения металлов
- •2.2. Химические свойства
- •2.3.4. Соединение с другими элементами
- •2.4. Гидроксиды и их производные
- •2.5. Лантаноиды
- •2.6. Актиноиды
- •2.7. Применение
- •3. Контрольные задания по теме «свойства элементов III группы»
- •4. Химия р– элементов ivгруппы
- •4.1. Способы получения
- •4.2. Химические свойства
- •4.3. Бинарные соединения
- •4.3.1. Соединения с водородом
- •4.3.2. Соединения с кислородом
- •4.3.3. Галогениды
- •4.3.4. Соединения с другими элементами
- •4.4. Кислоты, гидроксиды и их производные
- •4.5. Применение
- •5. Химия d – элементов IV группы
- •5.1. Способы получения
- •5.2. Химические свойства
- •5.3. Бинарные соединения
- •5.3.1. Соединения с водородом
- •5.3.2. Соединения с кислородом
- •5.3.3. Галогениды
- •5.3.4. Соединения с другими элементами
- •5.4. Гидроксиды, кислоты и их производные
- •5.5. Применение
- •6. Контрольные задания по теме “свойства элементов
- •IV группы”
- •7. Правила техники безопасности при работе в лаборатории
- •8. Лабораторная работа “элементы III и IV групп периодической системы” Опыт 1. Гидролиз тетрабората натрия (буры)
- •Опыт 2. Получение малорастворимого метабората
- •Опыт 3. Изучение свойств алюминия
- •Опыт 5. Гидролиз солей алюминия
- •Опыт 6. Получение дигидроксидов олова и свинца и изучение их свойств
- •Опыт 8. Нерастворимые соединения свинца и олова
- •Библиографический список
1.5. Гидроксиды и их производные
Для Al, Ga, In, и Tl характерны гидроксиды типа Э(OH)3, для таллия – также TlOH. Получают гидроксиды осаждением щелочами из растворимых солей соответствующих металлов:
Э(NO3)3 + 3NaOH = Э(OH)3 + 3NaNO3
Al (OH)3, Ga (OH)3 и In (OH)3 амфотерны, причем от Al к In усиливаются основные свойства. Tl(OH)3 имеет основной характер , TlОН – растворимое в воде сильное основание.
При нагревании гидроксиды теряют воду, переходя в оксиды:
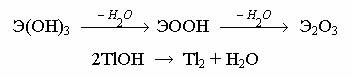
Все гидроксиды взаимодействуют с кислотами, а амфотерные – и со щелочами (при сплавлении и в растворе) с образованием алюминатов, галлатов и индатов:
Э(OH)3 + NaOH = NaЭО2 + 2Н2О (1000 0С)
Э(OH)3 + NaOH(конц.) = Na[Э(OH)4]
На рис. 3 и 4 показаны схемы взаимосвязи между основными типами соединений элементов группы III А на примерах В и Аl.
1.6. Применение
Бор и его соединения – нитрид BN, карбид В4С, фосфид ВР – применяются как полупроводники, BN и В4С – сверхтвердые материалы. Бура Na2B4O710Н2О используется в стекольном, керамическом и других производствах.
Область применения сплавов алюминия – от домашней утвари до современной авиатехники.
Легкоплавкие сплавы галлия находят широкое применение в различного рода терморегуляторах и высокотемпературных термометрах.
Сплавы, содержащие индий, применяются в качестве припоев для соединения металлов, стекла, керамики.
Таллий находит применение в электронике и электротехнике, Tl2S – для изготовления фотоэлементов.
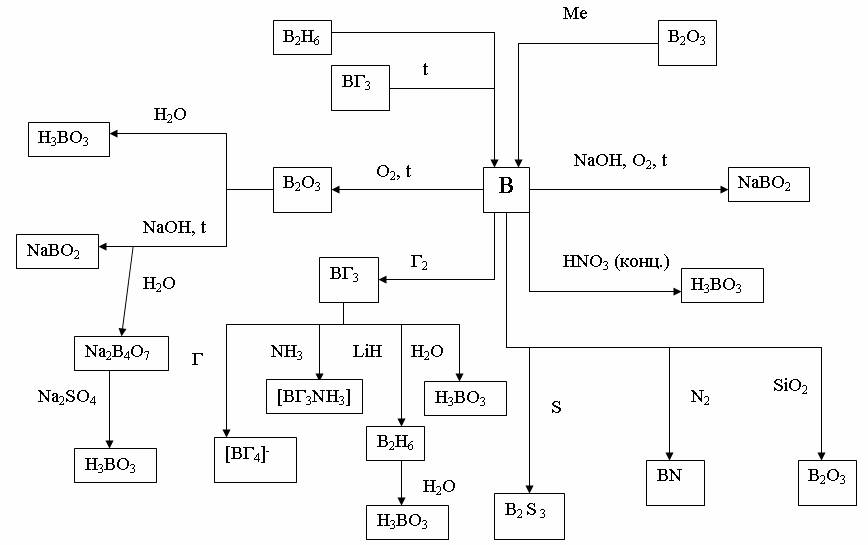
Рис.3. Химические свойства бора и его соединений
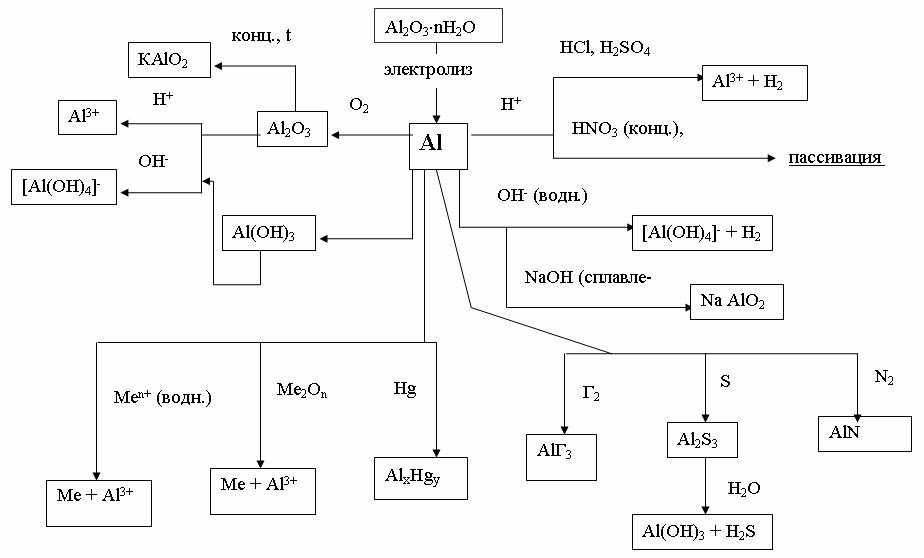
Рис. 4. Химические свойства алюминия и его соединений
2. Химия d – элементов III группы
Побочная подгруппа третьей группы (III В) охватывает большое число химических элементов, т.к. в состав ее, кроме четырех d–элементов (Sc, Y, La, Ac), входят f−элементы с порядковыми номерами 58 - 71 (лантаноиды) и 90 – 103 (актиноиды). Это редкоземельные металлы, обычно находящиеся в природе совместно. Разделение их осуществляется с большим трудом.
Скандий и его аналоги, каждый в своем периоде, являются первыми d – элементами, т.е. у них первых начинают заполнятся d–орбитали предвнешнего электронного слоя. Наличие лишь одного электрона в d–состоянии обуславливает малую устойчивость d1s2 – конфигурации и отражается на свойствах этих элементов. В частности, в отличие от других d – элементов скандий и его аналоги проявляют постоянную устойчивую степень окисления +3.
Важнейшие сведения о d – элементах III группы приведены в таблицах 4–6.
Таблица 4
Общие сведения
Символ элемента |
Sc |
Y |
La |
Ac |
Русское название |
Скандий |
Иттрий |
Лантан |
Актиний |
Латинское название |
Scandium |
Yttrium |
Lanthanum |
Actinium |
Автор и год открытия |
Л. Нильсон, 1879 |
Ю. Гадолин, 1794 |
К.Г. Мосандер, 1839 |
А. Дебьерн, 1899 |
Содержание в земной коре, масс. % |
610-4 |
2,810-3 |
1,810-3 |
610-10 |
Основные природные соединения |
Sc2 [ Si2O7] – тортвейтит, Sc(РО4)2Н2О - стереттит |
YРО4 – ксенотим, Y2[ Si2O7] - таленит |
(Се,La,Th,Y)РО4 – монацит, (Се,La)СО3F – бастнезит |
Присутствует в минералах урана и тория |
Таблица 5
Атомные характеристики элементов
Элемент |
Sc |
Y |
La |
Ac |
Порядковый номер |
21 |
39 |
57 |
89 |
Относительная атомная масса |
44,96 |
88,91 |
138,91 |
227,03 |
Сокращенная электронная формула |
3d1 4s2 |
4d1 5s2 |
5d1 6s2 |
6d1 7s2 |
Степень окисления элемента в соединениях |
+3 |
+3 |
+2, +3, +4 |
+3 |
Радиус атома, нм |
0,164 |
0,181 |
0,187 |
0,203 |
Радиус иона Э3+, нм |
0,075 |
0,090 |
0,103 |
0,118 |
Первый потенциал ионизации, В |
6,56 |
6,22 |
5,58 |
5,12 |
Сродство к электрону, эВ |
–0,73 |
–0,40 |
0,55 |
– |
Электороотрица - тельность |
1,20 |
1,11 |
1,08 |
1,00 |
Таблица 6
Основные физико-химические свойства
Элемент |
Sc |
Y |
La |
Ac |
Тип кристаллической решётки |
гексагональная |
гексагональная |
гексагональная |
Кубическая гранецентрированная |
Плотность, г/см3 |
2,99 |
4,47 |
6,15 |
10,10 |
Тпл., 0С |
1541 |
1522 |
921 |
1050 |
Ткип., 0С |
2831 |
3338 |
3457 |
3300 |
Электро- проводность (Нg –1) |
1,50 |
1,45 |
1,70 |
– |
Стандартная энтальпия атомизации элементов, кДж/моль |
378,9 |
422,9 |
431,2 |
385 |
Стандартная энтропия Дж/моль·К |
34,8 |
44,4 |
56,9 |
56,0 |
Стандартный электродный потенциал, В, процесса Э3+ + 3е = Э
|
–2,077 |
–2,372 |
–2,522 |
–2,600 |
