
- •1. Химия р-элементов III группы 3
- •1. Химия р-элементов III группы
- •1.1. Способы получения
- •1.2. Химические свойства
- •1.3. Бинарные соединения
- •1.3.1. Соединения с водородом
- •1.3.2. Соединения с кислородом
- •1.3.3. Галогениды
- •1.3.4. Соединения с другими элементами
- •1.4. Кислоты бора и их производные
- •1.5. Гидроксиды и их производные
- •1.6. Применение
- •2. Химия d – элементов III группы
- •2.1. Способы получения металлов
- •2.2. Химические свойства
- •2.3.4. Соединение с другими элементами
- •2.4. Гидроксиды и их производные
- •2.5. Лантаноиды
- •2.6. Актиноиды
- •2.7. Применение
- •3. Контрольные задания по теме «свойства элементов III группы»
- •4. Химия р– элементов ivгруппы
- •4.1. Способы получения
- •4.2. Химические свойства
- •4.3. Бинарные соединения
- •4.3.1. Соединения с водородом
- •4.3.2. Соединения с кислородом
- •4.3.3. Галогениды
- •4.3.4. Соединения с другими элементами
- •4.4. Кислоты, гидроксиды и их производные
- •4.5. Применение
- •5. Химия d – элементов IV группы
- •5.1. Способы получения
- •5.2. Химические свойства
- •5.3. Бинарные соединения
- •5.3.1. Соединения с водородом
- •5.3.2. Соединения с кислородом
- •5.3.3. Галогениды
- •5.3.4. Соединения с другими элементами
- •5.4. Гидроксиды, кислоты и их производные
- •5.5. Применение
- •6. Контрольные задания по теме “свойства элементов
- •IV группы”
- •7. Правила техники безопасности при работе в лаборатории
- •8. Лабораторная работа “элементы III и IV групп периодической системы” Опыт 1. Гидролиз тетрабората натрия (буры)
- •Опыт 2. Получение малорастворимого метабората
- •Опыт 3. Изучение свойств алюминия
- •Опыт 5. Гидролиз солей алюминия
- •Опыт 6. Получение дигидроксидов олова и свинца и изучение их свойств
- •Опыт 8. Нерастворимые соединения свинца и олова
- •Библиографический список
1.1. Способы получения
Технический бор получают из природного сырья в несколько стадий:
Na2B4O7∙10H2O![]() H3BO3
H3BO3![]() B2O3
B2O3![]() B
(аморфный)
B
(аморфный)
Чистый бор получают электролизом расплавленных фтороборатов, восстановлением или разложением его галогенидов, а также разложением гидридов бора:
2BBr3 + 3H2 = 2B + 6HBr
B2H6 = 2B + 3H2
Алюминий получают электролизом глинозема (Al2O3) в расплавленном криолите Na3AlF6 в присутствии флюсов AlF3, CaF2, MgF2.
Ga, In и Tl получают при переработке полиметаллических руд. При этом данные элементы выделяют в виде оксидов или хлоридов, которые затем химическим или электрохимическим способом восстанавливают до металлов.
1.2. Химические свойства
Бор – неметалл, остальные элементы – металлы. Все элементы проявляют степень окисления +3, а бор может быть отрицателен (–3). Для таллия наиболее характерна степень окисления +1.
Химия бора во многом напоминает химию кремния (правило диагонали); они близки по электроотрицательности, их гидроксиды являются слабыми кислотами, оксиды имеют высокие температуры плавления и очень устойчивы, соединения с металлами тверды и тугоплавки, соединения с водородом – летучие вещества, воспламеняющиеся на воздухе. В обычных условиях бор (подобно кремнию) весьма инертен и воздействует лишь с фтором; при нагревании окисляется кислородом, серой, галогенами, азотом. В кислотах, не являющихся окислителями, бор не растворяется. Химическая активность аморфного бора выше, чем кристаллического.
Al, Ga и In на воздухе покрыты прочной оксидной пленкой и поэтому не изменяются. Таллий же медленно окисляется.
Al – довольно активный амфотерный металл. Очищенный от оксидной пленки он легко реагирует с водой; взаимодействует с неметаллами (галогены, кислород, сера, азот, углерод, фосфор), оксидами, кислотами, щелочами, аммиаком. Пассивируется концентрированными HNO3 и H2SO4 на холоду.
Ga, In и Tl по химическим свойствам близки к алюминию, хотя щелочи на Tl не действуют.
На рисунках 1 и 2 показано взаимодействие p – элементов III группы с простыми веществами и с важнейшими реагентами.
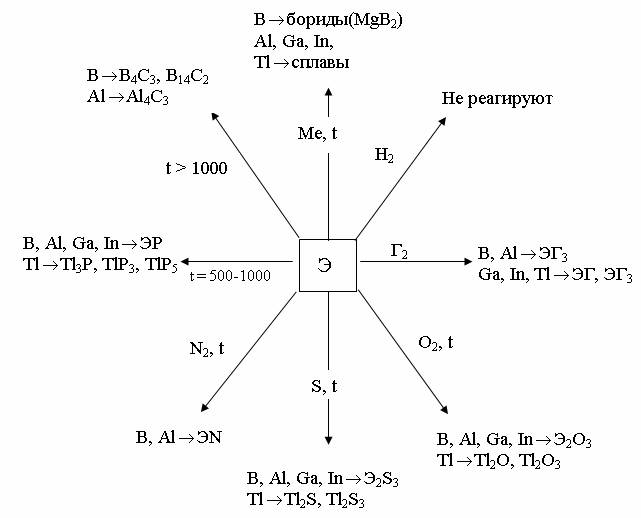
Рис. 1. Схема взаимодействия р–элементов III группы с простыми веществами
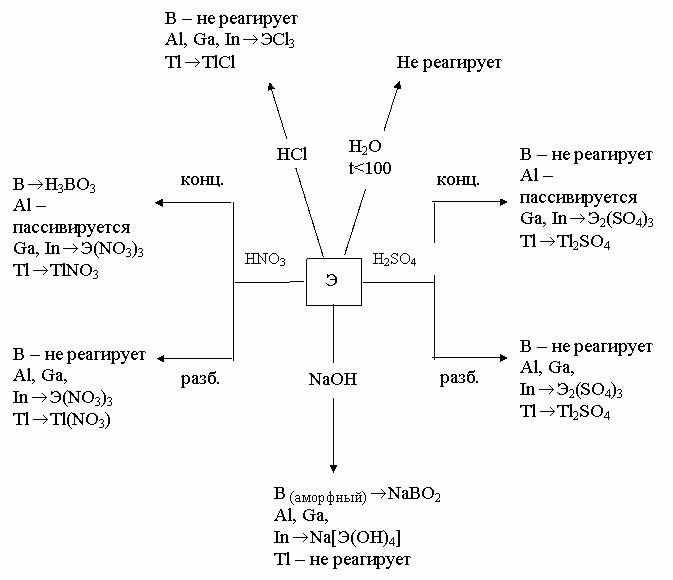
Рис. 2. Схема взаимодействия р–элементов III группы с важнейшими реагентами
Ga + 6HNO3(конц.) = Ga(NO3)3 + 3NO2 + 3H2O
2B(аморфный) + 2KOH + 2H2O = 2KBO2 + 3H2
3Te + 4HNO3(разб.) = 3TeNO3 + NO + 2H2O
![]()
1.3. Бинарные соединения
В бинарных соединениях степени окисления для бора +3 и –3, для Al, Ga, In +3, для Tl +1 и +3. Многие бинарные соединения бора похожи по свойствам на аналогичные соединения кремния.
1.3.1. Соединения с водородом
Из рассматриваемой группы элементов наиболее изучены гидриды бора (бораны). Бораны имеют различный состав, определяемый формулами BnHn+4 и BnHn+6. Обычно смесь боранов получается при действии кислот на бориды, например:
6MgB2 + 12HCl = B4H10 + 6MgCl2 + 8B + H2
Бораны очень реакционноспособны, реагируют с кислородом со взрывом, разлагаются водой, спиртами и щелочами:
B2H6 + 3O2 = B2O3 + 3H2O
B2H6 + 6H2O = 2H3BO3 + 6H2
B4H10 + 4NaOH + 12H2O = 4Na[B (OH)4] + 11H2
Известен полимерный гидрид алюминия (алан) AlH3, который получается действием AlCl3 на LiH в эфирном растворе:
AlCl3 + 3LiH = AlH3 + 3LiCl
В избытке LiH образуется тетрагидридоалюминат лития (сильный восстановитель, разлагающийся водой):
AlCl3 + 4LiH = Li[AlH4] + 3LiCl
или AlCl3 + LiH = Li[AlH4]
Li[AlH4] + 4H2O = LiOH + Al(OH)3 + 4H2
Гидриды галлия и индия ЭH3, подобно AlH3 полимерны.
