
- •1. Химия р-элементов III группы 3
- •1. Химия р-элементов III группы
- •1.1. Способы получения
- •1.2. Химические свойства
- •1.3. Бинарные соединения
- •1.3.1. Соединения с водородом
- •1.3.2. Соединения с кислородом
- •1.3.3. Галогениды
- •1.3.4. Соединения с другими элементами
- •1.4. Кислоты бора и их производные
- •1.5. Гидроксиды и их производные
- •1.6. Применение
- •2. Химия d – элементов III группы
- •2.1. Способы получения металлов
- •2.2. Химические свойства
- •2.3.4. Соединение с другими элементами
- •2.4. Гидроксиды и их производные
- •2.5. Лантаноиды
- •2.6. Актиноиды
- •2.7. Применение
- •3. Контрольные задания по теме «свойства элементов III группы»
- •4. Химия р– элементов ivгруппы
- •4.1. Способы получения
- •4.2. Химические свойства
- •4.3. Бинарные соединения
- •4.3.1. Соединения с водородом
- •4.3.2. Соединения с кислородом
- •4.3.3. Галогениды
- •4.3.4. Соединения с другими элементами
- •4.4. Кислоты, гидроксиды и их производные
- •4.5. Применение
- •5. Химия d – элементов IV группы
- •5.1. Способы получения
- •5.2. Химические свойства
- •5.3. Бинарные соединения
- •5.3.1. Соединения с водородом
- •5.3.2. Соединения с кислородом
- •5.3.3. Галогениды
- •5.3.4. Соединения с другими элементами
- •5.4. Гидроксиды, кислоты и их производные
- •5.5. Применение
- •6. Контрольные задания по теме “свойства элементов
- •IV группы”
- •7. Правила техники безопасности при работе в лаборатории
- •8. Лабораторная работа “элементы III и IV групп периодической системы” Опыт 1. Гидролиз тетрабората натрия (буры)
- •Опыт 2. Получение малорастворимого метабората
- •Опыт 3. Изучение свойств алюминия
- •Опыт 5. Гидролиз солей алюминия
- •Опыт 6. Получение дигидроксидов олова и свинца и изучение их свойств
- •Опыт 8. Нерастворимые соединения свинца и олова
- •Библиографический список
5.3.4. Соединения с другими элементами
Карбиды и нитриды элементов подгруппы титана ЭN и ЭС (переменного состава) – кристаллические вещества, очень твердые, тугоплавкие (3000 – 40000С), хорошо проводят электрический ток, химически инертны. Аналогичными свойствами обладают силициды ЭSi2, бориды ЭВ, ЭВ2 также переменного состава.
Нитриды ЭN можно получать не только прямым синтезом, но и высокотемпературным взаимодействием карбидов ЭС с азотом и водородом, а также взаимодействием оксидов ЭО2 с углем и азотом. Нитрид титана лишь при сильном нагревании реагирует с водяным паром и щелочами:
2TiN + 4H2O = 2TiO2 + 2NH3 + H2
2TiN + 4KOH + 2H2O = 2K2TiO3 + 2NH3 + H2
Карбиды ЭС получают высокотемпературным синтезом и взаимодействием ЭО2 с углеродом. При высокой температуре карбиды реакционноспособны, например:
2TiC + N2 + H2 = 2TiN + C2H2
Известен сульфид TiS, образующийся при восстановлении TiS2 и Ti2S3 водородом, а также при восстановлении TiCl4 сероводородом.
5.4. Гидроксиды, кислоты и их производные
Гилроксиды Э (IV) – белые студенистые осадки переменного состава ЭО2∙хН2О. Они образуются при гидролизе тетрагалогенидов или при обработке их растворами щелочей. Гидроксид титана (IV) растворим в концентрированных щелочах; гидроксиды циркония (IV) и графния (IV) со щелочами практически не взаимодействуют.
Вследствие амфотерности гидратированные диоксиды ЭО2∙хН2О иногда записывают в виде кислот, например:
при
х = 2 ― H4TiO4
−
ортотитановая
![]() кислота,
кислота,
соли – ортотитанаты;
при
х = 1 ― H2TiO3
– метатитановая
![]() кислота,
кислота,
соли – титанаты.
α- кислоты растворяются в минеральных кислотах; β- кислоты химически более инертны и растворяются только в HF и при нагревании в концентрированной H2SO4. При длительном хранении H4TiO4 переходит в H2TiO3. При сплавлении со щелочами H2TiO2 образует в зависимости от количества щелочи орто- , мета - или полититанаты.
При взаимодействии оксидов или гидроксидов элементов группы IV B с кислотами образуются не средние соли, а соответствующие оксо – и гидроксопроизводные, например:
Ti (OH)4 + 2HCl = TiOCl2 + 3H2O
TiO2 + H2SO4 = TiOSO4 + H2O
Соединения простого состава получают лишь в неводных растворах. Так, Ti(SO4)2 образуется при взаимодействии TiCl4 и SO3 в жидком хлориде сульфурила SO2Cl2 или сплавлением TiO2 с дисульфатом:
TiCl4 + 4SO3 = Ti(SO4)2 + 2SO2Cl2
TiO2 + 2K2S2O7 = Ti (SO4)2 + 2K2SO4
Для всех рассматриваемых элементов очень характерно комплексообразование с галогенводородными кислотами и, особенно, с их солями. Наиболее характерны комплексы общей формулы Ме2[ЭГ6], где Ме – одновалентный металл. Они хорошо кристаллизируются и гораздо менее подвергаются гидролизу, чем исходные галогениды.
ЭF4 + 2KF = K2[ЭF6]
ЭO2 + 6HF = H2[ЭF6] + 2H2O
Производные других анионных комплексов Э(IV) обычно образуются при сплавлении соответствующих соединений, например:
ЭCl4 + 2KCl = K2ЭCl6
ЭO2 + 2KOH = K2ЭO3 + H2O
TiO2 + CaCO3 = CaTiO3 + CO2
Состав оксотитанатов (IV), оксоцирконатов (IV) и оксогафнатов (IV) весьма разнообразен. Простейшие из них отвечают формулам МеЭО3 (Ме – одновалентный металл), Ме2ЭО4 (Ме – двухвалентный металл). Большинство оксосолей представляют собой смешанные оксиды. В воде они не растворяются, а производные щелочных металлов гидролизуются.
Степень окисления +3 отчетливо проявляется лишь у титана. Производные Тi(III) получают восстановлением соединений Тi(IV), например:
2TiCl4 + H2 = 2TiCl3 + 2HCl
Производные Тi(III) – восстановители. Они легко окисляются кислородом воздуха, диоксидом серы:
4TiCl3 + О2 + 2Н2О = 4TiОCl2 + 4HCl
4TiCl3 + 4HCl + SО2 + 6Н2О = 4 [Ti(H2О)2Cl4] + S
На рис. 15 показана взаимосвязь между основными типами соединений на примере титана.
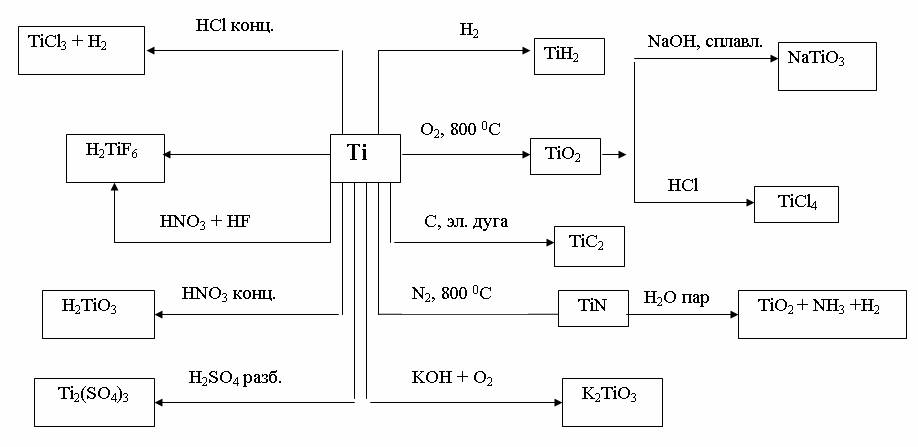
Рис. 15. Химические свойства титана и его соединений
