
- •1. Химия р-элементов III группы 3
- •1. Химия р-элементов III группы
- •1.1. Способы получения
- •1.2. Химические свойства
- •1.3. Бинарные соединения
- •1.3.1. Соединения с водородом
- •1.3.2. Соединения с кислородом
- •1.3.3. Галогениды
- •1.3.4. Соединения с другими элементами
- •1.4. Кислоты бора и их производные
- •1.5. Гидроксиды и их производные
- •1.6. Применение
- •2. Химия d – элементов III группы
- •2.1. Способы получения металлов
- •2.2. Химические свойства
- •2.3.4. Соединение с другими элементами
- •2.4. Гидроксиды и их производные
- •2.5. Лантаноиды
- •2.6. Актиноиды
- •2.7. Применение
- •3. Контрольные задания по теме «свойства элементов III группы»
- •4. Химия р– элементов ivгруппы
- •4.1. Способы получения
- •4.2. Химические свойства
- •4.3. Бинарные соединения
- •4.3.1. Соединения с водородом
- •4.3.2. Соединения с кислородом
- •4.3.3. Галогениды
- •4.3.4. Соединения с другими элементами
- •4.4. Кислоты, гидроксиды и их производные
- •4.5. Применение
- •5. Химия d – элементов IV группы
- •5.1. Способы получения
- •5.2. Химические свойства
- •5.3. Бинарные соединения
- •5.3.1. Соединения с водородом
- •5.3.2. Соединения с кислородом
- •5.3.3. Галогениды
- •5.3.4. Соединения с другими элементами
- •5.4. Гидроксиды, кислоты и их производные
- •5.5. Применение
- •6. Контрольные задания по теме “свойства элементов
- •IV группы”
- •7. Правила техники безопасности при работе в лаборатории
- •8. Лабораторная работа “элементы III и IV групп периодической системы” Опыт 1. Гидролиз тетрабората натрия (буры)
- •Опыт 2. Получение малорастворимого метабората
- •Опыт 3. Изучение свойств алюминия
- •Опыт 5. Гидролиз солей алюминия
- •Опыт 6. Получение дигидроксидов олова и свинца и изучение их свойств
- •Опыт 8. Нерастворимые соединения свинца и олова
- •Библиографический список
5.2. Химические свойства
Ti, Zr и Hf на холоду весьма устойчивы вследствие образования на поверхности тонкой, но очень прочной плёнки оксида ЭО2. Они медленно реагируют только с HF и смесью HF и HNO3:
Э + 6HF = H2[ЭF6] + 2H2
3Э + 4HNO3 + 18HF = 3H2[ЭF6] + 4NO + 8H2O
При нагревании и в порошкообразном состоянии химическая активность металлов сильно возрастает, и они интенсивно реагируют с кислородом, галогенами, серей и другими простыми веществами, давая соединения часто переменного состава. Все три металла при этих условиях могут реагировать с водяным паром и концентрированной Н2SO4, а титан – ещё и с соляной и концентрированной азотной кислотами:
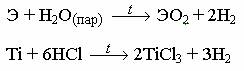
3Ti + 4HNO3 (конц.) + H2O = 3H2TiO3 (TiO2∙H2O) + 4NO
Таблица 11
Общие сведения
Символ элемента |
Ti |
Zr |
Hf |
Ku |
Русское название |
Титан |
Цирконий |
Гафний |
Курчатовий |
Латинское название |
Titanium |
Zirconium |
Hafnium |
Kurchatovium |
Автор и год открытия |
М.Г. Клапрот, 1795 |
М.Г. Клапрот, 1789 |
Д. Хевеши, Д. Костер, 1923 |
Г.Н. Флеров и др. 1964 |
Содержание в земной коре, масс. % |
0,63 |
1,7∙10-2 |
3,2 ∙ 10-4 |
– |
Основные природные соединения |
TiO2 – рутил, брукит, анатаз, FeTiO3 – ильменит, FeTiO3 ∙ xFe3O4 – титаномагнетит |
ZrO2 – бадделеит, ZrSiO4 – циркон |
Сопутствует цирконию в его минералах (от 0,5 до 4 %) |
|
Таблица 12
Атомные характеристики элементов.
Элемент |
Ti |
Zr |
Hf |
Ku |
Порядковый номер |
22 |
40 |
72 |
104 |
Относительная атомная масса |
47,88 |
91,22 |
178,49 |
261,11 |
Сокращенная электронная формула |
3d24s2 |
4d25s2 |
5d26s2 |
6d27s2 |
Степень окисления элемента в соединениях |
+4, +3, +2 |
+4, +3 |
+4, +3. |
+4 |
Радиус атома, нм |
0,146 |
0,160 |
0,159 |
0,160 |
Радиус иона Э4+, нм |
0,064 |
0,082 |
0,082 |
0,078 |
Первый потенциал ионизации, В |
6,82 |
6,84 |
7,50 |
− |
Сродство к электрону, эВ |
0,63 |
1,13 |
0,15 |
− |
Электроотрицательность |
1,32 |
1,23 |
1,33 |
− |
Таблица 13
Основные физико-химические свойства
Элемент |
Ti |
Zr |
Hf |
Ku |
Тип кристаллической решетки |
Гексагональная |
|||
Плотность, г/см3 |
4,54 |
6,51 |
13,31 |
(18) |
Тпл., 0 С |
1668 |
1855 |
2230 |
(2100) |
Ткип, 0 С |
3330 |
4377 |
5197 |
(5550) |
Электропроводимость (Hg −1) |
1,65 |
2,10 |
2,30 |
− |
Стандартная энтальпия атомизации элементов, кДж/моль |
471,4 |
608,3 |
619,2 |
− |
Стандартная энтропия, Дж/моль ∙ К |
30,6 |
39,0 |
43,6 |
− |
Стандартный электродный потенциал, В, процессов Э+3 + 3е = Э Э+4 + 4е = Э ЭО2 + 4Н+ + 4е = = Э + 2Н2О |
−1,21 −
−0,36
|
− −1,53
−1,55
|
− −1,70
−1,57
|
− −
− |
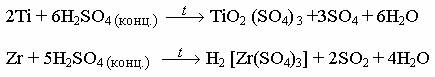
В своей подгруппе титан наиболее активен.
На рис. 13 и 14 схематично показано взаимодействие элементов группы IV B с простыми веществами и важнейшими реагентами.
