
- •1. Химия р-элементов III группы 3
- •1. Химия р-элементов III группы
- •1.1. Способы получения
- •1.2. Химические свойства
- •1.3. Бинарные соединения
- •1.3.1. Соединения с водородом
- •1.3.2. Соединения с кислородом
- •1.3.3. Галогениды
- •1.3.4. Соединения с другими элементами
- •1.4. Кислоты бора и их производные
- •1.5. Гидроксиды и их производные
- •1.6. Применение
- •2. Химия d – элементов III группы
- •2.1. Способы получения металлов
- •2.2. Химические свойства
- •2.3.4. Соединение с другими элементами
- •2.4. Гидроксиды и их производные
- •2.5. Лантаноиды
- •2.6. Актиноиды
- •2.7. Применение
- •3. Контрольные задания по теме «свойства элементов III группы»
- •4. Химия р– элементов ivгруппы
- •4.1. Способы получения
- •4.2. Химические свойства
- •4.3. Бинарные соединения
- •4.3.1. Соединения с водородом
- •4.3.2. Соединения с кислородом
- •4.3.3. Галогениды
- •4.3.4. Соединения с другими элементами
- •4.4. Кислоты, гидроксиды и их производные
- •4.5. Применение
- •5. Химия d – элементов IV группы
- •5.1. Способы получения
- •5.2. Химические свойства
- •5.3. Бинарные соединения
- •5.3.1. Соединения с водородом
- •5.3.2. Соединения с кислородом
- •5.3.3. Галогениды
- •5.3.4. Соединения с другими элементами
- •5.4. Гидроксиды, кислоты и их производные
- •5.5. Применение
- •6. Контрольные задания по теме “свойства элементов
- •IV группы”
- •7. Правила техники безопасности при работе в лаборатории
- •8. Лабораторная работа “элементы III и IV групп периодической системы” Опыт 1. Гидролиз тетрабората натрия (буры)
- •Опыт 2. Получение малорастворимого метабората
- •Опыт 3. Изучение свойств алюминия
- •Опыт 5. Гидролиз солей алюминия
- •Опыт 6. Получение дигидроксидов олова и свинца и изучение их свойств
- •Опыт 8. Нерастворимые соединения свинца и олова
- •Библиографический список
4.5. Применение
Углерод широко применяется в металлургии как восстановитель. Графитовые электроды применяют в электрометаллургии и электрохимических производствах. Графит используется в атомной энергетике (замедлитель нейтронов) и электротехнике (электрощетки в моторах и др.). Активный уголь – как абсорбент, сажа – наполнитель резиновых смесей.
Кремний – добавка к сплавам. Кремний находит применение в так называемых кремниевых приборах (радиоэлектроника, вычислительная техника, электроника и т.д.).
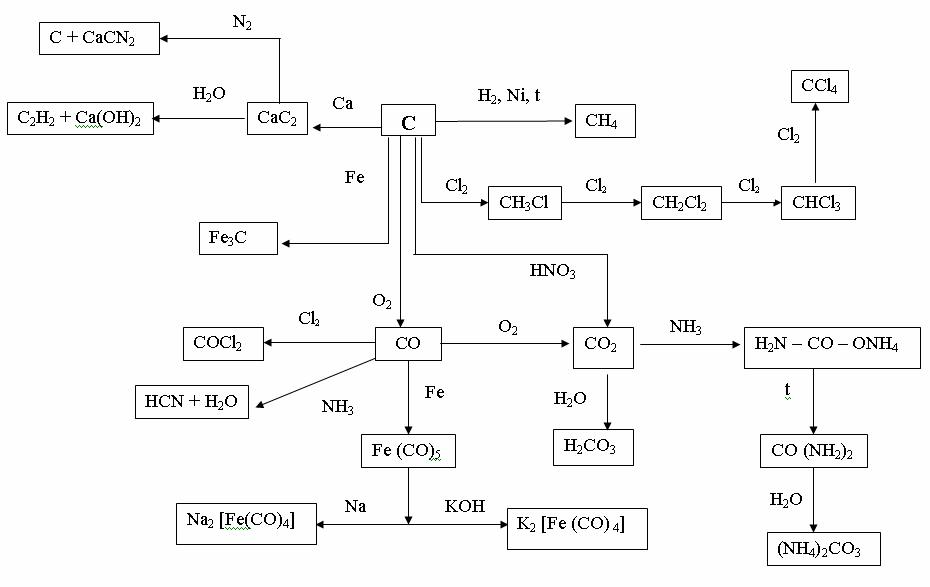
Рис. 11. Химические свойства углерода и его соединений
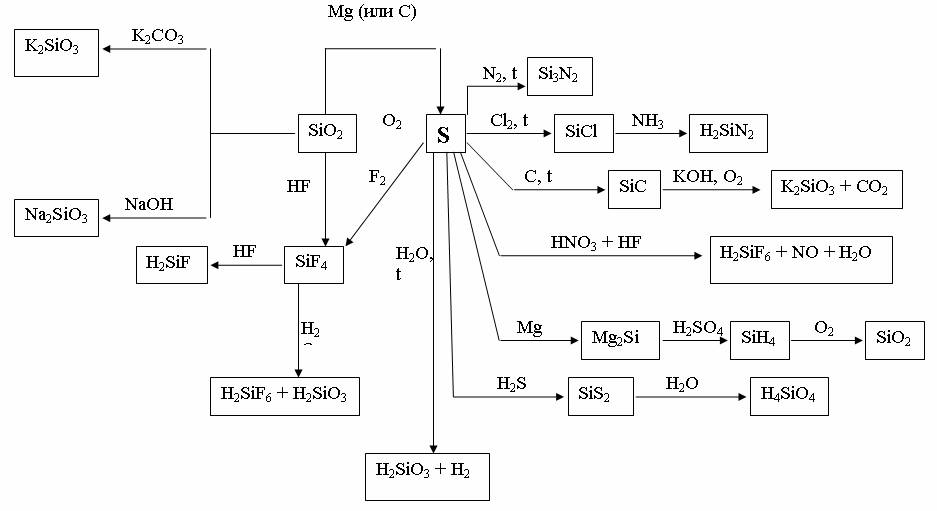
Рис. 12. Химические свойства кремния и его соединения
Карбид SiC по твердости уступает только алмазу, поэтому используется как абразив, а также как полупроводник. Широко применяется кварцевое стекло SiO2.
Германий используется как полупроводник. На основе GeO2 готовят специальные оптические стекла.
Олово применяется для производства различных сплавов и белой жести для консервной промышленности.
Свинец – в свинцовых аккумуляторах, в производстве кабелей, в антифрикционных и типографских сплавах, в атомной энергетике и рентгенотехнике как поглотитель излучений. PbO2 применяется в производстве красок и хрусталя.
5. Химия d – элементов IV группы
В IV группу побочную подгруппу (подгруппу титана) входят элементы Ti, Zr, Hf, Ku, являющиеся полными электронными аналогами (электронная конфигурация (n - 1)d2ns2). По свойствам данные элементы похожи на элементы подгруппы скандия, но отличаются тем, что обычно они четырехвалентны, за исключением титана, который может образовывать соединения со степенью окисления +3, и +2.
В отличие от элементов подгруппы германия в подгруппе титана с ростом атомного номера устойчивая степень окисления повышается. Для титана характерно координационное число 6 и реже 4, для Zr и Hf – 7 и 8.
По физическим свойствам элементы подгруппы титана являются металлами серебристо-белого цвета. Чистые металлы хорошо поддаются механической обработке, однако даже следы поглощения газов сообщают им хрупкость. Ti относится к легким, а Zr и Hf – к тяжелым металлам. Все они тугоплавки и имеют одинаковый тип кристаллической решетки.
В таблицах 11 – 13 представлены важнейшие сведения о d – элементах IV группы.
5.1. Способы получения
Вначале руду переводят в оксид или галогенид, а затем восстанавливают Ti, Zr или Hf методом металлотермии в атмосфере инертных газов из-за высокой химической активности этих металлов при высокой температуре:
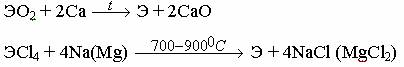
Zr или Hf получают также натрий-термическим восстановлением комплексных фторидов:
K2[ЭГ6] + 4Na = Э + 2KF + 4NaF
Высокочистые металлы – термическим разложением тетраноидов в вакууме:
![]()
Разделение циркония и гафния осуществляется труднее, чем любых соседних элементов, включая лантаноиды, т.к. их химические свойства ближе друг к другу, чем у всех остальных пар родственных элементов. Химическое сродство Zr и Hf обусловлено близкими значениями радиусов атомов и ионов (см. табл. 12). Для отделения Zr от Hf наиболее широко применяют селективную экстракцию.
Ku получают ядерным синтезом.
