
- •Методические указания к проведению занятия
- •Начало формы
- •Фармакокинетика
- •Фармакогенетика
- •Показания и доказательная база. «перспективные» показания
- •Принципы выбора отдельных лс данной группы в различных клинических ситуациях
- •Противопоказания
- •Нежелательные лекарственные реакции и методы контроля за безопасностью
- •Фармакодинамические
- •Применение в особых ситуациях
- •Перспективные разработки
- •Литература
- •Конец формы
УРАЛЬСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Кафедра внутренних болезней, клинической фармакологии и
эндокринологии
«УТВЕРЖДАЮ»
Зав. кафедрой внутренних болезней,
клинической фармакологии и эндокринологии
Профессор ________________О.Г.Смоленская
«_____»________________2010г.
МЕТОДИЧЕСКАЯ РАЗРАБОТКА К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ
(для преподавателей)
Факультет лечебно-профилактический
Тема занятий: Клиническая фармакология НПВС и ГКС.
Екатеринбург, 2011
Факультет лечебно-профилактический. Курс V Семестр___________
Занятие №
1. ТЕМА ЗАНЯТИЯ: Клиническая фармакология НПВС, ГКС.
2. УЧЕБНАЯ ЦЕЛЬ ЗАНЯТИЯ: Изучить клиническую фармакологию НПВС, ГКС.
3. ЗАДАЧИ ЗАНЯТИЯ:
- изучить клиническую фармакологию НПВС, особенности использования в различных клинических ситуациях;
- изучить клиническую фармакологию ГКС, особенности использования в различных клинических ситуациях;
- на примере какого-либо воспалительного заболевания научиться осуществлять выбор конкретного эффективного и безопасного лекарственного средства;
- определять оптимальный режим дозирования, выбирать лекарственную форму препарата, дозу, кратность, длительность введения НПВС, ГКС;
- выбирать методы контроля за эффективность и безопасностью применения средств и предсказать риск развития нежелательных лекарственных реакций;
- давать рекомендации по профилактике нежелательных лекарственных реакций;
- предложить рациональную замену «устаревшим» препаратам согласно принципам доказательной медицины.
4. ПРОДОЛЖИТЕЛЬНОСТЬ ЗАНЯТИЯ (в академических часах) – 4 часа.
5. ОСНАЩЕНИЕ ЗАНЯТИЯ:
- история болезни тематического больного, лист назначения и другая медицинская документация;
- рецептурные справочники, проспекты и аннотации на изучаемые лекарственные средства;
- таблицы, слайды;
- ситуационные задачи.
6. ПЛАН ПРОВЕДЕНИЯ ЗАНЯТИЯ И БЮДЖЕТ УЧЕБНОГО ВРЕМЕНИ:
- организационный момент – 5 минут;
- опрос контроль исходного уровня знаний – 30 минут;
- демонстрация больных – 60 минут;
- разбор темы занятия - 60 минут;
- подведение итогов занятия – 20 минут;
- задание к следующему занятию – 5 минут.
Методические указания к проведению занятия
Перед разбором материала студенты, курирующие тематических больных, докладывают о своих пациентах. Затем в процессе разбора темы решается вопрос о рациональности использования НПВС/ГКС у курируемых пациентов, выявляются факторы риска НЛР, решается вопрос о необходимости профилактики и лечении развившихся НЛР, производится подбор наиболее рационального лечения для каждого пациента с учетом возраста, тяжести основного заболевания, наличия сопутствующих заболеваний, лекарственной непереносимости и прочих состояний влияющих на выбор лечения.
Начало формы
Нестероидные противовоспалительные препараты — группа лекарственных средств, обладающих обезболивающим, противовоспалительным и жаропонижающим эффектом. Основное фармакологическое действие НПВП связано с подавлением синтеза провоспалительных простагландинов в очаге тканевого повреждения. В настоящее время НПВП чрезвычайно широко используются практически во всех отраслях медицины и особенно широко в ревматологии. Так, по данным систематических опросов, большинство российских и западных ревматологов считают НПВП эффективным и необходимым средством для терапии РЗ. В настоящее время в класс НПВП входит около 20 лекарственных средств, по химической структуре подразделяемых на несколько групп: производные салициловой, индоловой, гетероарилуксусной, пропионовой, энолиоковой кислот и др. Следует отметить, что «химическая» классификация не имеет большого практического значения, поскольку молекулярная структура препарата не позволяет прогнозировать его клиническую эффективность и токсичность. Химические свойства. По химической структуре НПВП в своем большинстве представляют слабые органические кислоты. Некоторые из них, например, набуметон, являются предшественниками активного препарата с кислотными свойствами (пролекарствами). Классификация. Существует несколько классификаций НПВП. В зависимости от выраженности противовоспалительной активности и химической структуры НПВП подразделяются следующим образом: 1. НПВС с выраженной противовоспалительной активностью
2. НПВС со слабой противовоспалительной активностью
3. Комбинированные препараты
Основное фармакологическое действие НПВП связано с подавлением активности циклооксигеназы (ЦОГ) — фермента, ответственного за метаболизм производных арахидоновой кислоты и синтез простагландинов, простациклина (ПГI2) и тромбоксана (ТхА2). Существуют две основные изоформы ЦОГ: ЦОГ-1 и ЦОГ-2 (кроме того, выделены ЦОГ – 3 (в ЦНС), ЦОГ – 4,5 (физиологическая роль не установлена). Первый фермент постоянно присутствует в большинстве тканей и необходим для поддержания тканевого гомеостаза, второй фермент в норме в большинстве тканей не обнаруживают, но его уровень значительно увеличивается в очагах тканевого повреждения в ответ на выброс провоспалительных медиаторов и цитокинов. Блокаду ЦОГ-2 рассматривают как один из важных механизмов противовоспалительной и анальгетической активности НПВП, а блокаду ЦОГ-1 — как причину развития нежелательных эффектов. Помимо блокады ЦОГ, эффективность НПВП может быть связана с другими механизмами: подавлением функции нейтрофилов (в частности, опосредованным блокадой фосфодиэстеразы), нарушением взаимодействия лейкоцитов с эндотелием сосудов, подавлением активации фактора транскрипции NF-κВ (регулятор синтеза провоспалительных медиаторов), центральными антиноцицептивными эффектами, антигистаминным действием, блокадой синтеза металлопротеиназ, влиянием на процессы апоптоза и т.д. Следует отметить, что «структурный» фермент ЦОГ-1, по современным представлениям, также играет определённую роль в развитии воспаления, поэтому его блокада в очагах тканевого повреждения может иметь значение для развития анальгетического и противовоспалительного эффекта НПВП.
НПВП имеют ряд общих химических и фармакологических свойств, их условно подразделяют на короткоживущие (T½ <6 ч) и длительно живущие (T½ >6 ч). Однако чёткой связи между Т½ НПВП в плазме и клинической эффективностью НПВП при их длительном приёме проследить не удалось: это связано с тем, что короткоживущие препараты накапливаются и длительно присутствуют в зоне воспаления, например в полости сустава. Основные представители группы НПВП и их фармакологические свойства представлены в табл.1.
Таблица 1. Общая характеристика нестероидных противовоспалительных средств
Наибольшее значение для клинической практики имеет разделение НПВП на два основных класса, в зависимости от селективности в отношении ЦОГ-2, — на неселективные и селективные НПВП. Некоторые исследователи выделяют среди селективных НПВП подгруппу высокоселективных препаратов (так называемые «коксибы»), в РФ зарегистрированы из этой группы 2 представителя — целекоксиб (целебрекс), эторикоксиб (аркоксия) (табл.2).
Таблица2. Классификация нестероидных противовоспалительных средств в зависимости от селективности в отношении ЦОГ-2
*Применение приостановлено. **Не зарегистрированы в РФ.
ЭФФЕКТИВНОСТЬ Системное действие НПВП возможно при приёме внутрь, назначении ректальных свечей и использовании инъекционных форм. Для лечения хронических РЗ наиболее удобно использовать формы НПВП для приёма внутрь. Нет чётких данных, имеют ли ректальные свечи какие-либо преимущества в скорости наступления или выраженности лечебного действия перед приёмом НПВП внутрь, поэтому целесообразно использовать их лишь для того, чтобы уменьшить риск развития диспепсии, связанной с контактным раздражающим эффектом этих препаратов. Применение инъекционных форм НПВП показано только для кратковременного (не долее трёх дней) лечения острых болей. При более длительном использовании современные формы НПВП для приёма внутрь, обладающие высокой биодоступностью, оказывают столь же выраженный анальгетический эффект. Важно отметить, что использование инъекционных форм не снижает риска развития системных нежелательных эффектов НПВП, однако возникает вероятность развития локальных постинъекционных осложнений. Поэтому длительное использование инъекционных форм НПВП у больных с РЗ нецелесообразно, его нужно считать порочной практикой. В настоящее время существует серьёзная доказательная база, подтверждающая эффективность локальных форм НПВП (кремы и мази) для симптоматической терапии остеоартроза коленных суставов и суставов кистей, а также воспалительных заболеваний мягких тканей. По данным рандомизированных контролируемых испытаний (РКИ), мази с НПВП достоверно превосходят по своему действию плацебо, относительно редко вызывают местные и системные нежелательные эффекты, их хорошо переносят больные, тем не менее в реальной клинической практике локальное назначение НПВП обычно рассматривают как метод вспомогательной терапии и применяют при умеренно или слабо выраженных болях, для повышения анальгетического эффекта при системном назначении НПВП или для снижения суммарной системной дозы НПВП при недостаточно хорошей переносимости или риске развития нежелательных эффектов. Эффективность системного назначения НПВП при ревматических заболеваниях хорошо доказана. При этом НПВП более эффективны, чем парацетамол. Данные РКИ, в которых сравнивали эффективность и безопасность неселективных и селективных НПВП, показали, что при РА длительное использование препаратов этой группы приводит к значимому уменьшению выраженности боли и улучшению общего самочувствия у 60–70% больных. В то же время применение НПВП при РА следует рассматривать как преимущественно симптоматический метод лечения, поскольку даже при длительном использовании в высоких дозах эти препараты не замедляют прогрессирование заболевания. НПВП — препараты «первой линии» для купирования боли и воспаления при анкилозирующем спондилоартрите, имеющие хорошо доказанный клинический эффект. Кроме того, в единичных клинических работах было показано, что многолетний непрерывный приём НПВП способен замедлить прогрессирование рентгенологических изменений в позвоночнике. НПВП относят к препаратам выбора для фармакотерапии таких РЗ, как боль внизу спины и поражения мягких тканей ревматической природы (плечелопаточный периартрит, тендиниты, бурситы и др.). Рациональное использование НПВП при этих патологических состояниях в качестве монотерапии в ряде случаев позволяет добиться полного уменьшения выраженности болей в суставах. Особое значение имеет применение НПВП для купирования острого подагрического артрита, при котором использование высоких противовоспалительных доз НПВП рассматривают как наиболее целесообразный и эффективный способ терапевтического вмешательства. При остеоартрозе использование НПВП в составе комплексной терапии позволяет достичь быстрого симптоматического улучшения и тем самым обеспечить больному комфортное ожидание начала действия «хондропротекторов» и немедикаментозных методов лечения. Использование в качестве симптоматического средства парацетамола, рекомендованного Европейской антиревматической лигой и Американской коллегией ревматологов в качестве препарата «первой линии» для лечения остеоартроза, не позволяет достичь столь значимого лечебного действия. Серия РКИ доказала, что у больных с остеоартрозом НПВП при длительном применении в небольших дозах значительно более эффективны, чем высокие дозы парацетамола (4 г/сут). Симптоматическое действие при назначении НПВП (целекоксиб) может быть выше, чем при использовании «хондропротекторов». Имеются теоретические обоснования патогенетического эффекта НПВП при остеоартрозе, а также клинические данные, подтверждающие замедление деструкции хряща при использовании отдельных препаратов из группы НПВП, тем не менее целесообразность назначения НПВП при остеоартрозе в качестве патогенетического средства при отсутствии клинической симптоматики не определена. До настоящего времени актуальным остаётся вопрос о различии в терапевтической эффективности отдельных НПВП. По данным РКИ, все препараты этой группы в эквивалентных дозах оказывают одинаковое лечебное действие. Важно отметить, что селективные НПВП не уступают по своему анальгетическому эффекту неселективным НПВП, в том числе при острых болях. В то же время клинический опыт свидетельствует о существенных вариациях в «ответе» у отдельно взятых пациентов при использовании различных препаратов из группы НПВП. Это может определяться индивидуальными особенностями фармакодинамики различных препаратов, в частности биодоступностью, скоростью наступления пиковой концентрации, скоростью метаболизма и способностью накапливаться в очагах воспаления в более высокой концентрации, чем в плазме крови. Для индивидуальных препаратов, являющихся рацемическими смесями, важно соотношение D- и S-оптических изомеров с различной биологической активностью. Опредёленное значение также может иметь наличие у некоторых НПВП независимых от блокады ЦОГ механизмов действия. Большинство клинических работ, показавших хороший эффект НПВП, предполагало непрерывное использование этих препаратов в средних или высоких терапевтических дозах. Нет чётких данных о том, насколько эффективно при РЗ использование низких доз НПВП в режиме «по требованию». С другой стороны, нет убедительных доказательств, подтверждающих более мощное анальгетическое и противовоспалительное действие при использовании «супратерапевтических» доз НПВП. Поэтому использовать эти препараты в дозах, превышающих рекомендованные, нецелесообразно, особенно если учесть, что повышение дозы закономерно сопровождается ростом частоты нежелательных эффектов. ПОБОЧНЫЕ ЭФФЕКТЫ Высокий лечебный потенциал НПВП ограничен вероятностью развития различных нежелательных эффектов. У некоторых пациентов опасные осложнения могут возникать даже при кратковременном приёме небольших доз НПВП, что привлекает большое внимание к проблеме безопасности этого класса противоревматических средств. При этом наиболее частые из нежелательных эффектов НПВП, такие, как поражение ЖКТ, нарушение агрегации тромбоцитов, функции почек, негативное влияние на систему кровообращения, связаны с подавлением активности «физиологического» изомера ЦОГ (ЦОГ-1), т.е. они класс-специфические. Иные побочные эффекты НПВП, развитие которых, очевидно, не связано с ингибированием синтеза простагландинов, встречаются гораздо реже и не имеют столь важного клинического значения (табл. 3).
Таблица 3. Побочные эффекты нестероидных противовоспалительных средств
ПОРАЖЕНИЕ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА Приём НПВП может вызывать повреждение слизистой оболочки верхних отделов ЖКТ с развитием эрозий, язв и их осложнений: желудочно-кишечного кровотечения, перфорации язвы и нарушением проходимости ЖКТ. Эти патологические состояния объединены исторически сложившимся термином «НПВП-гастропатия». Помимо НПВП-гастропатии, приём НПВП может приводить к обострению и развитию осложнений гастроэзофагеальной рефлюксной болезни, вызывать различные диспепсические симптомы, а также поражение тонкой и толстой кишки. НПВП-ГАСТРОПАТИЯ Центральное звено патогенеза НПВП-гастропатии — блокада ЦОГ-1 и подавление синтеза «цитопротективных» простагландинов, приводящая к существенному снижению защитного потенциала слизистой оболочки и провоцирующая её повреждение соляной кислотой и пепсином, которые содержатся в желудочном соке. Другими факторами негативного воздействия НПВП считают уменьшение агрегации тромбоцитов, микроциркуляторные нарушения, блокаду ферментных систем митохондрий клеток слизистой оболочки, блокаду NO-синтетазы, усиление клеточного апоптоза, влияние на желудочную секрецию, нарушение репаративных процессов вследствие блокады ЦОГ-2 и др. До настоящего времени не совсем ясно значение инфекции H. pylori в патогенезе НПВП-гастропатии. Этот микроорганизм обнаруживают у 40–80% больных РЗ в зависимости от исследуемой популяции. Возможно, инфицирование H. pylori увеличивает вероятность развития НПВП-индуцированных язв, эрозий и желудочно-кишечного кровотечения, однако НПВП-гастропатия может возникать и у больных, не инфицированных H. pylori. По данным РКИ, эрадикация H. pylori перед началом приёма НПВП значительно уменьшает риск развития язв и эрозий, однако не влияет на частоту рецидивов НПВП-индуцированных язв и желудочно-кишечного кровотечения. НПВП не вызывают гастроэзофагеальный рефлюкс и не влияют на антирефлюксные механизмы защиты пищевода. В то же время существуют данные о том, что у больных, страдающих гастроэзофагеальным рефлюксом, приём НПВП может способствовать развитию пептического повреждения слизистой оболочки пищевода с развитием эзофагита, эрозий и язв, а также способствовать формированию пептической стриктуры. Риск развития желудочно-кишечных кровотечений и перфорации язвы у больных, регулярно принимающих НПВП, возрастает по сравнению с популяцией более чем в 4 раза (примерно 1 случай на 100 пациентов-лет). Больные, регулярно принимающие НПВП, погибают от подобных осложнений примерно в 2 раза чаще, чем лица, не получающие НПВП и/или низких доз ацетилсалициловой кислоты. При эндоскопическом контроле язвы желудка и/или двенадцатиперстной кишки обнаруживают у 15–40% и более больных, регулярно принимающих Н-НПВП. По результатам исследования, проведённого в Институте ревматологии РАМН (1996–2006), при эзофагогастродуоденоскопии среди 6103 первичных больных РЗ, принимавших НПВП, у 763 (12,5%) были диагностированы язвы желудка и/или двенадцатиперстной кишки. С помощью серии эпидемиологических исследований было показано, что неселективные НПВП существенно различаются в отношении негативного влияния на ЖКТ. Это различие может быть связано с различной селективностью неселективных НПВП в отношении ЦОГ-2 (чем выше селективность, тем ниже токсичность). Так, согласно данным метаанализа D. Henry (1994), риск развития желудочно-кишечных кровотечений возрастает следующим образом: ибупрофен <диклофенак <напроксен <индометацин <пироксикам. Более поздние эпидемиологические исследования (по типу «случай–контроль») также свидетельствуют о наиболее низком риске поражения ЖКТ при использовании терапевтических доз ибупрофена и диклофенака. Следует отметить, что данные о бόльшей безопасности ибупрофена основаны на оценке применения низких, анальгетических доз этого препарата (до 1200 мг/сут). При использовании высоких противовоспалительных доз ибупрофена (до 2400 мг/сут) риск развития опасных осложнений значительно возрастает и приближается к индометацину. По данным ряда популяционных исследований, наиболее высокий риск развития желудочно-кишечных кровотечений возникает при использовании кеторолака. Однако результаты масштабного РКИ (n=11 245) показали, что при кратковременном приёме кеторолака (2 дня парентерально и 5 — перорально) у больных после хирургических операций частота опасных осложнений со стороны ЖКТ не выше, чем при использовании диклофенака и кетопрофена в аналогичном режиме. Ацетилсалициловая кислота в низких дозах, используемая для профилактики сосудистых тромбозов, также способна вызывать развитие серьёзных осложнений со стороны ЖКТ, прежде всего кровотечений. По данным метаанализа (24 РКИ, n=66 000), частота желудочно-кишечных кровотечений при приёме низких доз ацетилсалициловой кислоты более чем в 1,5 раза выше, чем у лиц, не получающих ацетилсалициловой кислоты и других НПВП. Комбинация низких доз ацетилсалициловой кислоты с селективными или неселективными НПВП значительно увеличивает риск серьёзных осложнений со стороны ЖКТ, и поэтому её считают одним из наиболее важных факторов риска НПВП-гастропатии. Однако в другом исследовании, проведённом с участием здоровых добровольцев, было доказано, что комбинация целекоксиба и низких доз ацетилсалициловой кислоты (81 мг) гораздо реже вызывает развитие эндоскопических язв по сравнению с аналогичной комбинацией напроксена. Эти данные подтверждают результаты популяционных исследований, согласно которым у больных, получающих целекоксиб вместе с низкими дозами ацетилсалициловой кислоты, серьёзные осложнения со стороны ЖКТ возникают практически вдвое реже, чем у больных, получающих Н-НПВП и низкие дозы ацетилсалициловой кислоты. Уменьшение риска развития НПВП-гастропатии при использовании с-НПВП Доказано, что в отношении развития ЖКТ-осложнений селективные НПВП более безопасны, чем неселективные НПВП. Они примерно в 2 раза реже вызывают желудочно-кишечные кровотечения и перфорацию язв, в 3–4 раза реже — язвы желудка и/или двенадцатиперстной кишки, а также поражение тонкой кишки. Селективные НПВП так же безопасны в плане развития рецидивов желудочно-кишечного кровотечения, как неселективные НПВП в комбинации с мощными гастропротективными препаратами. Доказательная база, подтверждающая бόльшую безопасность целекоксиба по сравнению с неселективными НПВП, очень велика и касается всех возможных осложнений со стороны ЖКТ. Согласно результатам метаанализа, основанного на данных 31 РКИ (39 605 больных с РА и остеоартрозом), опасные осложнения со стороны ЖКТ возникали у пациентов, принимавших целекоксиб, более чем в 2 раза реже, чем в контрольной группе, — 0,4% и 0,9% соответственно. Недавние популяционные исследования по типу «случай–контроль» показали, что целекоксиб в отношении серьёзных осложнений со стороны ЖКТ — наиболее безопасный препарат среди всех НПВП. Два однотипных РКИ, основанных на проведении повторного эндоскопического исследования у больных с РА (n=659 и n=400), доказали гораздо меньшую частоту развития язв желудка и двенадцатиперстной кишки при использовании целекоксиба (400 мг/сут), по сравнению с напроксеном (1000 мг/сут) и диклофенаком (150 мг/сут). Безопасность мелоксикама доказывали в масштабных, но относительно кратковременных (4–12 нед) РКИ, в которых эффективность этого препарата сравнивали с неселективными НПВП. Суммарная частота осложнений со стороны ЖКТ (включая диспепсию) была ниже, чем при приёме неселективных НПВП, однако лишь в одном РКИ было получено достоверное различие по частоте желудочно-кишечных кровотечений и перфораций язв, тем не менее, по данным метаанализов, использование мелоксикама в дозе 7,5 мг/сут ассоциируется с уменьшением риска развития серьёзных осложнений со стороны ЖКТ вдвое по сравнению с неселективными НПВП. Безопасность нимесулида доказывали в основном с помощью наблюдательных когортных и ретроспективных эпидемиологических исследований. Достоверное уменьшение частоты осложнений со стороны ЖКТ на фоне приёма этого препарата по сравнению с неселективными НПВП было продемонстрировано в единичных РКИ. Нет достоверных данных, свидетельствующих о существенном различии между селективными НПВП относительно риска развития серьёзных осложнений в ЖКТ. Ретроспективный анализ, проведённый в ГУ ИР РАМН, показал отсутствие достоверных различий между частотой диагностики при эзофагогастродуоденоскопии язв и эрозий у больных с РЗ (n=1172), принимавших целекоксиб, мелоксикам и нимесулид. В то же время результаты эпидемиологических исследований (по типу «случай–контроль») свидетельствуют, что целекоксиб в отношении риска развития осложнений со стороны ЖКТ более безопасен по сравнению с мелоксикамом. ЗНАЧЕНИЕ ЛЕКАРСТВЕННОЙ ФОРМЫ НПВП Поскольку патогенез НПВП-гастропатии в первую очередь связан с системным негативным действием НПВП, это осложнение может развиваться при использовании любых лекарственных форм. Так, согласно данным ретроспективных когортных исследований, применение НПВП в виде ретардных форм, кишечно-растворимых таблеток и ректальных свечей не уменьшает риска развития серьёзных осложнений со стороны ЖКТ. По данным ГУ ИР РАМН, частота диагностики язв желудка и/или двенадцатиперстной кишки у больных, регулярно принимавших НПВП в виде свечей (n=382), составила 14,1%, у больных (n=5721), принимавших НПВП перорально, — 12,4% (p <0,05). ДИАГНОСТИКА НПВП-ГАСТРОПАТИИ НПВП-индуцированные язвы и эрозии не имеют специфических особенностей. Соотношение язв желудка и двенадцатиперстной кишки у больных с НПВП-гастропатией составляет 1,5/2,0:1, а сочетанные язвы желудка и двенадцатиперстной кишки диагностируют примерно у 5% от общего числа пациентов с НПВП-индуцированными язвами. Размер НПВП-индуцированных язв обычно небольшой, и лишь у 20% больных их размер достигает 10 мм и более. У большинства больных НПВП-гастропатия развивается сразу после начала приёма этих препаратов (до трёх месяцев), при более длительном приёме вероятность подобного осложнения значительно снижается. НПВП-индуцированные язвы в ряде случаев могут не вызывать каких-либо субъективных симптомов («немые язвы»), в то же время, согласно данным нескольких популяционных исследований, у больных, предъявляющих жалобы на диспепсию и гастралгии, серьёзные осложнения со стороны ЖКТ диагностируются чаще, чем у тех, кто не испытывает подобных неприятных ощущений. Если пациент продолжает приём препаратов, вызвавших НПВП-гастропатию, после заживления язвы и отсутствует надлежащая профилактика, язвы и эрозии неизбежно рецидивируют. По данным наблюдательных исследований и РКИ, частота рецидивов НПВП-индуцированных язв и множественных эрозий при периоде наблюдения от 3 до 12 мес и более составляет 40% и выше. Эзофагогастродуоденоскопия — основной метод диагностики или исключения НПВП-гастропатии. Хотя клиническое значение бессимптомных язв чётко не определено, большинство исследователей оценивают их обнаружение как «суррогатный маркёр» опасных осложнений, таких, как желудочно-кишечные кровотечения. Диагностика язв при эзофагогастродуоденоскопии служит прямым показанием к проведению соответствующих лечебных и профилактических мероприятий. Вспомогательное значение для диагностики НПВП-гастропатии может иметь исследование кала на скрытую кровь. ФАКТОРЫ РИСКА НПВП-ГАСТРОПАТИИ По данным эпидемиологических исследований, серьёзные осложнения со стороны ЖКТ наиболее часто возникают у пациентов, имеющих так называемые факторы риска. По мнению ведущих экспертов, важнейшие факторы риска НПВП-гастропатии — наличие в анамнезе язв, особенно осложнённых кровотечением или перфорацией, пожилой возраст (65 лет и старше), приём высоких доз НПВП, двух или более препаратов этой группы (включая низкие дозы ацетилсалициловой кислоты), сопутствующий приём антикоагулянтов и глюкокортикоидов. Некоторые авторы выделяют также такие дополнительные факторы риска, как курение, приём алкоголя, наличие тяжёлых сопутствующих заболеваний со стороны сердечно-сосудистой системы, наличие симптомов диспепсии, а также инфицированность H. pylori (табл. 4). Таблица 4. Факторы риска НПВП-гастропатии (мнение ведущих экспертов)
Всем больным, имеющим основные факторы риска, независимо от наличия клинических признаков поражения ЖКТ, показано проведение эндоскопического исследования через 1–3 мес после начала приёма НПВП. ЛЕЧЕНИЕ НПВП-ГАСТРОПАТИИ Прекращение приёма НПВП у большинства больных само по себе не приводит к рубцеванию НПВП-индуцированных язв, хотя может повышать эффективность противоязвенной терапии. Длительность курсовой терапии должна быть не менее 4 нед, а при больших размерах и локализации язв в желудке — 8–12 нед. Препараты выбора для лечения НПВП-гастропатии — ингибиторы протонного насоса (ИПН), такие, как омепразол, лансопразол, пантопразол, эзомепразол, эффективны при НПВП-индуцированных язвах как двенадцатиперстной кишки, так и желудка, и превосходящие по своему лечебному действию блокаторы H2-рецепторов гистамина и мизопростол. ИПН используются в стандартных терапевтических дозах (например, омепразол 40 мг/сут), при этом нет необходимости в отмене НПВП и иных противоревматических препаратов. Согласно результатам ряда клинических исследований (ASTROAUT, OMNIUM и др.), при назначении стандартных доз ИПН и продолжении приёма НПВП в течение восьминедельного срока рубцевание НПВП-индуцированных язв желудка происходит более чем у 80%, а язв двенадцатиперстной кишки — у 90% больных. Факторы, способные снизить эффективность ИПН, — локализация язв в желудке, большие размеры язв и курение. У больных, не инфицированных H. pylori, противоязвенное действие ИПН гораздо меньше, чем у инфицированных этим микроорганизмом пациентов. Вероятно, сопутствующий приём высоких доз ГК и цитотоксичных препаратов (таких, как метотрексат) также способен замедлить процесс рубцевания НПВП-индуцированных язв. В настоящее время нет определённых данных, позволяющих говорить о преимуществах какого-либо отдельного препарата из группы ИПН при лечении НПВП-гастропатии. Результаты ряда открытых и небольших по масштабу РКИ свидетельствуют, что эффективность ИПН может быть повышена путём их комбинации с препаратами висмута. Эрадикация H. pylori, проводимая в рамках стандартной противоязвенной терапии, не ускоряет заживления НПВП-индуцированных язв. ПРОФИЛАКТИКА НПВП-ГАСТРОПАТИИ Как было уже сказано, подавляющее большинство случаев развития серьёзных осложнений со стороны ЖКТ отмечают у лиц, имеющих факторы риска НПВП-гастропатии, поэтому именно этому контингенту больных показано проведение активных профилактических мероприятий. Среди них важнейшее значение имеет рациональное использование НПВП с учётом особенностей клинической ситуации и фармакологических свойств лекарств. НПВП всегда следует назначать в минимальных дозах, необходимых для достижения терапевтического эффекта, по возможности избегая сочетаний с препаратами, способными увеличить риск развития осложнений со стороны ЖКТ (низкие дозы ацетилсалициловой кислоты, антикоагулянты, глюкокортикоиды). Не следует превышать рекомендованные терапевтические дозы, а также комбинировать различные НПВП (что возникает, например, при одновременном назначении пероральных и парентеральных форм). Следует помнить, что назначение НПВП в свечах или в виде инъекций не уменьшает риска развития НПВП-гастропатии. Нет данных о том, что риск опасных осложнений со стороны ЖКТ может быть уменьшен при использовании определённых пищевых продуктов (рекомендации запивать таблетки молоком, киселём и т.п.), фитопрепаратов. Использование селективных НПВП значительно уменьшает риск развития язв, эрозий и их осложнений по сравнению с неселективными НПВП, поэтому их назначение показано во всех случаях, когда пациент нуждается в противовоспалительной и анальгетической терапии, но при этом имеет факторы риска НПВП-гастропатии, тем не менее осложнения со стороны ЖКТ могут возникать и при применении селективных НПВП, особенно у больных, имевших в анамнезе серьёзные осложнения со стороны ЖКТ (кровотечения, перфорация, рецидивирующие язвы). Риск развития желудочно-кишечных кровотечений у больных, имевших подобную патологию в анамнезе, на фоне приёма селективных НПВП такой же, как у принимающих неселективные НПВП в комбинации с ИПН. При высоком риске осложнений (у пациентов, имевших в анамнезе желудочно-кишечные кровотечения или перфорацию язвы, при рецидивирующих НПВП-индуцированных язвах, при сочетании двух и более факторов риска) даже на фоне приёма селективных НПВП следует проводить медикаментозную профилактику НПВП-гастропатии с использованием ИПН. В настоящее время доказано, что комбинация селективных НПВП и ИПН более безопасна в группах высокого риска по сравнению с комбинацией неселективных НПВП и ИПН. ПРИМЕНЕНИЕ «ГАСТРОПРОТЕКТОРОВ» По современным представлениям, назначение «гастропротективных» препаратов для профилактики серьёзных осложнений со стороны ЖКТ показано всем пациентам при воздействии на них факторов риска НПВП-гастропатии, принимающим неселективные НПВП или низкие дозы ацетилсалициловой кислоты, и пациентам, получающим селективные НПВП, при наличии в их анамнезе желудочно-кишечных кровотечений или перфорации стенки желудка, рецидивирующей НПВП-индуцированной язвы, при сочетании двух и более факторов риска. Поскольку риск развития рецидива НПВП-гастропатии сохраняется в течение всего времени приёма НПВП, приём «гастропротектора» нужно продолжать в течение всего курса лечения НПВП или низкими дозами ацетилсалициловой кислоты. Использование антацидных препаратов и сукральфата в качестве гастропротекторов нецелесообразно, так как их эффективность не превышает эффекта плацебо. То же касается применения стандартных доз блокаторов H2-рецепторов гистамина для профилактики развития или рецидивов язв и эрозий желудка, хотя они и достоверно уменьшают риск развития патологии двенадцатиперстной кишки. Лишь высокие дозы фамотидина (80 мг/сут) эффективны для профилактики НПВП-индуцированных язв желудка. Аналогичный эффект для высоких доз ранитидина (400 мг/сут) показан не был. Следует отметить, что в отличие от мизопростола и ИПН до настоящего времени не доказано, что риск развития желудочно-кишечных кровотечений и перфорации язв уменьшается при использовании блокаторов H2-рецепторов гистамина. Специально с целью профилактики НПВП-гастропатии был создан препарат мизопростол (синтетический аналог простагландина Е1) — специфический антагонист негативного действия НПВП на слизистой оболочке желудка. В ходе масштабного исследования в течение 6 мес MUCOSA (n=8000) было показано, что этот препарат эффективен для профилактики развития и рецидивов НПВП-индуцированных язв желудка и/или двенадцатиперстной кишки и эрозий, а также желудочно-кишечных кровотечений и перфорации язв. Мизопростол значительно превосходит по профилактическому действию ранитидин и сукральфат. Существует чёткая зависимость между эффективностью профилактики и суточной дозой мизопростола (200 мкг 4 раза >200 мкг 3 раза >200 мкг 2 раза в день). У больных, не инфицированных H. pylori, мизопростол для профилактики рецидивов НПВП-индуцированных язв гораздо эффективнее ИПН. Однако ограничивают применение мизопростола большая частота нежелательных эффектов (прежде всего, диареи), возникающих достоверно чаще, чем при использовании иных гастропротекторов, а также неудобная схема применения. На основе мизопростола были созданы комбинированные препараты, содержащие стандартную дозу гастропротектора (200 мкг) и НПВП (диклофенак 100 мг). В настоящее время в связи с широким использованием селективных НПВП подобные комбинированные препараты утратили своё значение. Более того, в клинических исследованиях было показано, что высокоселективные селективные НПВП («коксибы») более безопасны и значительно лучше переносятся больными по сравнению с комбинацией диклофенака и мизопростола. ИПН эффективны для профилактики развития и рецидивов НПВП-индуцированных язв желудка и/или двенадцатиперстной кишки и эрозий, а также желудочно-кишечных кровотечений. ИПН в смешанных группах больных (инфицированных и не инфицированных H. pylori) так же эффективны для профилактики развития и рецидивов НПВП-индуцированных язв и эрозий, как мизопростол и превосходят по эффективности блокаторы H2-рецепторов гистамина. Нет определённых данных о возможности развития серьёзных нежелательных эффектов при длительном использовании ИПН у больных, принимающих НПВП, и о преимуществах какого-либо отдельного препарата из группы ИПН перед другими. На сегодняшний день ИПН — наиболее широко используемая в клинической практике группа гастропротекторов. Современные представления о роли инфекции H. pylori в развитии НПВП-гастропатии и о показаниях для проведения эрадикации этого микроорганизма у пациентов, принимающих НПВП, были представлены в III Маастрихтском соглашении. Согласно его положениям, НПВП-гастропатия и желудочно-кишечные кровотечения могут возникать и у пациентов, не инфицированных H. pylori, в то же время эрадикация H. pylori до начала приёма НПВП позволяет существенно уменьшить риск развития НПВП-индуцированных язв, что было показано в двух хорошо организованных РКИ, проведённых в Гонконге. Однако, в отличие от обычной (H. pylori-ассоциированной) язвенной болезни, в случае развития НПВП-гастропатии эрадикация H. pylori не даёт существенного противорецидивного действия. Эрадикация H. pylori не ускоряет заживления НПВП-индуцированных язв на фоне приёма антисекреторных противоязвенных препаратов и не уменьшает риска развития НПВП-индуцированных язв, если её проводят у лиц, уже принимающих НПВП. Поэтому после успешного лечения осложнённой или неосложнённой НПВП-индуцированной язвы, включающего курс эрадикационной терапии, если необходимо продолжить приём НПВП, несмотря на эрадикацию H. pylori, всё равно нужно обязательно использовать одну из основных методик профилактики НПВП-гастропатии: или назначение селективных НПВП, или комбинацию НПВП с гастропротективным препаратом. ДИСПЕПСИЯ, АССОЦИИРОВАННАЯ С ПРИЁМОМ НПВП Приём НПВП может ассоциироваться с возникновением различных неприятных ощущений со стороны верхних отделов ЖКТ, часто при отсутствии определяемого при эндоскопическом исследовании повреждения слизистой оболочки. По данным эпидемиологических исследований, НПВП вызывают диспепсию гораздо чаще, чем препараты иных фармакологических групп, такие, как глюкокортикоиды, метилксантины, блокаторы кальциевых каналов и ингибиторы ангиотензинпревращающего фермента (АПФ). Среди больных, регулярно принимающих НПВП, диспепсия возникает у 20–40%, при этом около 10% больных прерывают приём НПВП из-за развития неприятных симптомов со стороны ЖКТ. В отличие от НПВП-гастропатии, патогенез диспепсии в большей степени связан с контактным действием НПВП. Эти препараты оказывают местное негативное влияние на мембраны эпителиоцитов, приводящее к обратной диффузии ионов водорода в слизистую оболочку, с последующим снижением рН в подслизистом слое, стимулирующим болевые рецепторы. Определённое значение в патогенезе диспепсии играет способность НПВП ускорять или замедлять моторику ЖКТ. Влияние инфицированности слизистой оболочки желудка H. pylori на развитие НПВП-ассоциированной диспепсии не доказано. Неприятные ощущения со стороны ЖКТ, возникающие при приёме НПВП, носят неспецифический характер. Наиболее часто пациенты отмечают боли, чувство «жжения» и тяжести в эпигастральной области, возникновение этих симптомов часто чётко связано с приёмом НПВП. Диспепсия ухудшает качество жизни больных РЗ и приводит к существенным материальным затратам из-за необходимости длительно принимать различные препараты для купирования этого осложнения и проводить различные дорогостоящие диагностические процедуры. Диспепсию способны вызывать все НПВП, включая низкие дозы ацетилсалициловой кислоты, однако на фоне приёма селективных НПВП она возникает реже, чем при приёме неселективных НПВП. Это осложнение чаще отмечают у лиц с наличием язвы в анамнезе и лиц, принимающих высокие дозы НПВП. ЛЕЧЕНИЕ И ПРОФИЛАКТИКА НПВП-АССОЦИИРОВАННОЙ ДИСПЕПСИИ Уменьшить риск развития диспепсии можно, ограничивая использование НПВП, наиболее часто вызывающих диспепсию (в частности, индометацина). Развитие неприятных ощущений со стороны ЖКТ часто связано с индивидуальными фармакологическими свойствами определённого лекарства. Поэтому замена препарата, вызвавшего данное осложнение, на другой (иногда на препарат, содержащий то же действующее вещество, выпущенное иным производителем), во многих случаях позволяет решить проблему диспепсии у конкретного пациента. Кроме того, при развитии этого осложнения на фоне приёма неселективных НПВП целесообразен переход на использование селективных НПВП, которые гораздо лучше переносятся пациентами и реже вызывают диспепсию. Чтобы уменьшить интенсивность диспепсических симптомов, можно использовать антацидные препараты и сукральфат (в режиме «по требованию»). По данным РКИ, блокаторы H2-рецепторов гистамина и ИПН — эффективные средства для купирования диспепсии и симптомов гастроэзофагеального рефлюкса, ассоциированных с приёмом НПВП. Приём НПВП после еды, в вертикальном положении, с большим количеством жидкости может уменьшать выраженность неприятных ощущений со стороны верхних отделов ЖКТ, однако доказательств эффективности этих рекомендаций нет. При использовании НПВП в виде ректальных свечей диспепсия возникает реже, чем при приёме внутрь. Эрадикация H. pylori не уменьшает риска развития диспепсии на фоне приёма НПВП. Комбинация неселективных НПВП и ИПН — более эффективное, чем селективные НПВП, средство, предупреждающее развитие диспепсии у больных, имевших в анамнезе серьёзные осложнения со стороны ЖКТ. НПВП-ЭНТЕРОПАТИЯ Этим термином обозначают патологию тонкой кишки, которая возникает в связи с приёмом НПВП и вызывает нарушение проницаемости кишечной стенки с экссудацией белка и диапедезом эритроцитов, приводящими к железодефицитной анемии и гипоальбуминемии, а также к повреждению слизистой оболочки с развитием эрозий, язв и их осложнениями — кровотечением и перфорацией, появлением циркулярных стриктур и нарушением кишечной проходимости. Патогенез этого осложнения связан с негативным влиянием НПВП на энтероциты — снижением синтеза простагландина Е2 и простациклина, блокадой ферментных систем митохондрий, нарушением микроциркуляции вследствие блокады NO-синтетазы и др., что приводит к нарушению межклеточных контактов с последующей транслокацией бактериальной флоры и компонентов бактерий в кишечную стенку и дальнейшим развитием хронического воспаления. Частота кишечных кровотечений, перфорации и язв тонкого кишечника у лиц, принимающих НПВП, гораздо выше, чем у пациентов, не получающих этих препаратов. Согласно результатам исследования VIGOR, у больных, длительно принимающих неселективные НПВП, частота кишечных кровотечений и перфораций составила 0,89% на 100 пациентов/лет. Косвенные признаки воспаления тонкой кишки отмечают у 40–70% больных, длительно принимающих НПВП, а по данным энтероскопии, и капсульной эндоскопии, видимое повреждение слизистой оболочки тонкого кишечника обнаруживают более чем у 40% больных. Основными клиническими проявлениями НПВП-энтеропатии следует считать железодефицитную анемию и гипоальбуминемию, однако иногда эта энтеропатия может дебютировать кишечным кровотечением, перфорацией или клинической картиной кишечной непроходимости. Проведение диагностических мероприятий, позволяющих обнаружить патологию тонкой кишки, показано больным, регулярно принимающим НПВП, при наличии у них признаков кишечного кровотечения и гипоальбуминемии, если отсутствует иная причина, вызвавшая данную патологию (НПВП-гастропатии, поражения толстой кишки и др.). Для диагностики поражения слизистой оболочки тонкой кишки используют эндоскопические методики: энтероскопию и капсульную эндоскопию, – а также рентгеновскую энтерографию. Диагностируют нарушения проницаемости стенки тонкой кишки, основываясь на методиках с использованием меченых молекул (например, 51Cr-меченная ЭДТА) или эритроцитов и определяя в кале маркёры клеточного воспаления (например, кальпротектин). Риск развития патологии тонкой кишки увеличивается при наличии дивертикулов, а также хронических воспалительных заболеваний кишечника, таких, как неспецифический язвенный колит и болезнь Крона. ЛЕЧЕНИЕ И ПРОФИЛАКТИКА НПВП-ЭНТЕРОПАТИИ Отмена НПВП способна уменьшить риск развития тяжёлых осложнений и ускорить процесс выздоровления, однако не приводит к купированию всех симптомов НПВП-энтеропатии. Имеются отдельные сообщения о возможности применять для лечения НПВП-энтеропатии мизопростол, сульфасалазин и метронидазол, однако до настоящего времени не проводили РКИ, позволяющие доказать эффективность этих препаратов. Профилактика НПВП-энтеропатии прежде всего подразумевает рациональное использование НПВП у больных с такими вероятными факторами риска, как пожилой возраст, сопутствующий приём ГК, низких доз ацетилсалициловой кислоты и антикоагулянтов. Особую осторожность следует соблюдать при назначении НПВП больным с хроническими воспалительными заболеваниями кишечника, поскольку при болезни Крона и неспецифическом язвенном колите приём неселективных НПВП может спровоцировать тяжёлое кишечное кровотечение и перфорацию. Согласно данным серии РКИ, применение высокоселективных С-НПВП (в частности, целекоксиба) у данного контингента больных достоверно снижает риск развития или рецидива патологии тонкой кишки. Сульфасалазин и препараты висмута способны уменьшать кровопотерю, связанную с повышением проницаемости кишечной стенки на фоне приёма НПВП. Использование мизопростола способно уменьшить риск развития серьёзных осложнений со стороны тонкой кишки при длительном приёме НПВП. Следует помнить, что ИПН не уменьшают риска развития НПВП-энтеропатии. ПРИЁМ НПВП И ПАТОЛОГИЯ ТОЛСТОЙ КИШКИ Приём НПВП может вызывать развитие эрозий, язв, перфорации и стриктуры толстой кишки, а также осложнять течение дивертикулёза кишечника. Кроме того, на фоне приёма НПВП может развиться колит, напоминающий воспалительные заболевания кишечника, и возникать обострение неспецифического язвенного колита. ПОРАЖЕНИЕ ПЕЧЕНИ, СВЯЗАННОЕ С ПРИЁМОМ НПВП В патогенезе НПВП-ассоциированного поражения печени обсуждают роль блокады ферментных систем цикла Кребса и разобщения окислительного фосфорилирования (по типу синдрома Рейе) в митохондриях гепатоцитов, блокаду фосфодиэстеразы IV, нарушение экскреции жёлчи вследствие образования комплексов с жёлчными кислотами и энтеропечёночной рециркуляции НПВП, а также иммунологические нарушения. Среди больных, регулярно принимающих НПВП, бессимптомное повышение трансаминаз отмечают у 1–5%. К счастью, клинически выраженные гепатотоксические реакции (острый лекарственный гепатит) возникают редко — около 1 случая на 10 000 больных, регулярно принимающих НПВП. Поражение печени могут сопровождать холестатическая желтуха или фульминантная печёночная недостаточность, способные привести к летальному исходу. Все НПВП, включая селективные НПВП, могут вызывать развитие серьёзных гепатотоксических реакций, однако наиболее часто они развиваются при использовании сулиндака. В последние годы в медицинской литературе появились сообщения о случаях развития тяжёлых осложнений со стороны печени при использовании нимесулида. Эти данные послужили причиной прекращения продаж этого препарата в ряде стран. Однако следует отметить, что, по данным клинических и эпидемиологических исследований, гепатотоксичности нимесулида не превышает гепатотоксичности диклофенака и ибупрофена. В связи с редкостью патологии факторы риска поражения печени на фоне приёма НПВП точно не определены. По мнению ряда экспертов, к ним можно отнести женский пол, пожилой возраст, патологию гепатобилиарной системы, тяжёлые заболевания, способствующие ухудшению кровотока в печени, сочетанный приём препаратов, влияющих на метаболизм НПВП, генетические аномалии активности ферментов, определяющих биотрансформацию НПВП и их метаболитов, гипоальбуминемию, повышение активности АЛТ и АСТ в анамнезе на фоне лекарственной терапии. Поскольку данная патология развивается редко, необходимость проведения специфической профилактики не определена. При возникновении клинических признаков поражения печени или существенных изменений лабораторных показателей следует немедленно отменить НПВП. Проводить лечение острого лекарственного гепатита следует в специализированном гастроэнтерологическом отделении в соответствии со стандартами терапии этой патологии. Целесообразность назначения специальной терапии (в том числе «гепатопротекторов») при бессимптомном повышении активности трансаминаз до настоящего времени не определена. ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ Приём НПВП может приводить к дестабилизации АГ, дестабилизации и прогрессированию сердечной недостаточности, а также ассоциироваться с повышением риска патологий сердца и сосудов (ИМ, инсульт и внезапная коронарная смерть). ПРИЁМ НПВП И АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ Гипертензивный эффект НПВП включает подавление фильтрации и усиление проксимальной канальцевой реабсорбции натрия, увеличение внепочечной и внутрипочечной сосудистой резистентности за счёт ингибирования синтеза простагландинов с вазодилататорной активностью (простагландин Е2 и простагландин I2) и/или благодаря тому, что усиливается высвобождение норадреналина из нервных окончаний и увеличивается чувствительность сосудистой стенки к действию вазоконстрикторных субстанций, замедляются почечный кровоток и клубочковая фильтрация с активацией ренин-ангиотензиновой и симпатической систем, увеличивается секреции эндотелина-1. Материалы ряда РКИ и данные метаанализов свидетельствуют о том, что приём как неселективных НПВП, так и селективных НПВП может приводить к увеличению АД, однако этот эффект имеет существенное значение преимущественно у пациентов с уже развившейся АГ. С помощью метаанализа, включавшего данные 54 исследований, было показано, что приём неселективных НПВП приводит к достоверному увеличению АД у пациентов, страдающих АГ. Влияние неселективных НПВП на АД у пациентов без АГ не изучено. По обобщённым данным 50 РКИ было показано, что приём НПВП приводит к увеличению АД (в среднем на 5 мм рт.ст.), однако этот эффект более выражен у пациентов, уже получавших антигипертензивную терапию, чем у лиц с исходно нормальным АД. Результаты РКИ свидетельствуют, что индометацин, пироксикам и напроксен в средних дозах и ибупрофен в высокой дозе способны уменьшать эффективность β-адреноблокаторов, диуретиков, ингибиторов АПФ и, в меньшей степени, блокаторов медленных кальциевых каналов. По данным недавно опубликованного метаанализа, при использовании селективных НПВП («коксибов») возникает такое же увеличение систолического и диастолического АД, как при использовании неселективных НПВП. ПРИЁМ НПВП И РИСК РАЗВИТИЯ СЕРДЕЧНО-СОСУДИСТЫХ КАТАСТРОФ Данные, касающиеся риска патологий сердечно-сосудистой системы на фоне приёма НПВП, весьма противоречивы. Исходя из теоретических положений, селективные НПВП снижают ЦОГ-2-зависимый синтез простагландина I2 клетками сосудистого эндотелия, не влияя на ЦОГ-1-зависимый синтез TхA2 тромбоцитами, что может приводить к нарушению баланса PG I2/TхA2 и, следовательно, к активации, агрегации и адгезии тромбоцитов и увеличению риска сосудистого тромбоза. Эта проблема получила большой медицинский и общественный резонанс после изъятия с фармакологического рынка селективных НПВП рофекоксиба. Первые данные о значимом повышении частоты тромбозов при лечении рофекоксибом появились в ходе исследования VIGOR, а результаты исследования APPROVe подтвердили этот факт, что послужило основанием для приостановки выпуска препарата. В исследовании AРC, аналогичном APPROVe, установлено зависимое от дозы увеличение частоты кардиоваскулярных осложнений у пациентов, получавших целекоксиб, однако этот факт не получил подтверждения в ходе масштабных исследований PreSAP и ADAPT. С другой стороны, хотя неселективные НПВП не вызывают нарушения баланса простагландина I2/TхA2, использование этих препаратов может сопровождаться дестабилизацией АГ и сердечной недостаточности, что само по себе повышает риск сердечно-сосудистых заболеваний. В 2006 г. был представлен обзор когортных исследований, исследований «случай–контроль», РКИ, касающихся применения НПВП для профилактики аденоматозного полипоза кишечника, и РКИ, в которых сравнивали неселективные и селективные НПВП у пациентов с РЗ. Метаанализ результатов исследований «случай–контроль» (12 исследований, n=311 599) не показал достоверного увеличения риска ИМ у лиц, принимавших НПВП. В четырёх когортных исследованиях (n=922 000) повышения риска развития этого осложнения при приёме НПВП отмечено не было (ОШ=1,0), за исключением исследования эффектов рофекоксиба (ОШ=1,26). Результаты анализа 3 РКИ профилактического применения целекоксиба, рофекоксиба и ацетилсалициловой кислоты у пациентов с аденоматозным полипозом толстой кишки (n=5365) свидетельствуют об увеличении риска у пациентов, получавших любой из перечисленных препаратов. Материалы длительных РКИ (8 РКИ, n=37 761) свидетельствуют об абсолютном нарастании частоты возникновения ИМ у пациентов, получавших селективные НПВП по сравнению с неселективными НПВП, но тяжёлые осложнения со стороны ЖКТ встречались гораздо чаще при приёме неселективных НПВП. Анализ совокупности всех данных (62 исследования, n=94599) показал, что в целом частота ИМ была выше на фоне приёма селективных НПВП, чем неселективных НПВП, но достоверное увеличение риска отмечено только при приёме рофекоксиба (ОР=2,24). Суммируя сказанное, следует сделать вывод о том, что повышение риска сердечно-сосудистых заболеваний можно рассматривать как класс-специфический побочный эффект всех НПВП. Однако приём НПВП увеличивает вероятность развития указанных патологий гораздо меньше, чем иные традиционные факторы риска кардиоваскулярных осложнений, такие, как курение. ПРИЁМ НПВП И РИСК РАЗВИТИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ Как было уже указано, использование НПВП увеличивает риск развития и декомпенсации застойной сердечной недостаточности. По данным популяционных исследований, риск госпитализаций по поводу сердечной недостаточности значительно возрастает у пациентов, впервые начавших принимать неселективные НПВП и рофекоксиб, но не целекоксиб. ПРОФИЛАКТИКА СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ, СВЯЗАННЫХ С ПРИЁМОМ НПВП Основной метод профилактики кардиоваскулярных осложнений у больных с РЗ — рациональное использование НПВП, учитывающее особенности клинической ситуации и возможное наличие сопутствующих заболеваний сердечно-сосудистой системы. Следует подробно информировать пациентов о возможных побочных эффектах НПВП не только со стороны ЖКТ, но и со стороны сердечно-сосудистой системы. Пациентам, имеющим высокий риск кардиоваскулярных осложнений, можно назначать НПВП только по строгим показаниям и под тщательным медицинским контролем. У данного контингента больных целесообразно проводить «мониторирование» кардиоваскулярных осложнений (особенно контроль АД) на протяжении всего времени приёма НПВП. Необходимо помнить, что риск сердечно-сосудистых осложнений существенно повышается при длительном приёме НПВП в высоких дозах, поэтому не следует использовать эти препараты в дозах, превышающих рекомендуемые. У больных, страдающих заболеваниями сердечно-сосудистой системы, на фоне приёма НПВП может возникнуть необходимость корректировать антигипертензивную терапию и комплексную терапию сердечной недостаточности. При наличии факторов риска сердечно-сосудистых осложнений на фоне приёма НПВП необходимо назначать низкие дозы ацетилсалициловой кислоты. Важно отметить, что, по данным экспериментальных исследований, некоторые НПВП (ибупрофен, напроксен, индометацин) могут конкурировать с ацетилсалициловой кислотой за связывание с активным центром ЦОГ-1 и блокировать его антиагрегантное действие. Эти данные подтверждаются результатами эпидемиологического исследования с использованием база данных California Medicade за 1999–2004 гг. Было показано, что применение ацетилсалициловой кислоты уменьшает риск развития ИМ на фоне лечения рофекоксибом, целекоксибом, мелоксикамом, в то же время положительного влияния приёма ацетилсалициловой кислоты на риск развития ИМ у лиц, принимавших индометацин и ибупрофен, отмечено не было. При выборе НПВП для лечения больных с повышенным риском кардиоваскулярных осложнений следует иметь в виду, что некоторые НПВП (целекоксиб и, вероятно, напроксен) реже вызывают кардиоваскулярные побочные эффекты, чем другие НПВП (диклофенак, ибупрофен) и в этой ситуации более предпочтительны. ПОРАЖЕНИЕ ПОЧЕК Характерная форма почечной патологии на фоне лечения НПВП (наряду с повышением АД) — снижение клубочковой фильтрации с возникновением отёков, небольшим увеличением уровня креатинина и мочевины в сыворотке и гиперкалиемией. В большинстве случаев эти нарушения протекают довольно мягко, носят транзиторный характер и при отмене НПВП полностью обратимы. Факторы риска поражения почек в результате приёма НПВП — пожилой возраст (старше 65 лет), скрытая почечная недостаточность, застойная сердечная недостаточность, цирроз печени, использование диуретиков, дегидратация и снижение АД, а также применение некоторых лекарственных средств, включая диуретики, аминогликозиды, циклоспорин А, ингибиторы АПФ. Селективные НПВП могут в такой же степени нарушать функцию почек, как и неселективные НПВП. Так, по данным метаанализа, опубликованного в 2006 г. и включавшего данные 114 РКИ (n=116 094), приём рофекоксиба приводил к нарастанию риска почечных побочных эффектов, в том числе периферических отёков, нарушений функции почек. Напротив, на фоне приёма целекоксиба умеренно уменьшался риск нарушения функции почек и развития АГ. Более редкая форма почечной патологии — «анальгетическая нефропатия», развитие которой связывают с длительной ишемией, обусловленной ингибированием синтеза простагландинов, приводящих к расширению сосудов. Это осложнение развивается при многолетнем непрерывном приёме НПВП, сопровождается медленно прогрессирующим некрозом сосочков почек. Основной компонент анальгетической нефропатии — нарушение концентрационной функции почек; в финальной стадии развивается хроническая почечная недостаточность. ПРИЁМ НПВП И ПАТОЛОГИЯ ЛЁГКИХ У 10–20% пациентов, страдающих бронхиальной астмой, наблюдают гиперчувствительность к ацетилсалициловой кислоте и НПВП, приводящую к тяжёлым обострениям астмы. Ранее эту патологию называли «аспиринчувствительной» бронхиальной астмой, а в настоящее время — «аспирининдуцированным респираторным заболеванием». Установлено, что ингибиторы ЦОГ-2 (нимесулид, мелоксикам, целекоксиб) значительно реже вызывают данное осложнение, поэтому их рассматривают как препараты выбора для больных, у которых РЗ сочетаются с бронхиальной астмой. ПРИЁМ НПВП И РЕПАРАЦИЯ ПЕРЕЛОМОВ В недавних исследованиях было установлено, что НПВП оказывают негативное влияние на консолидацию переломов у лабораторных животных. Это привлекло внимание к проблеме рациональной аналгезии у пациентов с переломами костей скелета, в том числе связанными с остеопорозом. Клинические данные, касающиеся влияния НПВП на срастание переломов костей скелета, крайне немногочисленны. Предварительные результаты свидетельствуют о негативном влиянии неселективных НПВП на заживление переломов позвоночника и об отсутствии такового у селективных НПВП. До получения более доказательных данных всё же следует рекомендовать по возможности ограничивать длительное применение НПВП для аналгезии у пациентов с переломами костей. ИСПОЛЬЗОВАНИЕ НПВП В ПЕРИОД БЕРЕМЕННОСТИ И ЛАКТАЦИИ Согласно теоретическим положениям и экспериментальным данным, приём НПВП (как неселективных, так и селективных) может предотвращать или замедлять наступление овуляции. Клиническое значение и частота развития данного побочного эффекта неизвестны. Неселективные НПВП не обладают тератогенным эффектом, при наличии строгих показаний их можно применять в течение первого и второго триместра беременности. Поскольку данные, касающиеся использования у беременных селективных НПВП, отсутствуют, эти препараты не следует применять в период беременности. Так как через 20 нед после гестации любые НПВП (кроме низких доз ацетилсалициловой кислоты) могут вызывать спазм артериального протока и нарушение функции почек у плода, в этот период любые НПВП (за исключением низких доз ацетилсалициловой кислоты) следует отменить. НПВП — слабые кислоты, они не присутствуют в высокой концентрации в молоке, тем не менее их применение у кормящих матерей нежелательно. При наличии строгих показаний разрешено использовать ибупрофен, индометацин, диклофенак, напроксен, пироксикам. Следует принимать во внимание, что кормление сразу после приёма НПВП позволяет уменьшить риск поступление препарата в грудное молоко. ВЗАИМОДЕЙСТВИЕ НПВП С ДРУГИМИ ПРЕПАРАТАМИ В процессе лечения НПВП необходимо иметь в виду их способность к взаимодействию с другими лекарственными средствами, особенно непрямыми антикоагулянтами, диуретиками, β-адреноблокаторами, ингибиторами АПФ, солями лития, нередко назначаемыми больным с ревматическими заболеваниями, особенно в пожилом возрасте (табл. 5). Таблица 5. Лекарственное взаимодействие нестероидных противовоспалительных средств с другими препаратами, имеющее клиническое значение
ПРИМЕНЕНИЕ НПВП В КЛИНИЧЕСКОЙ ПРАКТИКЕ: ОБЩИЕ РЕКОМЕНДАЦИИ Использование НПВП (в виде монотерапии или в комбинации с другими анальгетиками) целесообразно при острых или хронических заболеваниях и патологических состояниях, сопровождаемых болями, которые связаны с воспалением, острой травмой и оперативными вмешательствами. Уменьшение боли относится к основным направлениям противоревматической терапии, поэтому использование НПВП показано всем больным с ревматическими заболеваниями, испытывающим боли, которые связаны с воспалительным или дегенеративным поражением органов опорно-двигательного аппарата. Продолжительность курса лечения НПВП необходимо определять индивидуально в зависимости от конкретной клинической ситуации (длительность и интенсивность боли). «Индивидуальный» ответ на НПВП может колебаться в широких пределах, поэтому нередко необходим подбор наиболее эффективного препарата. Для достоверного вывода об эффективности или отсутствия такой препарат следует использовать не менее 2–4 нед в оптимальной терапевтической дозе. Главный фактор, который следует учитывать при назначении НПВП, — возможный риск развития серьёзных нежелательных эффектов. НПВП в средних и высоких терапевтических дозах для лечения ревматических заболеваний должен назначать больному квалифицированный врач с соблюдением правил выписки рецептурных лекарственных препаратов. При этом необходимо представить больному необходимую информацию о цели назначения НПВП, возможных нежелательных эффектах и методах самоконтроля в процессе их приёма. Монотерапию НПВП нельзя рассматривать как адекватное лечение каких-либо хронических ревматических заболеваний, поскольку нет определённых доказательств положительного влияния НПВП на их прогрессирование. Нецелесообразно использовать НПВП при ревматических заболеваниях в отсутствие прямого показания (боль). Нет достоверных данных, свидетельствующих о преимуществах в эффективности отдельных препаратов из группы НПВП при определённых ревматических заболеваниях. Поэтому выбор НПВП нужно осуществлять индивидуально, исходя из фармакологических особенностей препарата (см. ниже), клинической ситуации и наличия факторов риска нежелательных эффектов. Для купирования острых болей в течение короткого времени (до трёх суток) целесообразно использовать парентеральные формы НПВП (кеторолак, диклофенак, кетопрофен, мелоксикам и др.), или нимесулид (в растворимой форме), или лорноксикам, обладающие выраженным анальгетическим эффектом. Для длительного лечения показано использование НПВП, обладающих средним или длительным периодом полувыведения, перорально или в виде ректальных свечей. Локальное использование НПВП в виде мазей имеет вспомогательное значение — как дополнение к системному назначению НПВП при комплексной терапии поражения суставов и мягких тканей ревматической природы. Неселективные НПВП целесообразно назначать больным, не имеющим основных факторов риска НПВП-гастропатии (к которым относят возраст старше 65 лет, сопутствующую патологию ЖКТ, приём низких доз ацетилсалициловой кислоты, антикоагулянтов и глюкокортикоидов) и клинически выраженной патологии сердечно-сосудистой системы (в том числе неконтролируемой АГ, сердечной недостаточности, тяжёлого поражения коронарных артерий). При наличии факторов риска НПВП-гастропатии и на фоне приёма ацетилсалициловой кислоты использование неселективных НПВП допустимо только в сочетании с ИПН. Не следует назначать неселективные НПВП больным, у которых ранее возникали опасные осложнения со стороны ЖКТ (кровотечение и перфорация язвы), страдающим хроническими воспалительными заболеваниями кишечника и тяжёлой патологией сердечно-сосудистой системы. Селективные НПВП назначают больным старше 65 лет, имеющим факторы риска НПВП-гастропатии или принимающим низкие дозы ацетилсалициловой кислоты. У больных, имеющих в анамнезе тяжёлое поражение ЖКТ (желудочно-кишечное кровотечение и/или перфорация язвы, рецидивирующее течение язвенной болезни) или принимающих низкие дозы ацетилсалициловой кислоты, варфарин и глюкокортикоиды, применять селективных НПВП можно только в сочетании с ИПН. При наличии тяжёлой патологии сердечно-сосудистой системы, сопровождающейся высоким риском развития сосудистых тромбозов (ишемическая болезнь сердца, ишемический инсульт, состояния после операций на сердце и крупных сосудах, рецидивирующий тромбофлебит и т.д.), назначение селективных НПВП возможно лишь на фоне адекватной антитромботической терапии. При назначении НПВП лечащий врач должен принимать во внимание специфические противопоказания и предупреждения, заявленные фирмой — производителем препарат (табл. 6). Таблица 6. Контроль нежелательных эффектов нестероидных противовоспалительных средств
В педиатрической практике: Не используются: аспирин до 15 лет (риск синдрома Рея), коксибы (до 18 лет), индометацин и пироксикам (до 14 лет), лорноксикам (до 18 лет), кеторолак (до 16 лет). Препарат выбора в качестве жаропонижающего средства- парацетамол. Препарат второго ряда- ибупрофен. Нимесулид в странах ЕС не используется до 14 лет в связи с выявленной гепатотоксичностью. В РФ имеется форма выпуска в виде сиропа, используемая у детей младшего возраста (хотя официально препарат разрешен с 12 лет), таким образом нимесулид не может быть препаратом выбора в детской практике. В педиатрии в зависимости от дозы и формы выпуска используются используются: диклофенак (с 1 года) , мелоксикам (с 12 лет), кетопрофен (с 6 лет), напроксен (с 1 года), ибупрофен (с 3-х месс. возраста), парацетамол (с 1 мес. возраста).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Конец формы
Начало формы
Глюкокортикоиды (кортикостероиды, глюкокортикостероиды) (ГК) — группа лекарственных средств (ЛС), имеющих стероидную природу, обладающих высокой противоспалительной активностью и оказывающих влияние на углеводный, липидный и водно-электролитный обмены.
Начало использования ГК в ревматологии в 1950-е годы революционизировало подходы к терапии многих аутоиммунных заболеваний.
КЛАССИФИКАЦИЯ
По происхождению:
• природные (гидрокортизон, кортизон);
• синтетические:
• нефторированные (преднизолон, метилпреднизолон, преднизон);
• фторированные (триамцинолон, дексаметазон, бетаметазон).
По продолжительности действия (при системном назначении):
• короткого действия (гидрокортизон, кортизон) — Т½ = 8–12 ч;
• средней продолжительности действия (преднизолон, преднизон, метилпреднизолон) — Т½ = 12–36 ч;
• продолжительного действия (триамцинолон, дексаметазон, бетаметазон) — Т½ = 36–54 ч.
МЕХАНИЗМ ДЕЙСТВИЯ И ОСНОВНЫЕ ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ
ГК опосредует свои эффекты посредством геномных и негеномных механизмов. В основе геномных эффектов лежит регуляция активности генов, негеномные эффекты реализуются за счёт непосредственного взаимодействия ГК с мембранными структурами, а также их связывания с рецепторами, не приводящего к изменению экспрессии генов.
Для реализации геномных эффектов требует некоторое время (от 30 мин), поскольку они связаны с изменением биосинтеза белков, в то время как негеномные эффекты обуславливают практически мгновенные изменения. Геномные эффекты могут проявляться и при низких концентрациях препарата (до 10–12 моль/л), реализация негеномных эффектов требует более высоких концентраций.
Краткая схема действия ГК, связанного с рецепторами, представлена на рис. 1.
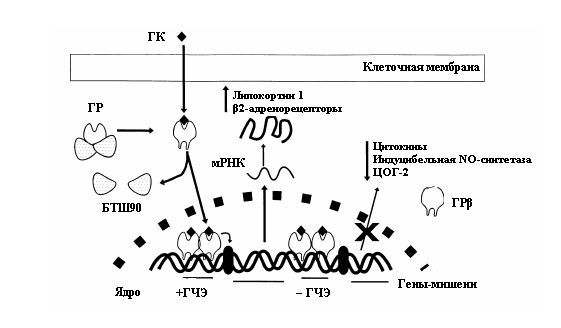
Рисунок 1. Классическая модель действия глюкокортикоидов.
После проникновения в клетку путём диффузии препарат взаимодействует с глюкокортикоидным рецептором (ГР), который находится в цитоплазме и связан с 2 молекулами белка теплового шока с молекулярной массой 90 кДа (БТШ90). После связывания комплекс ГК–рецептор транслоцируется в ядро клетки, где в виде димера связывается с ГК-чувствительным элементом (ГЧЭ) (последовательностью, распознающейГК) соответствующих генов. Это взаимодействие может приводить к усилению или подавлению (–ГЧЭ) экспрессии гена. Глюкокортикоидный рецептор β может взаимодействовать с ДНК, однако не способен связаться с ГК.
Помимо взаимодействия с ДНК ГК могут оказывать непосредственное воздействие на транскрипционные факторы (комплекс ГК–рецептор может связываться с NF-κB и активаторным белком 1) и влиять на структуру хроматина (способствуют деацетилированию гистонов, что приводит к усилению экспрессии некоторых генов).
В результате глюкокортикоиды обладают способностью усиливать секрецию противовоспалительных и угнетать образование провоспалительных цитокинов, ферментов, рецепторов, адгезионных молекул и др. Также их влияние связано с воздействием на клеточные функции: угнетается функциональная активность нейтрофилов, макрофагов, эозинофилов, лимфоцитов; изменяется состояние эндотелиальных клеток.
За счёт этого реализуются основные эффекты: противовоспалительный, антидеструктивный и иммуномодулирующий. Противоаллергический, противошоковый, антитоксический и другие эффекты не имеют существенного значения при лечении ревматических заболеваний.
Противоспалительная активность ГК различается. Кроме того, ГК обладают минералокортикоидной активностью различной степени выраженности (способствуют задержке натрия). Последнее способствует развитию некоторых побочных эффектов. Сравнительные фармакодинамические характеристики различных ГК представлены в табл. 1.
Таблица 1. Фармакодинамические характеристики основных ГК
Препарат |
Эквивалентная доза, мг |
Сравнительная противовоспалительная активность |
Сравнительная минералокортикоидная активность |
Гидрокортизон |
20 |
1 |
1 |
Кортизон |
25 |
0,8 |
1 |
Преднизон |
5 |
4 |
0,8 |
Преднизолон |
5 |
4 |
0,8 |
Метилпреднизолон |
4 |
5 |
0,5 |
Триамцинолон |
4 |
5 |
0 |
Бетаметазон |
0,75 |
20–30 |
0 |
Дексаметазон |
0,75 |
20–30 |
0 |
Более благоприятным соотношением между глюкокортикоидной (противовоспалительной) и минералокортикоидной активностью отличаются фторированные производные. Так, противовоспалительная активность дексаметазона (по сравнению с таковой гидрокортизона) выше в 30 раз, бетаметазона — в 25–40 раз, триамцинолона — в 5 раз, при этом влияние на водно-солевой обмен минимально. Фторированные производные отличаются не только высокой эффективностью, но и низкой абсорбцией при местном применении, т.е. меньшей вероятностью развития системных побочных эффектов.
