
2.2 Некоторые физико-химические свойства озона
Химические свойства озона отличаются двумя главными особенностями — нестойкостью и окисляющей способностью. Находясь в воздухе в малых количествах, озон разлагается сравнительно медленно, присутствие в воздухе NO₂, Cl₂ и других газов-катализаторов (в отсутствие солнечного света), а также каталитическое действие окислов некоторых металлов (Ag, Cu, Fe, Mn) ускоряют разложение озона.
При повышении температуры разложение озона ускоряется. Термическое разложение озона стало классическим примером так называемой спиново-разрешенной термодиссоциации, который часто приводится в учебниках по химической кинетике. Механизм реакции можно представить следующим образом (реакции №1 и №2):
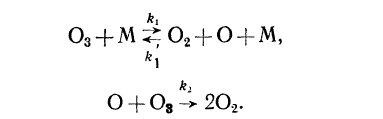
Константы скоростей следующие:
k₁ = 7,8 * 10¹⁴ * ехр (—23 340/RT) см³ * моль¯¹ * с¯¹,
k’₁ = 1,24 * 10¹³ * ехр (—1090/RT) см³ * моль¯¹ * с¯¹,
k₂= 2,9 ± 0,9 * 10¹² * ехр (—3700/RT) см³ * моль¯¹ * с¯¹,
Термический распад О₃ изучался в струевых и статических условиях при Т = 360 К, а также методом ударных волн при Т = 800 К. Реакция №2 приводит к кажущемуся удвоению скорости мономолекулярного распада, однако при высоких температурах в ударной волне влияние этой реакции уменьшается, что приводит к переходу от удвоенной к нормальной скорости мономолекулярной диссоциации. Между данными при прямой и обратной реакциях не наблюдается существенного различия. На рисунках 3 и 4 приведены результаты экспериментов разных авторов по определению температурных зависимостей коэффициентов в суммированных формулах.
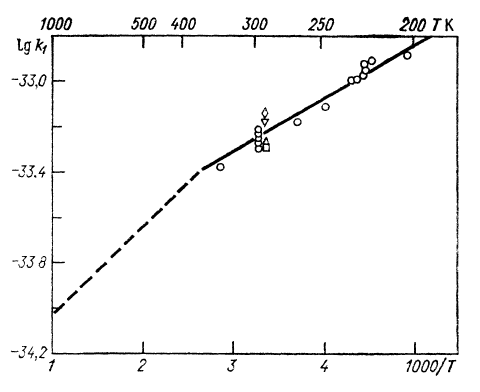
Рис.3. Зависимость константы скорости k₁ реакции №1 от температуры по данным разных авторов
(пунктир К’₁, где К – константа равновесия)
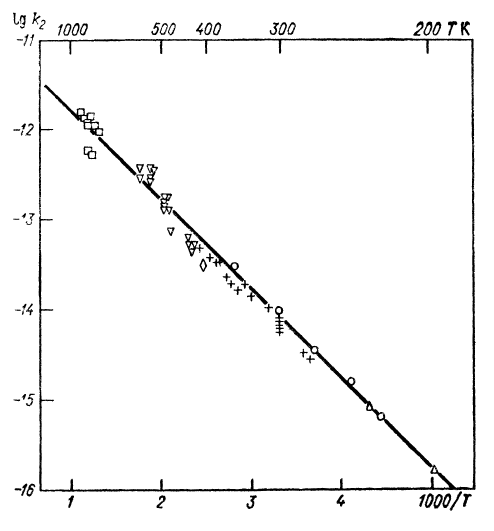
Рис.4. Зависимость константы скорости k₂ реакции №2 от температуры по данным разных авторов
При сравнительно низких температурах стратосферы и мезосферы обратная реакция №1 является главной для образования атмосферного озона, ее коэффициент измерен в настоящее время с точностью в несколько процентов. Реакция №2 долгое время считалась главным каналом деструкции (гибели) атмосферного озона. Сейчас доказана решающая роль в деструкции озона малых примесных составляющих атмосферы: окислов азота, хлора, водородосодержащих компонентов, играющих роль газов-катализаторов.
Озон обладает сильными окислительными свойствами. При обычной температуре большинство металлов окисляются озоном. Серебро чернеет в воздухе, содержащем озон, с ртутью он образует окись HgO. Озон способен образовывать озониды щелочных металлов, из которых лучше других известны озониды калия и аммония. Озониды имеют красный цвет и парамагнитны. Последнее обусловлено ионом О₃¯. Озониды могут рассматриваться как стабильные радикалы. Присоединение электрона к молекуле озона сопровождается выделением энергии примерно 2 эВ. Энергия разрыва связи О—О в ионе О₃¯, по-видимому, меньше энергии диссоциации молекулы О₃. В ряду молекулярных анионов кислорода О₃¯ наименее прочен, хотя длина связи у него меньше, чем у О₃ и О₂, и составляет (1,19 . . . 1,22) * 10¯⁸ см; центральный угол у иона О₃¯ около 100°.
В большинстве реакций окисления один атом кислорода входит в состав продуктов, а два выделяются в виде молекулы О₂. Одним из исключений из этого правила является пример с SO2:
3SO₂ + O₃ → 3SO₃
Константы реакций озона с различными газами в атмосфере в большинстве своем были уточнены в последние годы в связи с общим интересом к атмосферному озону. Исключение составляют реакции озона с окислами азота N0 и NO₂, изученные достаточно подробно еще в 50-е гг. Реакция
NO + O₃ → NO₂ + O₂
является главным каналом деструкции озона в атмосфере Земли. Она интересна также тем, что сопровождается хемилюминесценцией в видимой и ИК областях. Другая, важная для физики атмосферы, реакция
H + O₃ → OH + O₂
приводит также к возбуждению радикалов ОН и к возникновению мощной гидроксильной эмиссии на высотах 70 - 100 км.
В качестве одного из парадоксов следует отметить химическое взаимодействие довольно инертной молекулы азота с озоном при сравнительно низких температурах. Реакция
N₂ + O₃ → N₂O + O₂
протекает менее чем за 1 мин при 570К, но выход продуктов мал вследствие каталитического разложения озона. Другой интересный факт связан с неожиданно обнаруженной способностью озона окислять платину и ее аналоги.
Гетерогенные реакции озона (с поверхностями) представляют интерес по нескольким причинам, в связи с необходимостью транспортировать газовые смеси, содержащие озон, для подбора эффективных катализаторов — разрушителей озона в газовых промышленных отходах, для борьбы с сильным разрушающим действием озона на некоторые материалы (резины, пластики), используемые в авиации, электротехнике и других отраслях, а также при работе с озоном в лабораторных установках.
Стекло, фторопласты, некоторые металлы и их окисды (N₁, W, CrO₃, CdO, B1₂O₃) сравнительно мало влияют на скорость распада озона. Другие окислы более эффективны, например N₁O, N₁O—Fe₃O₄, гопкалит (смесь окислов марганца) увеличивают разложение в 10 ... 100 раз по сравнению с указанными выше. Особенно активно идет разложение на активированном угле, металлах переменной валентности (Mn, Co, Fe), фосфорном ангидриде Р₂О₅, перекиси бария ВаО₂. Большинство чистых металлов покрывается пленкой окисла: PbO₂, AgO или Ag₂O₃, HgO.
Взаимодействие озона с тефлоном (фторопластом), стеклом, нержавеющей сталью, алюминием, полиэтиленом, поливинилом, майларом и алюминиевой фольгой изучалось при пропускании воздуха с микроконцентрациями озона через трубки, сделанные из исследуемых материалов. Трубки из чистого тефлона пропускали озон без потерь. Стеклянные трубки для достижения такого эффекта требовали небольшого экспонирования в озоне. Трубки из нержавеющей стали, алюминиевые трубки и фольга, пленки из майлара должны были выдерживаться в озоне (при концентрациях порядка 10¯₂ млн¯¹) в течение нескольких часов, прежде чем они обеспечивали сохранность 90% и более от начального содержания озона. Более быстрая обработка озоном достигалась при нескольких экспонированиях в пределах от 5 до 15 мин при концентрациях 10 млн¯¹. Поверхности из тефлона являются наиболее подходящими, если учесть еще, что тефлон достаточно хороший вакуумный материал. Однако и тефлон может химически взаимодействовать с озоном, правда очень медленно, с выделением таких продуктов, как СО₂ и CF₂O .
Очень давно было замечено свойство озона разрушать натуральный каучук. Современные разновидности синтетического каучука обладают различной стойкостью к озону. Бутадиен-стирольная и бутадиен-нитрильная резины в этом отношении похожи на натуральный каучук. Напротив, этиленпропиленовый фторкаучук, а также сульфохлорированный полиэтилен характеризуются отличной стойкостью к действию озона. Разрушение каучука озоном используется как положительное свойство в некоторых простых методах количественного определения содержания озона в атмосферном воздухе.
Одна из важных реакций озона с неорганическими соединениями — разложение йодистого калия KI -широко используется в качестве одного из стандартных методов количественного определения озона.
К гетерогенным реакциям озона стали проявлять пристальный интерес в последние годы в связи с расчетом моделей озоносферы. Принципиальное значение для исследований проблемы тропосферного озона имеют расчеты глобального стока озона у поверхности Земли. По обобщенным данным, значения потока озона (в спокойном воздухе), направленного к поверхности, могут меняться в пределах двух порядков, от 10¹⁰ см¯² * с¯¹ для морской воды умеренных широт до 10¹² см¯² * с¯¹ для кустов можжевельника.
Определенный интерес для исследователей тропосферных процессов (гроз, дождей, туманов) имеет растворимость озона в воде и особенно ее зависимость от температуры. Данные по растворимости озона в воде сильно различаются у разных авторов. При нормальных условиях в 1 л воды растворяется 1 г озона; с уменьшением температуры растворимость увеличивается. Присутствие в растворах следов металлов переменной валентности, сильных кислот и других соединений приводит к каталитическому разложению озона.
В последние годы ряд зарубежных фирм использует в качестве растворителя озона при его больших концентрациях фторхлорметаны (фреоны). Озон, растворенный во фреоне, Относительно безопасен в обращении и может долгое время сохраняться в специальных баллонах, в которых он и транспортируется к потребителю.
В заключение стоит отметить очень важные и интересные хемилюминесцентные реакции озона с некоторыми органическими соединениями. Наиболее известна реакция с этиленом С₂Н₄. Насчитывается около 40 красителей, которые в той или иной степени флюоресцируют при наличии озона в воздухе. Таковы родамин С (в иностранной транскрипции В) — 3,6 бис-диэтиламинофлуорангидрохлорид, имеющий формулу C₂₈H₃ClN₂O₃, люминол C₈H₇N₃O₂ (3-аминофталгидразид), эозин — Y, феносафранин, рибофлавин, эйхрозин. Первые два были использованы при разработке чувствительных, быстрореагирующих анализаторов атмосферного озона.
