
- •Глава 1. Техника безопасности при выполнении лабораторной работы стр. 7
- •Глава 2. Требования к подготовке и выполнению лабораторных работ стр. 13
- •Глава 3 Электрохимические методы стр. 13
- •Глава 4. Практическая часть стр. 48
- •Глава 5. Экспериментальная часть стр. 57
- •Глава 6. Полярография стр. 68
- •6.2. Сущность метода стр. 70
- •Глава 1. Техника безопасности при выполнении лабораторной работы
- •1.1.Общие правила работы в химической лаборатории
- •1.2.Требования безопасности
- •1.3. Меры пожарной безопасности
- •1.4. Меры безопасности при работе со стеклянной посудой
- •1.5.Электробезопасность
- •1.6.Первая помощь при несчастных случаях
- •Глава 2. Требования к подготовке и выполнению лабораторных работ
- •Глава 3. Электрохимические методы
- •3.1. Вопросы
- •3.2. Задачи
- •3.3.Общие сведения
- •3.4. Ионоселективные электроды
- •Характеристики ионоселективных электродов
- •Виды ионоселективных электродов
- •3.5. Электроды сравнения
- •3.6. Ионометрия
- •3.6.1. Метод градуировочного графика
- •3.6.2. Метод добавок
- •3.7. Потенциометрическое титрование
- •3.7.1. Определение точки эквивалентности
- •3.8.Виды потенциометрического титрования
- •3.9.Блок потенциометрических измерений (Блок пи)
- •Глава 4. Практическая часть
- •4.1. Универсальный иономер эв-74
- •4.3. Иономер и-500
- •2. Измерение э.Д.С. Электродных систем.
- •Глава 5. Экспериментальная часть
- •5.1. Техника эксперимента
- •5.2. Определение содержания гидроксида калия в растворе
- •Определение содержания сульфата меди в растворе
- •5.4. Методы определения массовой концентрации фторидов (гост 4386-89)
- •Подготовка к работе фторидного электрода
- •Построение градуировочного графика
- •Ход определения
- •Обработка результатов
- •5.5. Определение средних и кислых карбонатов при их совместном присутствии
- •5.6. Определение иодид- и хлорид-ионов в их смеси
- •Глава 6. Полярография
- •6.1. Вопросы
- •В качестве индикаторного электрода могут использоваться ртутный, платиновый, графитовый и другие электроды.
- •7. Экспериментальная часть
- •7. 1. Определение произведения растворимости труднорастворимых веществ полярографическим методом
- •7.2. Определение константы растворимости хлорида свинца
- •7.3. Определение константы устойчивости и числа лигандов в комплексе полярографическим методом
- •7.4. Определение констант устойчивости комплекса с учетом конкурирующих процессов
- •Определение констант образования комплексов при ступенчатом комплексообразовании по методу Де Форда и Юма
- •Полярографический метод определения состава комплекса (металл – комплексон III)
- •Электрохимические датчики используемые в зонде (свойства, подготовка к работе, калибровка)
- •1 Электрод сравнения сильфонный
- •2 Электрод для измерения рН
- •3 Электрод для измерения Eh стеклянный
- •4 Электрод для измерения Eh платиновый
- •5 Электрод для измерения концентрации сероводорода и ионов сульфида
- •6 Электрод мембранный для определения no3-
- •8 Датчик кислорода
Характеристики ионоселективных электродов
Основными характеристиками ионоселективного электрода являются электродная функция, селективность и время отклика.
Зависимость потенциала от активности выражается прямой с наклоном, равным теоретическому, лишь в некотором ограниченном интервале. Для каждой системы существует предельная величина активности (концентрации), ниже которой система перестает подчиняться уравнению Нернста. В зависимости от природы окислительно-восстановительной системы эта величина колеблется в интервале 10-6-10-5 М. Электрод имеет нернстовскую электродную функцию в интервале активности (концентрации), где зависимость потенциала от рА (- lg аA) линейна и имеет угловой коэффициент 59,16/z A мВ/рА (250 С). Величина этого интервала зависит от природы мембраны.
Время отклика — это переходное время на изменение концентрации раствора, его определяют по зависимости потенциала электрода от времени с момента погружения в анализируемый раствор. В зависимости от природы мембраны время отклика может колебаться от нескольких секунд до нескольких минут. Чем меньше время отклика, тем лучше, особенно при непрерывных измерениях в потоке или при автоматизированных измерениях.
За диапазон определения принимают такую область электродной функции, в которой отклонения от линейности не превышают некоторую заданную величину, например рХ=0,2. При очень низких концентрациях (для хороших электродов порядка 106 М) электрод утрачивает электродную функцию (рис.1); точка перегиба на графике характеризует величину предела обнаружения.
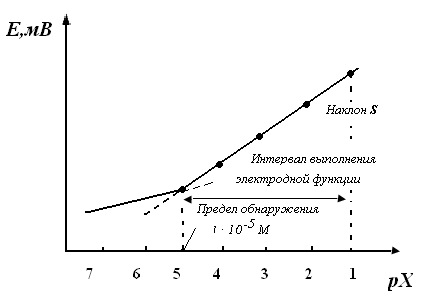
Рис.1 Интервал выполнения электродной функции и предел обнаружения ион-селективного электрода
Следующим по важности параметром идет температурный диапазон работы электрода. По этому параметру существует широкий выбор только для рН-электродов, для них доступна область измерений в пределах от 0 до 150°С. Для ионоселективных электродов модификаций с разными температурными диапазонами практически не бывает. В том случае, если не удается подобрать электроды с нужным температурным диапазоном, то проблема может быть решена нагревом или охлаждением анализируемого раствора. Электродная функция зависит от температуры (рис.2).
Р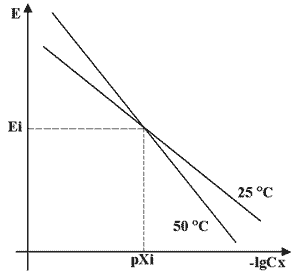 ис.
2. Зависимость электродной функции от
температуры:
ис.
2. Зависимость электродной функции от
температуры:
Сх - концентрация ионов X
pXi = - lg(Cx) - в изопотенциальной точке
Ei - потенциал электрода в изопотенциальной точке
С увеличением температуры увеличивается наклон (крутизна St) электродной характеристики. Крутизна электродной функции S —угловой коэффициент наклона градуировочного графика
Селективность электрода относительно определяемого иона в присутствии посторонних ионов определяется величиной ki/k пот, которая отражает относительное влияние ионов i и k на величину мембранного потенциала и характеризует способность мембраны различать ионы i, k и т.д. Величина ki/k пот показывает, на какое значение надо умножить активность мешающих ионов, чтобы получить на индикаторном электроде такое же изменение потенциала, как и для определяемых ионов приравной активности мешающих и определяемых ионов. Другими словами, ki/k пот показывает возможност работы электрода в присутствии мешающих ионов. Если ki/k пот < 1, электрод селективен относительно ионов i. Чем меньше числовая величина ki/k пот, тем выше селективность.
Существуют различные способы оценки величины ki/k пот. Чаще других используют метод смешанных растворов, основанный на измерении потенциала электрода в растворах с постоянной концентрацией мешающего иона k и переменной концентрацией определяемого иона i. Точка пересечения линейных участков полученной зависимости (рис. 3) дает величину аi, по которой рассчитывают ki/k пот = ki /a k zi /zk.
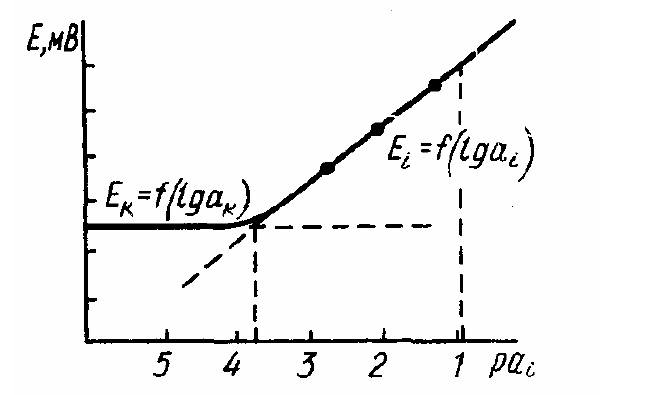
Рис 3. Определение коэффициента селективности методом смешанных растворов (а k=const).
Концентрация анализируемых ионов, при которой потенциал электрода не зависит от температуры, называется изопотенциальной точкой. Значения концентрации раствора и потенциала электрода в этой точке называют координатами изопотенциальной точки (pXi и Ei).
Для стеклянных электродов (рН и pNa) координаты изопотенциальной точки нормируется (указывается изготовителем), а для прочих измерительных электродов обычно нет.
Современные измерительные приборы позволяют автоматически учитывать температурные изменения электродной характеристики (термокомпенсация), для этого в прибор должны быть введены координаты изопотенциальной точки и текущая температура.
