
- •Глава 1. Техника безопасности при выполнении лабораторной работы стр. 7
- •Глава 2. Требования к подготовке и выполнению лабораторных работ стр. 13
- •Глава 3 Электрохимические методы стр. 13
- •Глава 4. Практическая часть стр. 48
- •Глава 5. Экспериментальная часть стр. 57
- •Глава 6. Полярография стр. 68
- •6.2. Сущность метода стр. 70
- •Глава 1. Техника безопасности при выполнении лабораторной работы
- •1.1.Общие правила работы в химической лаборатории
- •1.2.Требования безопасности
- •1.3. Меры пожарной безопасности
- •1.4. Меры безопасности при работе со стеклянной посудой
- •1.5.Электробезопасность
- •1.6.Первая помощь при несчастных случаях
- •Глава 2. Требования к подготовке и выполнению лабораторных работ
- •Глава 3. Электрохимические методы
- •3.1. Вопросы
- •3.2. Задачи
- •3.3.Общие сведения
- •3.4. Ионоселективные электроды
- •Характеристики ионоселективных электродов
- •Виды ионоселективных электродов
- •3.5. Электроды сравнения
- •3.6. Ионометрия
- •3.6.1. Метод градуировочного графика
- •3.6.2. Метод добавок
- •3.7. Потенциометрическое титрование
- •3.7.1. Определение точки эквивалентности
- •3.8.Виды потенциометрического титрования
- •3.9.Блок потенциометрических измерений (Блок пи)
- •Глава 4. Практическая часть
- •4.1. Универсальный иономер эв-74
- •4.3. Иономер и-500
- •2. Измерение э.Д.С. Электродных систем.
- •Глава 5. Экспериментальная часть
- •5.1. Техника эксперимента
- •5.2. Определение содержания гидроксида калия в растворе
- •Определение содержания сульфата меди в растворе
- •5.4. Методы определения массовой концентрации фторидов (гост 4386-89)
- •Подготовка к работе фторидного электрода
- •Построение градуировочного графика
- •Ход определения
- •Обработка результатов
- •5.5. Определение средних и кислых карбонатов при их совместном присутствии
- •5.6. Определение иодид- и хлорид-ионов в их смеси
- •Глава 6. Полярография
- •6.1. Вопросы
- •В качестве индикаторного электрода могут использоваться ртутный, платиновый, графитовый и другие электроды.
- •7. Экспериментальная часть
- •7. 1. Определение произведения растворимости труднорастворимых веществ полярографическим методом
- •7.2. Определение константы растворимости хлорида свинца
- •7.3. Определение константы устойчивости и числа лигандов в комплексе полярографическим методом
- •7.4. Определение констант устойчивости комплекса с учетом конкурирующих процессов
- •Определение констант образования комплексов при ступенчатом комплексообразовании по методу Де Форда и Юма
- •Полярографический метод определения состава комплекса (металл – комплексон III)
- •Электрохимические датчики используемые в зонде (свойства, подготовка к работе, калибровка)
- •1 Электрод сравнения сильфонный
- •2 Электрод для измерения рН
- •3 Электрод для измерения Eh стеклянный
- •4 Электрод для измерения Eh платиновый
- •5 Электрод для измерения концентрации сероводорода и ионов сульфида
- •6 Электрод мембранный для определения no3-
- •8 Датчик кислорода
4 Электрод для измерения Eh платиновый
1. Общие сведения, основные технические характеристики.
1.1. Электрод изготовлен из платины и предназначен для измерения окислительно-восстановительного потенциала в пределах от -О,5 до +1,8 В в диапазоне РН 0-14.
1.2. Температура анализируемой среды: О - 200ºС.
1.3 Давление анализируемой среды: 1 - 600 атм.
1.4. Ресурс - 1000 час.
1.5. Погрешность определения Eh в равновесных системах не более ±10мВ.
2. Конструкция электрода.
2.1. Электрод состоит из злектроввода, рабочей части электрода и соединительной трубки, изготовленной из маслостойкой резины и заполненной силиконовым маслом.
2.2. Рабочая часть электрода представляет собой платиновую проволоку 1, закрепленную в резиновой пробке (рисунок 23).
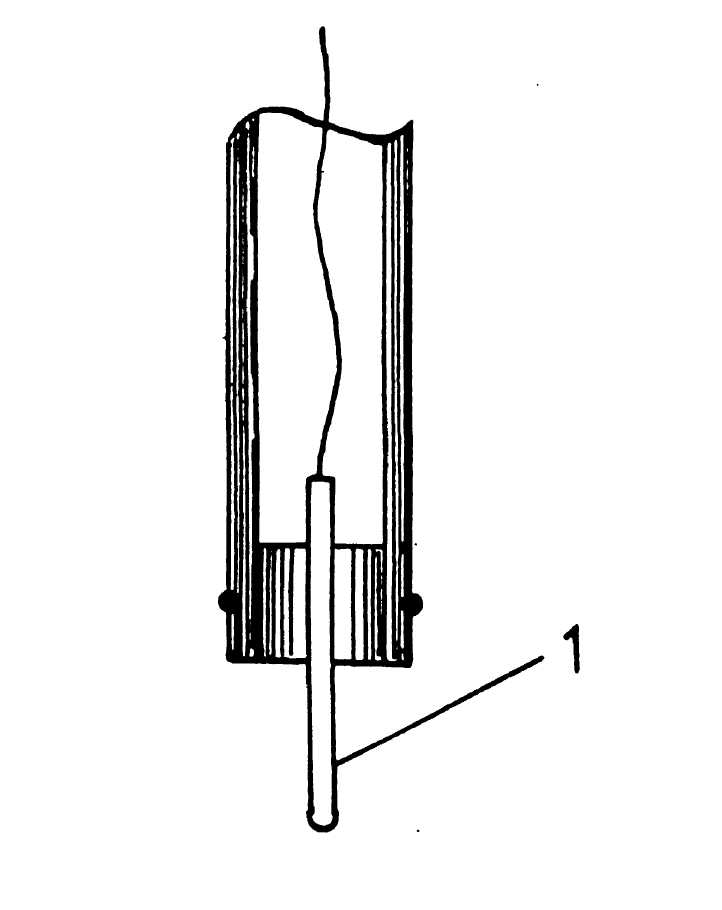
Рис. 23- Конструкция платинового Eh — электрода
3. Подготовка к работе и хранение.
3.1. Электрод не требует специальной подготовки к работе.
3.2. В промежутках между измерениями электрод хранить в сухом виде или в дистиллированной воде.
3.3. В случае появления ошибок при измерениях электрод в течение 5 мин выдержать в смеси концентрированной серной кислоты с концентрированной перекисью водорода, разбавленной в 2 раза дистиллированной водой. Если это не помогает - пошлифовать поверхность электрода мелкой наждачной шкуркой.
4. Проверка электрода.
4.1. Калибровать электрод не требуется. Проверка электрода производится в растворах железоцианидов калия. ЭДС цепи из Eh—электрода против стандартного выносного хлорсеребряного электрода сравнения ЭВЛ-1М <с насыщенным КС1) при 25 °С.
4.2. При образовании на поверхности электрода пленки органических веществ, ее следует снять, осторожно протирая спиртом или ацетоном.
5. Представление результатов.
5.1. Для перехода к величине Eh (потенциалу относительно стандартного водородного электрода) к измеряемой величине Е надо прибавить значение потенциала хлорсеребряного электрода, заполненного раствором ЗМ KCl, при соответствующей температуре.
5 Электрод для измерения концентрации сероводорода и ионов сульфида
1. Общие сведения, основные технические характеристики.
1.1. Электрод изготовлен с применением чувствительного элемента из серебряной проволоки, покрытой сульфидом серебра, или мембраны, изготовленной из сульфида серебра, и предназначен для определения активности (концентрации) ионов сульфида и концентрации сероводорода в интервале концентрации иона S2- 10-7 - 1моль/л.
1.2. Температура анализируемой среды: 0 - 175ºС.
1.3. Давление анализируемой среды: 1 – 1000 атм.
1.4. Крутизна характеристики электрода при 25ºС не менее 27мВ/лог. ед. S2- .
1.5. Электрическое сопротивление электрода при 25ºС не более: проволочного - 10кОм, мембранного - 1МОм.
1.6. Погрешность определения S2- не более ± 0, 1рS2- .
1.7. Ресурс электрода - 1год.
2. Конструкция электрода.
2.1. Электрод состоит из чувствительного элемента, электроввода и резиновой трубки, заполненной силиконовым маслом.
2.2. В качестве чувствительного элемента используется серебряная проволока 1 (рисунок 24), покрытая сульфидом серебра 2 или мембрана 1, спрессованная из сульфида серебра (рисунок 25).
3. Хранение и подготовка к работе.
3.1. Электрод следует хранить в сухом виде.Перед работой электрод следует вымочить в дистиллированной воде.
3.2. При образовании на поверхности электрода пленки органических веществ, ее следует снять, осторожно промывая спиртом или ацетоном. При необходимости свойства прессованного сульфидсеребряного электрода можно восстановить шлифовкой рабочей поверхности мембраны мелкой наждачной шкуркой.
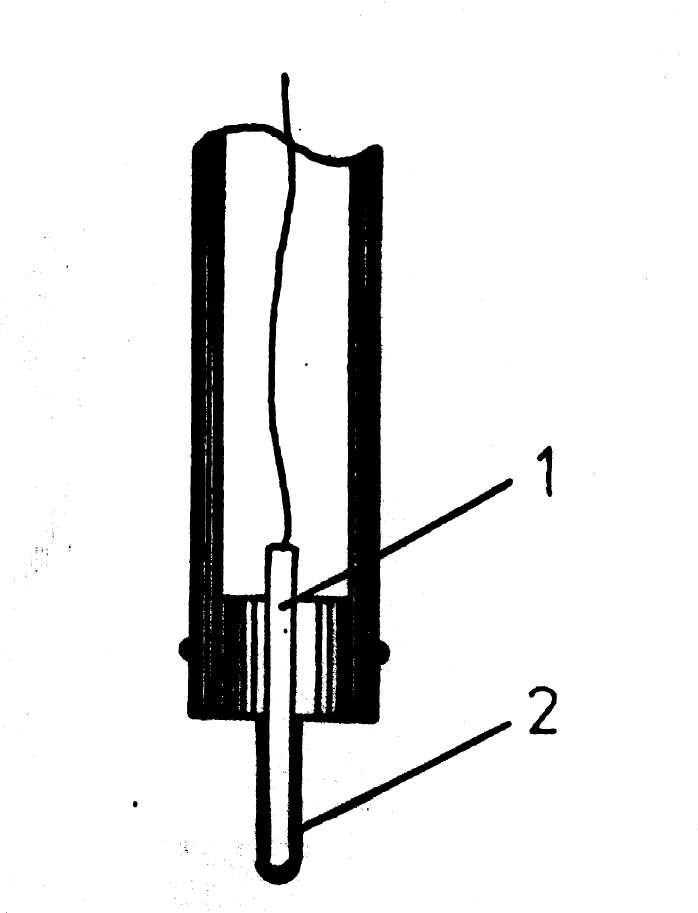
Рис. 24 - Конструкция проволочного сульфидсеребряного электрода
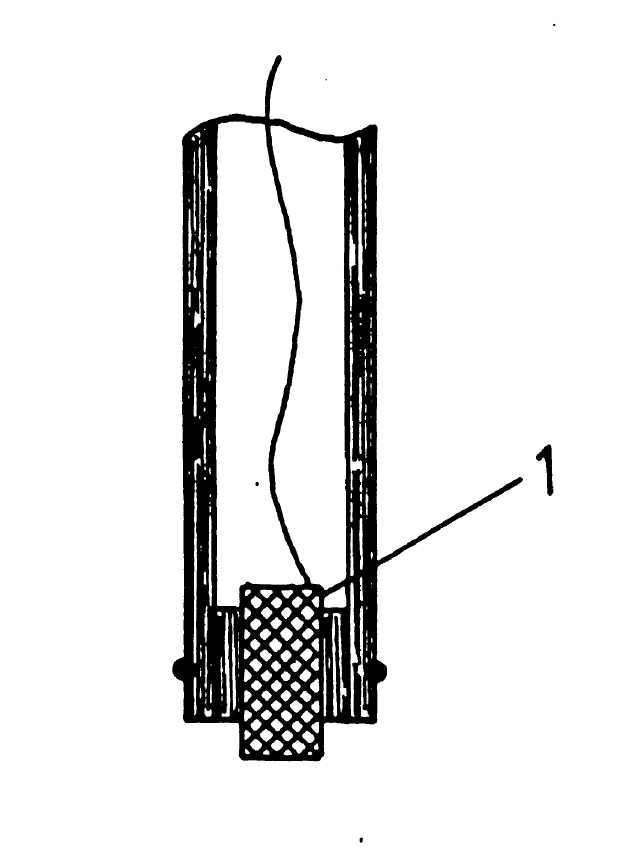
Рис. 15 - Конструкция мембранного сульфидсеребряного электрода
4. Калибровка сульфидного электрода по сероводороду.
4.1. Калибровка сульфидного электрода производится в буферных растворах, насыщаемых сероводородом с одновременным измерением температуры, рН, атмосферного давления и ЭДС сульфидного электрода относительно электрода сравнения при той же температуре.
На электроде происходит реакция
Ag2S + 2Н+ + 2е- = Ag + H2S
ЭДС этой реакции равна
E=E0+(RT/2F)*ln([H+]2/[H2S])=E0-ln10*RT*pH/F-(RT/2F)*ln[H2S]
где [H2S] - парциальное давление сероводорода, равное атмосферному давлению, за вычетом давления паров воды при этой температуре.
На практике применяется величина концентрации сероводорода, равная табличной растворимости сероводорода (при 1атм H2S), умноженной на парциальное давление сероводорода и деленной на измеренное атмосферное давление.
Для каждой температуры строится график зависимости величины E+(RT/2F)*ln[H2S] от pН для области pН < pК диссоциации сероводорода. Эти линии должны пересекаться в одной точке. Для каждой температуры рассчитывается тангенс угла наклона калибровочного графика. Для области pH > pК при каждой температуре строится прямая через пересечение калибровочного графика с величиной pН = pК при этой температуре, но с тангенсом угла наклона вдвое меньшим, чем рассчитанный ранее.
При измерениях вместе с величиной ЭДС системы необходимо измерять температуру и pН. Далее по калибровочному графику находится величина E0-lnl0*RT*pH/F. Концентрация сероводорода рассчитывается из уравнения
(RT/2F)*ln[H2S] = -Е + (Е0 – lnl0*RT*pH/F)
4.2. Калибровку следует производить в буферных растворах с pН 1,68, 4,01, 6,86, 9,18 при не менее чем трех температурах.
4.3. Буферные растворы насыщаются сероводородом барботированием при температуре калибровки не менее 20 минут.
4.4. Одновременно измеряются температура раствора, атмосферное давление, pН и ЭДС сульфидного электрода относительно электрода сравнения.
4.5. Раствор следует перемешивать магнитной мешалкой.
4.б. Обработка результатов калибровки производится по следующей схеме:
для каждой температуры рассчитывается концентрация сероводорода по формуле
CH2S=CTH2S*(Pобщ-РН2О)/Р
где CTH2S - табличная растворимость сероводорода при данной температуре, Робщ - атмосферное давление, PН2О - табличное значение давления паров воды при этой температуре, Р - нормальное атмосферное давление.
4.7. Для каждой точки рассчитывается величина
E*=E+(RT/2F)*lnСH2S
4.8. Для каждой температуры строится график зависимости величины Е* от pН, для pН < pК диссоциации сероводорода при данной температуре.
4.9. Ищется точка пересечения калибровочного графика при каждой температуре с величиной pН = pК диссоциации сероводорода при данной температуре. Через эту точку производится прямая в область pН > pК С тангенсом угла наклона вдвое меньшим, чем тангенс угла наклона построенной части калибровочного графика. Если есть точка калибровки с pН > pК, прямая должна пройти через нее.
5.Проведение измерений концентрации сероводорода.
5.1. При проведении измерений необходимо измерять ЭДС сульфидного электрода относительно электрода сравнения, температуру и pН.
5.2. Находится точка пересечения калибровочного графика при данной температуре с измеренной величиной рН и определяется соответствующая величина Е*.
5.3. Концентрация сероводорода рассчитывается из уравнения
(RT/2F)*lnCH2S = Е* - Е
6. Калибровка по активности сульфид-иона.
6.1. Калибровку следует производить, по крайней мере, по двум растворам, охватывающим начало и коней измеряемого диапазона pS.
6.2. В качестве калибровочных при определении активности S2- используются буферные растворы.
6.3. Перед погружением электрода в раствор он ополаскивается дистиллированной водой. Оставшиеся капли воды осторожно снимаются с мембраны фильтровальной бумагой.
6.4. При калибровке желательно перемешивание растворов с помощью магнитной мешалки (особенно важно при низких концентрациях S2-)
6.5. Калибровку можно производить по отношению либо к погружному электроду сравнения, либо к обычному стандартному электроду сравнения ЭВЛ-1М. В последнем случае при измерениях зондом надо вводить поправку на разницу потенциала электродов сравнения (в пределах 6-10 мВ).
6.6. Для перехода от активности к концентрации необходимо учесть коэффициент активности S2-, зависящий от ионной силы исследуемого раствора.
6.7. Результаты калибровки наносятся на диаграмму в координатах pS - Е. Для каждой температуры строится калибровочный график (он должен представлять прямую линию). Определяется тангенс угла наклона калибровочных графиков (в идеальном случае он равен bТ = lnl0*R/2F, или при 25°С около 29 мВ/рН) И величина b (при 25ºС b ≈ 0,099 мВ/рН*Т>. Определяются координаты точки пересечения калибровочных графиков (изопотенциальной точки, т.е. точки, где эдс системы при фиксированном pS не зависит от температуры) Еisp и pSisp.
6.8. При измерениях PS рассчитывается по уравнению:
![]()
Таблица 7 - Растворимость сероводорода в воде (в моль на кг Н2О) и значения отрицательного логарифма первой константы диссоциации сероводородной кислоты.
tºC |
Растворимость при давлении Н2S = 1атм |
Растворимость при общем давлении = 1атм |
рК1 Н2S |
0 |
0,211 |
0,21 |
7,43 |
5 |
0,18 |
0,178 |
7,33 |
10 |
0,154 |
0,152 |
7,23 |
15 |
0,133 |
0,131 |
7,15 |
20 |
0,117 |
0,114 |
7,07 |
25 |
0,103 |
0,1 |
7 |
30 |
0,092 |
0,088 |
6,93 |
40 |
0,075 |
0,07 |
6,82 |
50 |
0,0629 |
0,055 |
6,73 |
60 |
0,0537 |
0,043 |
6,66 |
70 |
0,0463 |
0,032 |
6,6 |
80 |
0,0414 |
0,024 |
6,56 |
90 |
0,0385 |
0,012 |
6,53 |
100 |
0,0366 |
- |
6,51 |
Таблица 8 - Значения pS контрольных растворов
Состав раствора |
Значение pS в диапазоне температур от 0 до 60ºС |
Исходные данные |
0,1М Na2S*9H2O+1M NaOH+1 г/л аскорбиновой кислоты |
0,9 |
концентрированный раствор NaOH, 1M раствор Na2S*9H2O |
0,01М Na2S*9H2O+1M NaOH+1 г/л аскорбиновой кислоты |
1,9 |
- " - |
0,1М NaOH (свободный от карбонатов), насыщенный при нормальном давлении сероводородом + 1 г/л аскорбиновой кислоты |
7,1 |
концентрированный раствор NaOH |
H2SO4 (1:4) и FeS для H2S |
||
0,05М бифталат калия, насыщенный при нормальном атмосферном давлении сероводородом |
12,9 |
фиксанал 4,0 рН |
H2SO4 (1:4) и FeS для H2S |
||
0,05М бифталат калия + 0,1М HCl, насыщенный сероводородом |
18,7 |
фиксанал 4,0 рН |
фиксанал HCl |
||
H2SO4 (1:4) и FeS для H2S |
Таблица 9 - Значения pS контрольных растворов
Состав раствора |
Значение pS при 25ºС |
Потенциал относительно насыщ. AgCl электрода при 25ºС |
0,1М Na2S*9H2O+1M NaOH+1 г/л аскорбиновой кислоты |
0,9 |
-831±15 |
0,01М Na2S*9H2O+1M NaOH+1 г/л аскорбиновой кислоты |
1,9 |
-796±15 |
0,1М NaOH (свободный от карбонатов), насыщенный при нормальном давлении сероводородом + 1 г/л аскорбиновой кислоты |
7,1 |
-630±15 |
0,05М бифталат калия, насыщенный при нормальном атмосферном давлении сероводородом |
12,9 |
-460±15 |
0,05М бифталат калия + 0,1М HCl, насыщенный сероводородом |
18,7 |
-300±15 |
