
- •Глава 1. Техника безопасности при выполнении лабораторной работы стр. 7
- •Глава 2. Требования к подготовке и выполнению лабораторных работ стр. 13
- •Глава 3 Электрохимические методы стр. 13
- •Глава 4. Практическая часть стр. 48
- •Глава 5. Экспериментальная часть стр. 57
- •Глава 6. Полярография стр. 68
- •6.2. Сущность метода стр. 70
- •Глава 1. Техника безопасности при выполнении лабораторной работы
- •1.1.Общие правила работы в химической лаборатории
- •1.2.Требования безопасности
- •1.3. Меры пожарной безопасности
- •1.4. Меры безопасности при работе со стеклянной посудой
- •1.5.Электробезопасность
- •1.6.Первая помощь при несчастных случаях
- •Глава 2. Требования к подготовке и выполнению лабораторных работ
- •Глава 3. Электрохимические методы
- •3.1. Вопросы
- •3.2. Задачи
- •3.3.Общие сведения
- •3.4. Ионоселективные электроды
- •Характеристики ионоселективных электродов
- •Виды ионоселективных электродов
- •3.5. Электроды сравнения
- •3.6. Ионометрия
- •3.6.1. Метод градуировочного графика
- •3.6.2. Метод добавок
- •3.7. Потенциометрическое титрование
- •3.7.1. Определение точки эквивалентности
- •3.8.Виды потенциометрического титрования
- •3.9.Блок потенциометрических измерений (Блок пи)
- •Глава 4. Практическая часть
- •4.1. Универсальный иономер эв-74
- •4.3. Иономер и-500
- •2. Измерение э.Д.С. Электродных систем.
- •Глава 5. Экспериментальная часть
- •5.1. Техника эксперимента
- •5.2. Определение содержания гидроксида калия в растворе
- •Определение содержания сульфата меди в растворе
- •5.4. Методы определения массовой концентрации фторидов (гост 4386-89)
- •Подготовка к работе фторидного электрода
- •Построение градуировочного графика
- •Ход определения
- •Обработка результатов
- •5.5. Определение средних и кислых карбонатов при их совместном присутствии
- •5.6. Определение иодид- и хлорид-ионов в их смеси
- •Глава 6. Полярография
- •6.1. Вопросы
- •В качестве индикаторного электрода могут использоваться ртутный, платиновый, графитовый и другие электроды.
- •7. Экспериментальная часть
- •7. 1. Определение произведения растворимости труднорастворимых веществ полярографическим методом
- •7.2. Определение константы растворимости хлорида свинца
- •7.3. Определение константы устойчивости и числа лигандов в комплексе полярографическим методом
- •7.4. Определение констант устойчивости комплекса с учетом конкурирующих процессов
- •Определение констант образования комплексов при ступенчатом комплексообразовании по методу Де Форда и Юма
- •Полярографический метод определения состава комплекса (металл – комплексон III)
- •Электрохимические датчики используемые в зонде (свойства, подготовка к работе, калибровка)
- •1 Электрод сравнения сильфонный
- •2 Электрод для измерения рН
- •3 Электрод для измерения Eh стеклянный
- •4 Электрод для измерения Eh платиновый
- •5 Электрод для измерения концентрации сероводорода и ионов сульфида
- •6 Электрод мембранный для определения no3-
- •8 Датчик кислорода
3 Электрод для измерения Eh стеклянный
1. Общие сведения, основные технические характеристики.
1.1. Электрод изготовлен с использованием чувствительного элемента (стеклянного шарика) от электрода 121 (Ленинградский Государственный Университет, кооператив "Потенциал” и предназначен для измерения окислительно—восстановительного потенциала в пределах от —0,5 до +1,8 в диапазоне рН 0—14.
1.2. Температура анализируемой среды: 0 — 80°С.
1.3. Давление анализируемой среды: 1—600 атм.
1.4. Ресурс - 1000 час.
1.5. Погрешность определения Eh в равновесных системах не более ±10мВ.
2. Конструкция электрода.
2.1. Электрод состоит из электроввода, рабочей части электрода и соединительной трубки, изготовленной из маслостойкой резины и заполненной силиконовым маслом.
2.2. Рабочая часть электрода (рисунок 22) представляет собой стеклянную трубку (стекло С—090) с чувствительным элементом 1, изготовленным из титаносиликатного стекла. Шарик металлизирован изнутри и набит медной стружкой 3, обеспечивающей контакт вывода 2 с чувствительным элементом. Стружка уплотнена пробкой из фторкаучуковой резины, через которую проходит вывод из провода МГТФ.
3. Подготовка к работе и хранение.
3.1. Шарик электрода перед эксплуатацией надо вымочить в течение 24 часов в растворе железоцианидов калия 0,05М K3[Fe(CN)6]+ 0,05М K4[Fe(CN)6], приготовленного на буферном растворе рН-6,86.
3.2. В промежутках между измерениями электрод хранить в том же растворе или дистиллированной воде. При длительном перерыве – электрод промыть дистиллированной водой, высушить фильтровальной бумагой и хранить в сухом виде.
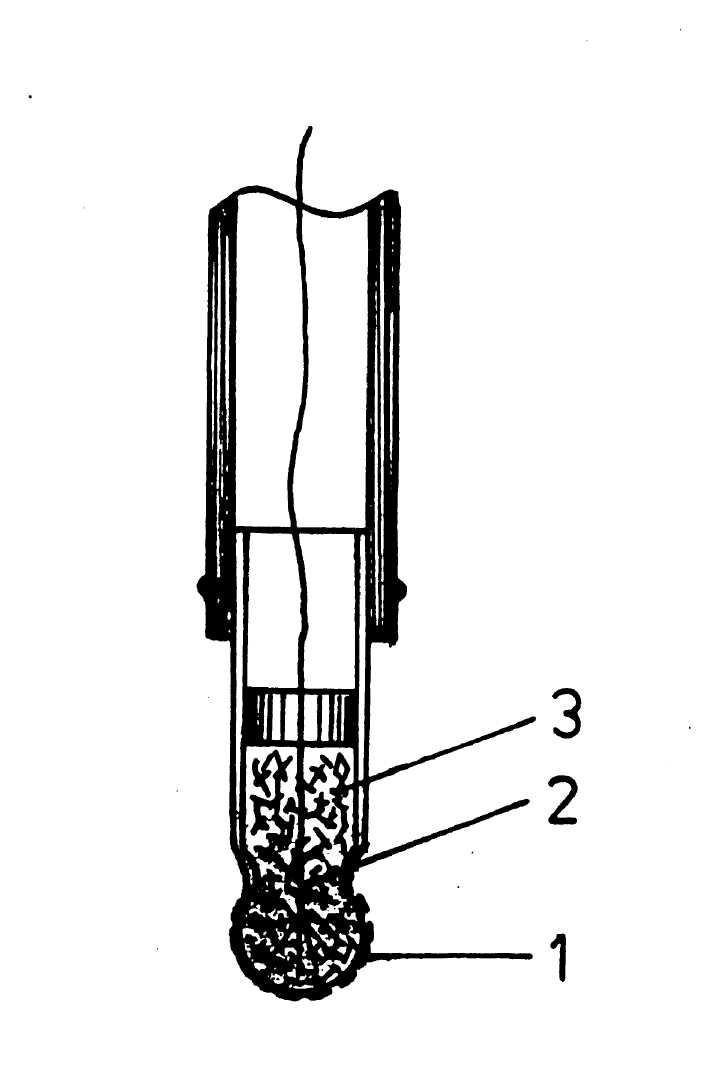
Рис. 22 - Конструкция стеклянного Eh - электрода
4. Проверка электрода.
4. 1. Калибровать электрод не требуется. Проверка электрода производится в растворах железоцианидов калия. ЭДС цепи из Eh-элетрода против стандартного выносного хлорсеребряного электрода сравнения ЭВЛ-1М (с насыщенным KCl) при 25 ºС смотрите в таблице 5.
4.2. При образовании на поверхности электрода пленки органических веществ, ее следует снять, осторожно протирая спиртом или ацетоном.
4.3. При ухудшении характеристик рекомендуется обновить рабочую поверхность обработкой травильной смесью (концентрированные HF и HNО3 в объёмном соотношении 1:3) в течение 10—15 сек с тщательной последующей промывкой дистиллированной водой и удалением продуктов разрушения стекла с помощью фильтровальной бумаги.
5. Представление результатов.
5.1. Для перехода к величине Eh (потенциалу относительно стандартного водородного электрода) к измеряемой величине Е надо прибавить значение потенциала используемого хлорсеребряного электрода при соответствующей температуре (см. таблицу. 6).
Таблица 6 - ЭДС системы окислительно-восстановительный электрод – насыщенный хлорсеребряный электрод сравнения в буферных растворах различного состава при 25ºС
Состав раствора |
Е, мВ |
||
|
Концетрация, моль/л |
||
K3[Fe(CN)6] |
K4[Fe(CN)6] |
||
Н2О |
0,041 |
0,009 |
272±5 |
Н2О |
0,05 |
0,05 |
246±5 |
Н2О |
0,0005 |
0,0005 |
213±10 |
рН-6,86 |
0,05 |
0,05 |
253±5 |
рН-6,86 |
0,0005 |
0,0005 |
217±5 |
рН-6,86 |
0,0001 |
0,0001 |
216±10 |
