
- •Передмова.
- •1. Основні поняття та закони термодинаміКи
- •Задачі для самостійного вирішення
- •2. Термодинамічні політропні процеси з ідеальними газами
- •З урахуванням виразу :
- •Характеристики політропних процесів
- •Задачі для самостійного вирішення
- •Значення ізобарної, ізохорної теплоємностей та показника адіабати
- •3. Властивості і процеси реальних газів і парів
- •Задачі для самостійного вирішення
- •4. Цикли паросилових і холодильних установок
- •Задачі для самостійного вирішення
- •5. Основи теплообміну
- •Задача для самостійного вирішення
2. Термодинамічні політропні процеси з ідеальними газами
Задачі аналізу і загальні аналітичні залежності. Задачами аналізу є встановлення закономірностей зміни параметрів стану робочого тіла і виявлення особливостей перетворення енергії.
Враховуючи,
що в ізохорному процесі
![]() і робота
і робота
![]() ,
вираз першого закону термодинаміки
набуває вигляду:
,
вираз першого закону термодинаміки
набуває вигляду:
![]() .
(2.1)
.
(2.1)
Кількість теплоти можна виразити через середню теплоємність:
![]() .
(2.2)
.
(2.2)
З (2.1) і (2.2) випливає:
![]() ,
або в диференціальній формі
,
або в диференціальній формі
![]() .
(2.3)
.
(2.3)
Із виразу першого закону термодинаміки для ізобарного процесу випливає:
![]() ,
або
,
або
![]() .
(2.4)
.
(2.4)
Кількість теплоти, виражена через середню теплоємність:
![]() або
в диференціальній формі
або
в диференціальній формі
![]() .
(2.5)
.
(2.5)
Тоді:
![]() або
або
![]() .
(2.6)
.
(2.6)
У диференціальній формі:
![]() .
(2.7)
.
(2.7)
Для розрахунку зміни питомої ентропії в політропному процесі використовуємо об'єднаний вираз 1-го і 2-го законів термодинаміки для оборотних процесів:
![]() або
або
![]() .
(2.8)
.
(2.8)
![]() або
або
![]() .
(2.9)
.
(2.9)
Замінивши
в цих виразах
і
,
і враховуючи, що
![]() ;
;
![]() ,
отримаємо:
,
отримаємо:
![]() ;
(2.10)
;
(2.10)
![]() .
(2.11)
.
(2.11)
Після інтегрування для кінцевого процесу 1-2 маємо:
![]() .
(2.12)
.
(2.12)
![]() .
(2.13)
.
(2.13)
Ізохорний
процес
(![]() ).
Процес може протікати з підвищенням
(
).
Процес може протікати з підвищенням
(![]() )
або зниженням (
)
або зниженням (![]() )
тиску (рис. 2.1).
)
тиску (рис. 2.1).
Р ис.
2.1. Графіки ізохорного процесу.
ис.
2.1. Графіки ізохорного процесу.
Із рівняння стану ідеального газу випливає закон Шарля:
![]() ;
;
![]() ;
;
![]() .
(2.14)
.
(2.14)
Оскільки , то з рівняння 1-го закону термодинаміки випливає, що:
![]() .
(2.15)
.
(2.15)
Зміна
ентропії згідно з (2.12) при
![]()
![]() ,
або згідно з (2.14)
,
або згідно з (2.14)
![]() .
(2.16)
.
(2.16)
Оскільки
![]() ,
то частка теплоти, яка йде на зміну
внутрішньої енергії:
,
то частка теплоти, яка йде на зміну
внутрішньої енергії:
![]() .
(2.17)
.
(2.17)
Оскільки
![]() ,
то робота в цьому процесі дорівнює нулю:
,
то робота в цьому процесі дорівнює нулю:
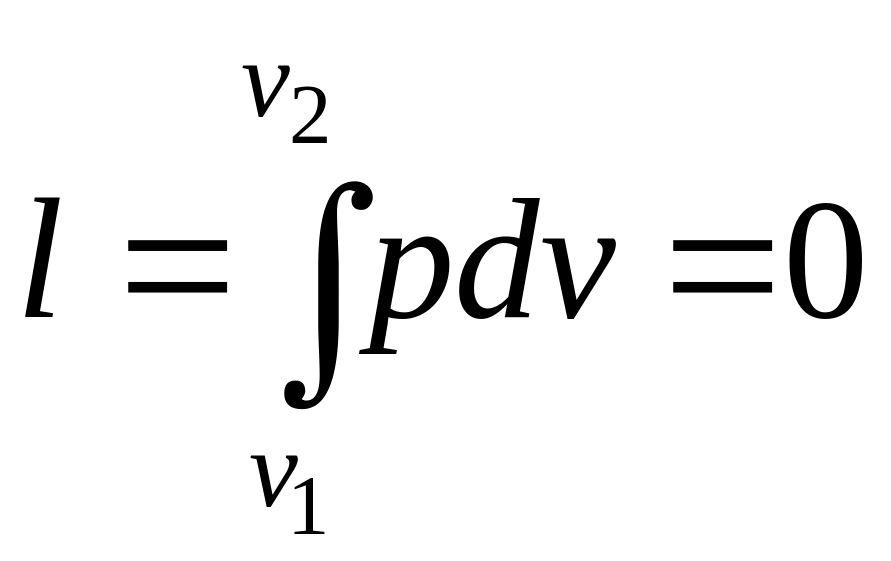 .
.
Таким чином, підведена до газу в ізохорному процесі теплота цілком йде на збільшення його внутрішньої енергії.
Ізобарний
процес
(![]() ).
З рівняння стану ідеального газу при
(рис.
2.2) випливає закон Гей-Люссака:
).
З рівняння стану ідеального газу при
(рис.
2.2) випливає закон Гей-Люссака:
![]() ;
;
![]() ;
;
![]() .
(2.18)
.
(2.18)
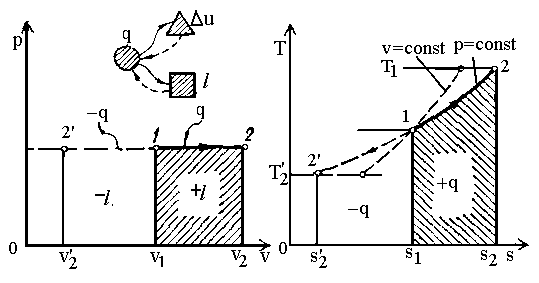
Рис.2.2. Графіки ізобарного процесу.
Робота в процесі:
 .
(2.19)
.
(2.19)
Оскільки
для ідеального газу
![]() ,
то:
,
то:
![]() .
(2.20)
.
(2.20)
Отже, питома газова стала R – це робота, яка виконується 1кг газу в процесі p=const при його нагріванні на один градус. Розмірність R: Дж/(кгК).
Кількість
теплоти в цьому випадку, при
![]() ,
згідно другої форми запису рівняння
першого закону
,
згідно другої форми запису рівняння
першого закону
![]() :
:
. (2.21)
Таким чином, уся теплота, підведена до газу в ізобарному процесі, витрачається на збільшення його ентальпії.
Ця теплота для ідеального газу дорівнює:
. (2.22)
Зміна
ентропії, згідно з (2.13) при
![]() :
:
![]() ,
або, згідно з (2.18)
,
або, згідно з (2.18)
![]() .
(2.23)
.
(2.23)
Оскільки
![]() ,
то ізобара в
координатах більш полога логарифмічна
крива, ніж ізохора.
,
то ізобара в
координатах більш полога логарифмічна
крива, ніж ізохора.
Коефіцієнт розподілу теплоти в процесі дорівнює:
![]() ,
,
![]() .
(2.24)
.
(2.24)
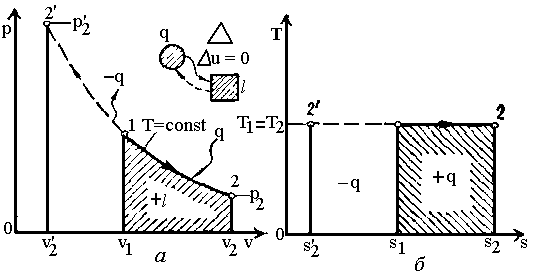
Ізотермний
процес
(![]() ).
З рівняння стану ідеального газу при
(рис. 2.3) витікає закон Бойля-Маріотта:
).
З рівняння стану ідеального газу при
(рис. 2.3) витікає закон Бойля-Маріотта:
![]()
 ;
;
![]() ;
;
![]() ;
;
![]() (2.25)
(2.25)
Рис.2.3. Графіки ізотермного процесу.
Зміна
внутрішньої енергії і ентальпії
![]() і
і
![]() ,
оскільки
,
оскільки
![]() .
Отже, вся теплота, яка підводиться,
витрачається на роботу:
.
Отже, вся теплота, яка підводиться,
витрачається на роботу:
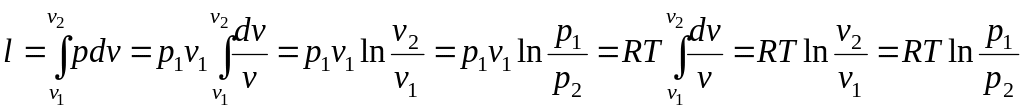 .
(2.26)
.
(2.26)
Теплота, необхідна для здійснення процесу:
![]() .
(2.27)
.
(2.27)
З виразів (2.26), (2.27) і (2.25) отримаємо:
![]() .
(2.28)
.
(2.28)
Частка теплоти, яка витрачається на зміну внутрішньої енергії:
![]() .
(2.29)
.
(2.29)
А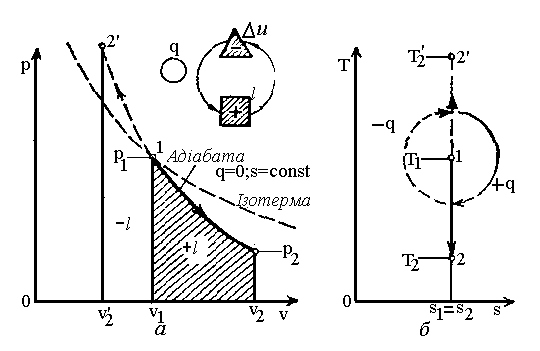 діабатний
процес
(
діабатний
процес
(![]() ;
;![]() )
– це процес, що протікає без зовнішнього
теплообміну (рис. 2.4).
)
– це процес, що протікає без зовнішнього
теплообміну (рис. 2.4).
Рис.2.4. Графіки адібатного процесу.
Якщо записати для цього випадку рівняння 1-го закону термодинаміки у вигляді:
![]() чи
чи
![]() ,
(2.30)
,
(2.30)
![]() чи
чи
![]() ,
(2.31)
,
(2.31)
то після ділення (2.30) на (2.31) одержимо показник адіабати:
![]() .
(2.32)
.
(2.32)
Тоді
після інтегрування виразу
![]() для кінцевого процесу 1-2 будемо мати:
для кінцевого процесу 1-2 будемо мати:
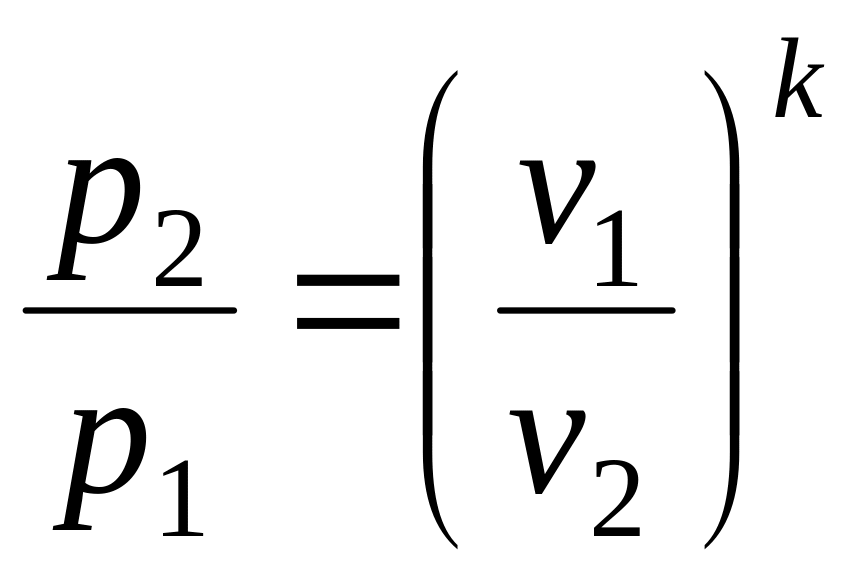 ,
чи
,
чи
![]() .
(2.33)
.
(2.33)
Співвідношення між параметрами стану для двох точок в цьому процесі:
 і
і
 .
(2.34)
.
(2.34)
З
рівняння 1-го закону термодинаміки
випливає, що
![]() ,
тобто:
,
тобто:
![]() ,
або
,
або
![]() .
(2.35)
.
(2.35)
