
- •Т.Г. Крупнова, ю.И. Сухарев аналитическая химия Учебное пособие по лабораторным работам
- •Введение
- •Лабораторная работа №1 техника выполнения титриметрического анализа. Запись и обработка результатов анализа
- •1.1. Работа с аналитическими весами
- •1.2. Работа с мерной посудой
- •1.3. Обработка и запись результатов анализа
- •2.1. Бихроматометрическое определение двухвалентного железа
- •Лабораторная работа №2 кислотно-основное титрование карбонат-иона и смесей с ним
- •1.1. Кислотно-основное титрование
- •Лабораторная работа №3 определение общей и карбонатной жесткости воды
- •1.1. Комплексонометрическое титрование
- •1.2. Жесткость воды
- •Лабораторная работа №4 фотометрический анализ меди с диэтилдитиокарбаматом натрия
- •1.1. Спектрофотометрический анализ
- •1.2. Закон Бугера – Ламберта – Бера
- •Библиографический список
- •Оглавление
1.2. Жесткость воды
Когда природная вода протекает через почвенные слои, легко растворимые соли экстрагируются из почвы в воду, обуславливая тем самым жесткость воды. В основном жесткость природных вод характеризует содержание в них ионов Ca2+ и Mg2+ (до некоторой степени также Fe2+, Fe3+). Общая жесткость количественно выражается числом миллиграмм-эквивалентов растворимых солей кальция и магния в 1 л воды. Таким образом, общая жесткость воды складывается из кальциевой и магниевой жесткости.
Выделяют также карбонатную жесткость, обусловленную содержанием гидрокарбонатов кальция и магния, и некарбонатную, обусловленную содержанием сульфатов, хлоридов, бисиликатов и т. д. кальция и магния. При нагревании воды нарушается карбонатное равновесие (уменьшается содержание СО2), вследствие чего гидрокарбонаты переходят в карбонаты:
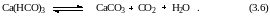
Растворимость карбонатов кальция и магния значительно меньше, чем гидрокарбонатов, поэтому при нагревании жесткость воды снижается. Этим процессом пользуются при умягчении воды кипячением. Отметим, что при кипячении удаляется не вся карбонатная жесткость воды, поскольку карбонаты, хотя и незначительно, но все же растворимы в воде. При нагревании удаляется частично и кальциевая некарбонатная жесткость, обусловленная сульфатом кальция, так как снижается растворимость сульфата кальция (гипса). Жесткость, удаляемая кипячением, называется устранимой или временной. Разность между карбонатной и устранимой жесткостью называют остаточной. Постоянная жесткость – это жесткость не устранимая кипячением. Сумма временной и постоянной жесткости представляет собой общую жесткость воды.
Жесткость питьевой воды согласно СанПиН 2.1.4.1074 – 01 [6] не должна превышать 7 мг-экв/л.
Карбонатную жесткость, обусловленную присутствием в воде бикарбонатов кальция и магния, определяют титрованием пробы соляной кислотой в присутствии метилового оранжевого. Общую жесткость определяют трилонометрическим титрованием в щелочной среде. Определению общей жесткости мешают ионы марганца, меди, цинка, высокое содержание углекислых и двууглекислых солей. Мешающее влияние устраняют в ходе анализа. Например, марганец, окисляясь на воздухе, мешает определению; внешне это выражается в том, что раствор постепенно обесцвечивается, приобретая серый цвет. Чтобы препятствовать окислению добавляют восстановители, например, гидроксиламин солянокислый.
Некарбонатную жесткость определяют по разности между общей жесткостью и карбонатной. Устранимую жесткость определяют по разности содержания бикарбонат ионов до и после кипячения.
2. Практическая часть
2.1. Определение общей жесткости воды
2.1.1. Цель работы
Ознакомление с основами трилонометрического титрования. Получение представлений об общей жесткости воды, самостоятельное проведение аналитического определения этого вида жесткости.
2.1.2. Оборудование
Пипетки.
Бюретка.
Колбы конические.
2.1.3. Реактивы
Трилон Б, 0,1 Н раствор.
Аммиачная буферная смесь с рН 9…10.
Гидроксиламин солянокислый, твердый.
Эриохром черный Т, растертый с хлоридом натрия (1:200)
Определение общей жесткости воды
Порядок выполнения работы
Получить у преподавателя исследуемую воду. Мерной колбой отмерить аликвоту, равную 50 мл, перенести в колбу для титрования, добавить 5 мл аммиачного буферного раствора, индикатор эриохром черный Т на кончике шпателя. Титровать по каплям раствором трилона Б до изменения окраски индикатора из винно-красной в синюю (при меньшем количестве индикатора из розовой в голубую). Титрование повторяют до трех сходящихся результатов.
Рассчитать общую жесткость по формуле
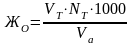 (мг-экв/л),
(мг-экв/л),
где VТ – объем трилона Б, пошедшего на титрование, мл;
NТ – нормальность трилона Б;
Vа – объем аликвотной части раствора, 50 мл.
Результаты обработать методами математической статистики, найти среднее значение общей жесткости воды и доверительный интервал.
2.2. Определение карбонатной жесткости воды
2.2.1. Цель работы
Ознакомление с основами ацидиметрического титрования. Получение представлений о карбонатной жесткости воды, самостоятельное проведение аналитического определения этого вида жесткости.
2.2.2. Оборудование
Пипетки.
Бюретка.
Колбы конические.
2.2.3. Реактивы
Кислота соляная, 0,1 Н раствор.
Метиловый оранжевый, 0,1%-ный водный раствор.
2.2.4. Порядок выполнения работы
Мерной колбой отмерить аликвоту исследуемого раствора равную 100 мл, перенести в колбу для титрования, добавить 2…3 капли метилового оранжевого. Титровать раствором 0,1 Н соляной кислоты до изменения желтой окраски индикатора в устойчивую оранжевую. Титрование повторяют до трех сходящихся результатов.
Рассчитать карбонатную жесткость по формуле
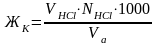 (мг-экв/л),
(3.8)
(мг-экв/л),
(3.8)
где VHCl – объем соляной кислоты, пошедшей на титрование, мл; NHCl –нормальность соляной кислоты, 0,1 Н; Vа – объем аликвотной части раствора, 100 мл.
Результаты обработать методами математической статистики, найти среднее значение карбонатной жесткости воды и доверительный интервал.
2.3. Определение устранимой и некарбонатной жесткости воды
2.3.1. Цель работы
Получение представлений об устранимой и некарбонатной жесткости, самостоятельное проведение аналитического определения этих видов жесткости.
2.3.2. Оборудование
Пипетки.
Бюретка.
Колбы конические.
Термостойкий стакан.
Колба мерная.
Воронка стеклянная.
2.3.3. Реактивы
Кислота соляная, 0,01 Н раствор.
Метиловый оранжевый, 0,1%-ный водный раствор.
2.3.4. Порядок выполнения работы
Мерной колбой отмерить аликвоту исследуемого раствора равную 200 мл в сухой термостойкий стакан. Кипятить воду в течение 1 ч. После охлаждения количественно перенести воду в мерную колбу объемом 200 мл, т. е. после выливания раствора в мерную колбу несколько раз ополоснуть стенки стакана небольшим количеством дистиллированной воды из промывалки, добавляя промывные воды в мерную колбу. Затем довести объем воды в колбе до метки дистиллированной водой и фильтровать в коническую колбу. Отмерить мерной колбой 50 мл фильтрата в коническую колбу для титрования, добавить 2…3 капли метилового оранжевого. Титровать раствором 0,1 Н соляной кислоты до изменения желтой окраски индикатора в устойчивую оранжевую. Повторить титрование до трех сходящихся значений.
Рассчитать остаточную жесткость по формуле
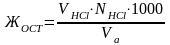 (мг-экв/л),
(3.10)
(мг-экв/л),
(3.10)
где VHCl – объем соляной кислоты, пошедшей на титрование, мл; NHCl –нормальность соляной кислоты, 0,01 Н; Vа – объем аликвотной части раствора, 100 мл.
По разности карбонатной (ЖК) и остаточной жесткости (ЖОСТ) найти устранимую жесткость (ЖУ).
По разности общей (ЖО) и карбонатной жесткости (ЖК) найти некарбонатную жесткость (ЖНК).
За окончательные результаты анализа остаточной жесткости принять среднее арифметическое трех параллельных определений, рассчитать доверительный интервал.
Результаты определения устранимой и некарбонатной жесткости обработать методами математической статистики для косвенных величин, используя формулы (1.16, 1.17), найти среднее значение устранимой и некарбонатной жесткости воды и доверительный интервал этих величин.
По окончании работы сделать вывод о соответствии жесткости анализируемой воды СанПиН 2.1.4.1074 – 01.
2.3. Задачи
Решить свой вариант задачи.
1. Вода объемом 1 л содержит 38,0 мг гидрокарбоната кальция и 19,6 мг сульфата магния. Чему равна общая жесткость воды?
2. Чему равна жесткость воды, содержащей 0,01 моль/л хлорида кальция?
3. Чему равна постоянная жесткость воды, если в 2,5 л ее содержится 40 мг сульфата кальция?
4. При кипячении 0,25 л воды, содержащей только гидрокарбонат кальция, в осадок выпадает 4 мг карбоната кальция. Чему равна временная жесткость воды?
5. Сколько граммов сульфата магния, содержится в 150 л воды, если жесткость воды, вызванная этой солью равна 4,7 мг-экв/л?
6. На титрование 25 мл воды израсходовано 2,4 мл 0,1 Н раствора HCl. Чему равна карбонатная жесткость воды?
7. На титрование 40 мл воды израсходовано 5,7 мл 0,12 Н раствора НCl. Чему равна карбонатная жесткость воды?
8. Чему равна общая жесткость воды, если в 300 л ее содержится 32,85 г гидрокарбоната кальция и 30,6 г сульфата магния?
2.4. Вопросы для контроля
1. В чем сущность комплексонометрического титрования?
2. Какие вещества используются для индикации точки эквивалентности при трилонометрическом титровании?
3. Чем определяется жесткость воды? Какие существуют виды жесткости воды?
4. Какими методами анализа проводят определение жесткости воды?
5. Перечислите и охарактеризуйте методы устранения жесткости.
6. В чем сущность титрования по методу осаждения? Рассмотреть данный метод на примере определения хлоридов титрованием нитратом серебра.
