
- •Т.Г. Крупнова, ю.И. Сухарев аналитическая химия Учебное пособие по лабораторным работам
- •Введение
- •Лабораторная работа №1 техника выполнения титриметрического анализа. Запись и обработка результатов анализа
- •1.1. Работа с аналитическими весами
- •1.2. Работа с мерной посудой
- •1.3. Обработка и запись результатов анализа
- •2.1. Бихроматометрическое определение двухвалентного железа
- •Лабораторная работа №2 кислотно-основное титрование карбонат-иона и смесей с ним
- •1.1. Кислотно-основное титрование
- •Лабораторная работа №3 определение общей и карбонатной жесткости воды
- •1.1. Комплексонометрическое титрование
- •1.2. Жесткость воды
- •Лабораторная работа №4 фотометрический анализ меди с диэтилдитиокарбаматом натрия
- •1.1. Спектрофотометрический анализ
- •1.2. Закон Бугера – Ламберта – Бера
- •Библиографический список
- •Оглавление
Лабораторная работа №2 кислотно-основное титрование карбонат-иона и смесей с ним
1.Теоретическая часть
1.1. Кислотно-основное титрование
В методах кислотно-основного титрования основной является реакция передачи протона от титранта титруемому веществу или титруемого вещества титранту. Реакции кислотно-основного взаимодействия характеризуются высокой скоростью, протекают строго стехиометрически.
В качестве рабочих растворов используют растворы сильных кислот (соляной, серной и т. д.) или сильных основания (гидроксида калия, гидроксида натрия и т. д.). Растворы кислот устойчивы и могут храниться без изменений сколь угодно долго. Растворы щелочей также устойчивы, однако их рекомендуется хранить в парафинированной и фторопластовой посуде, чтобы не допустить взаимодействия со стеклом. Необходимо также учитывать, что растворы щелочей поглощают диоксид углерода из воздуха.
Если молярная концентрация эквивалента кислоты точно известна, этот раствор можно использовать для установления концентрации щелочи и наоборот.
Для индикации точки эквивалентности в данном методе используют кислотно-основные индикаторы, например фенолфталеин, интервал перехода окраски которого рН 8,2…9,8, метиловый оранжевый с интервалом перехода окраски рН 3,1…4,4.
Данные индикаторы представляют собой различные органические соединения, являющиеся или слабыми кислотами, или слабыми основаниями, которые при диссоциации и сопровождающих ее таутомерных превращениях изменяют свою окраску. В качестве примера рассмотрим, какие химические процессы протекают при изменении окраски этих индикаторов.
Фенолфталеин в нейтральном или кислом растворе находится в бесцветной (бензоидной) форме:

При действии разбавленных растворов щелочей индикатор превращается в двухзарядный анион, имеющий хиноидную структуру и окраску:
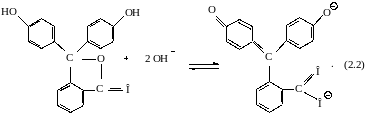
Бесцветная бензоидная форма |
Красная хиноидная форма |
В сильнощелочной среде рН > 13 фенолфталеин переходит в бесцветный трехзарядный анион:
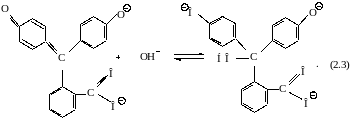
Красная хиноидная форма |
Бесцветная форма |
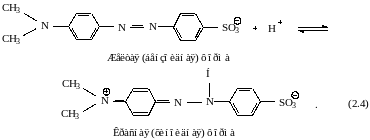
Метиловый оранжевый относится к биполярным соединениям, имеющим свойства и кислоты, и основания. Он содержит одну сильнокислотную сульфатную группу и основные аминогруппы. Поскольку диссоциация сульфатной группы протекает полностью, практически при всех значениях рН раствора индикаторные свойства метилового оранжевого зависят от состояния аминогрупп. В щелочной среде, а также в разбавленном водном растворе метиловый оранжевый находится в виде аниона, имеющего желтую бензоидную форму. При действии кислоты желтая форма индикатора переходит в красную хиноидную:
Точка эквивалентности при кислотно-основном титровании не всегда будет рН = 7, а только в случае взаимодействия сильной кислоты с сильным основанием. Для правильного выбора индикатора нужно знать ход кривой титрования. Кривые титрования показывают графическую зависимость концентрации участника реакции (или логарифма концентрации, например рН), протекающей при титровании от объема, добавленного титранта (или степени оттитрованности, f, %).
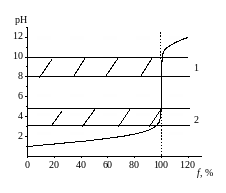
Рис. 2.1. Кривая титрования сильной кислоты сильным основанием:
1 – интервал рН изменения окраски фенолфталеина,
2 – интервал рН изменения окраски метилового оранжевого
Из рис. 2.1 следует, что при титровании сильной кислоты сильным основанием можно применять и фенолфталеин и метиловый оранжевый. При титровании сильного основания сильной кислотой применяют такие же индикаторы.
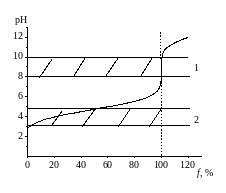
Рис. 2.2. Кривая титрования слабой кислоты сильным основанием:
1 – интервал рН изменения окраски фенолфталеина,
2 – интервал рН изменения окраски метилового оранжевого
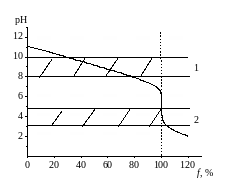
Рис. 2.3. Кривая титрования слабого основания сильной кислотой:
1 – интервал рН изменения окраски фенолфталеина,
2 – интервал рН изменения окраски метилового оранжевого
При титровании слабой кислоты (например, уксусной) сильным основанием точка эквивалентности смещается в более щелочную область, и скачок титрования становится меньше (рис. 2.2.). В этом случае для индикации точки эквивалентности можно использовать только фенолфталеин. При титровании слабого основания (например, раствора аммиака) сильной кислотой ситуация противоположная (рис. 2.3.). Фенолфталеин в этом случае не применим, для индикации нужно использовать метиловый оранжевый [1,2].
1.2. Титрование карбонат-иона и смесей с ним
Взаимодействие между карбонатом натрия и кислотой можно рассматривать как реакцию, протекающую в две стадии:
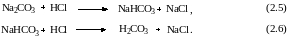
Суммарное уравнение реакции:
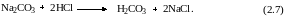
Поэтому на кривой титрования (рис. 2.4.) два скачка титрования. На первой стадии карбонат превращается в бикарбонат, отчего рН раствора становится равным 8. При этом расходуется только половина кислоты необходимой для нейтрализации карбоната.
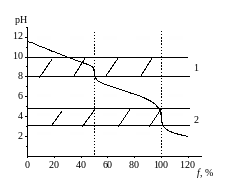
Рис. 2.4. Кривая титрования слабого основания сильной кислотой:
1 – интервал рН изменения окраски фенолфталеина,
2 – интервал рН изменения окраски метилового оранжевого
Поэтому, определяя концентрацию карбоната натрия в растворе с фенолфталеином в качестве индикатора, нужно при расчете объем титранта умножить на два. Более точный способ – оттитровать раствор с использованием в качестве индикатора метилового оранжевого до угольной кислоты.
При совместном присутствии карбоната и бикарбоната натрия с фенолфталеином оттитровывается карбонат до бикарбоната (уравнение 2.5), а с метиловым оранжевым – бикарбонат до угольной кислоты (уравнение 2.6). Таким образом, с фенолфталеином оттитровывается половина карбоната натрия, а с метиловым оранжевым – и первоначально присутствующий бикарбонат и бикарбонат, образовавшийся из карбоната.
При совместном присутствии карбоната и гидроксида натрия с фенолфталеином оттитровывается карбонат до бикарбоната (уравнение 2.5), а с метиловым оранжевым – бикарбонат до угольной кислоты (уравнение 2.6). Гидроксид натрия оттитровывается весь с фенолфталеином. Таким образом, с фенолфталеином оттитровывается половина карбоната натрия и весь гидроксид натрия, а с метиловым оранжевым – бикарбонат, образовавшийся из карбоната [3].
2. Практическая часть
2.1. Определение карбоната и бикарбоната натрия при совместном присутствии
2.1.1. Цель работы
Ознакомление с теоретическими основами кислотно-основного титрования, получение представлений о равновесии между различными формами карбонат-иона.
2.1.2. Оборудование
Колба мерная.
Воронка стеклянная.
Пипетки.
Бюретка.
Колбы конические.
2.1.3. Реактивы
Соляная кислота, фиксанал.
Метиловый оранжевый, 0,1%-ный водный раствор.
Фенолфталеин, 0,1%-ный этанольный раствор
2.1.4. Порядок выполнения работы
Приготовить из фиксанала 0,1 Н раствор соляной кислоты.
Получить у преподавателя контрольный раствор, содержащий карбонат и бикарбонат натрия. Отобрать пипеткой аликвотную часть раствора 25 мл и перенести в коническую колбу для титрования. Прибавить 4…5 капель раствора фенолфталеина (ориентируясь на окраску раствора) и оттитровать из бюретки 0,1 Н раствором соляной кислоты до обесцвечивания раствора. Отсчет записывают (V1) с точностью до сотых мл. Данный объем кислоты соответствует титрованию карбоната натрия по первой ступени. Протекает реакция 2.5, в которой карбонат взаимодействует с одним протоном водорода, таким образом, по определению эквивалента, в этой реакции молярная масса эквивалента карбоната натрия равна его молярной массе.
Доводят уровень кислоты в бюретке снова до нуля. Прибавляют к оттитрованному раствору 1…2 капли метилового оранжевого, чтобы раствор окрасился в желтый, но не очень интенсивный, цвет, и титруют кислотой до изменения окраски. Отсчет по бюретке записывают (V2). Точное титрование повторяют не менее трех раз.
На титрование исходного бикарбоната натрия расходуется объем соляной кислоты, соответствующий (V2 – V1). Это утверждение, разумеется, справедливо только в том случае, если между титрованиями уровень жидкости в бюретке был снова доведен до нуля. Если этого не сделать, объем V2 будет слишком велик, это неудобно для эксперимента, т. к. на титрование может потребоваться объем более 25 мл, т. е. более одной бюретки.
Рассчитать массу карбоната натрия в контрольном образце по формуле
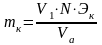 ,
(2.8)
,
(2.8)
где V1 – отсчет по бюретке при титровании с фенолфталеином, мл; N –нормальность соляной кислоты, 0,1 моль/л; Эк – молярная масса эквивалента карбоната натрия, 106 г/моль; Vа – объем аликвотной части раствора, 25 мл.
Рассчитать массу бикарбоната натрия в контрольном образце по формуле
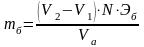 ,
(2.9)
,
(2.9)
где V1 – отсчет по бюретке при титровании с фенолфталеином, мл; V2 – отсчет по бюретке при титровании с метиловым оранжевым, мл; N –нормальность соляной кислоты, 0,1 моль/л; Эб – молярная масса эквивалента бикарбоната натрия, 84,0000 г/моль; Vа – объем аликвотной части раствора, 25 мл.
Рассчитать массу карбоната натрия для каждого из трех результатов или более результатов. Провести статистическую обработку результатов, записать результат соответствующим доверительным интервалом. Отдельно рассчитать массу бикарбоната натрия для каждого из трех результатов или более результатов. Также отдельно провести статистическую обработку результатов, записать результат соответствующим доверительным интервалом.
В отчете по лабораторной работе записать уравнения реакций, лежащих в основе титрования.
Сделать выводы по работе.
2.2. Определение карбоната и гидроксида натрия при совместном присутствии
2.2.1. Цель работы
Ознакомление с теоретическими основами кислотно-основного титрования, изучение титриметрического метода фиксирования двух точек эквивалентности
2.2.2. Оборудование
Пипетки.
Бюретка.
Колбы конические.
2.2.3. Реактивы
Соляная кислота, 0,1 Н.
Метиловый оранжевый, 0,1%-ный водный раствор.
Фенолфталеин, 0,1%-ный этанольный раствор
2.2.4. Порядок выполнения работы
Получить у преподавателя контрольный раствор, содержащий карбонат и гидроксид натрия. Отобрать пипеткой аликвотную часть раствора 25 мл и перенести в коническую колбу для титрования. Прибавить 4…5 капель раствора фенолфталеина (ориентируясь на окраску раствора) и оттитровать из бюретки 0,1 Н раствором соляной кислоты до обесцвечивания раствора. Отсчет записывают (V1) с точностью до сотых мл. Данный объем кислоты расходуется на полное титрование гидроксида натрия, присутствующего в растворе, плюс на титрование карбоната натрия по первой ступени.
Доводят уровень кислоты в бюретке снова до нуля. Прибавляют к оттитрованному раствору 1…2 капли метилового оранжевого, чтобы раствор окрасился в желтый, но не очень интенсивный, цвет, и титруют кислотой до изменения окраски. Отсчет по бюретке записывают (V2). Точное титрование повторяют не менее трех раз.
В зависимости от содержания определяемых веществ, на суммарное титрование может быть затрачено больше одной бюретки, тогда придется снова заполнять бюретку. Это уменьшит точность определения. Поэтому между титрованиями уровень жидкости в бюретке нужно снова доводить до нуля.
Поскольку при титровании с метиловым оранжевым в реакцию вступает половина карбоната натрия, то на реакцию со всем количеством было израсходовано удвоенное количество соляной кислоты. В этом случае в ходе всего эксперимента протекает суммарная реакция 2.7, т. е. карбонат вступает в реакцию с двумя протонами. По определению эквивалента, в этой реакции молярная масса эквивалента карбоната натрия равна его молярной массе деленной на два.
На титрование гидроксида натрия расходуется объем соляной кислоты соответствующий (V1 – V2).
Рассчитать массу карбоната натрия в контрольном образце по формуле
 ,
(2.10)
,
(2.10)
где V2 – отсчет по бюретке при титровании с метиловым оранжевым, мл; N –нормальность соляной кислоты, 0,1 моль/л; Эк – молярная масса эквивалента карбоната натрия, 53,0000 г/моль; Vа – объем аликвотной части раствора, 25 мл.
Рассчитать массу гидроксида натрия в контрольном образце по формуле
 ,
(2.11)
,
(2.11)
где V1 – отсчет по бюретке при титровании с фенолфталеином, мл; V2 – отсчет по бюретке при титровании с метиловым оранжевым, мл; N –нормальность соляной кислоты, 0,1 моль/л; Эг – молярная масса эквивалента гидроксида натрия, 39,9997 г/моль; Vа – объем аликвотной части раствора, 25 мл.
Рассчитать массу карбоната натрия для каждого из трех результатов или более результатов. Провести статистическую обработку результатов, записать результат соответствующим доверительным интервалом. Отдельно рассчитать массу гидроксида натрия для каждого из трех результатов или более результатов. Также отдельно провести статистическую обработку результатов, записать результат соответствующим доверительным интервалом.
В отчете по лабораторной работе записать уравнения реакций, лежащих в основе титрования.
Сделать выводы по работе.
2.3. Задачи
Решить свой вариант задачи.
1. Какой объем 39%-ного раствора серной кислоты, плотность которого равна 1,3 г/мл, надо взять для приготовления 1 л 0,1 Н раствора?
2. Сколько грамм гидроксида натрия требуется для приготовления 1 л 0,15 Н раствора?
3. Какой объем 10%-ного раствора гидроксида калия, плотность которого равна 1,08 г/мл, требуется для приготовления 1 л 0,2 Н раствора?
4. До какого объема следует разбавить 700 мл 0,24 Н раствора щелочи, чтобы получить 0,20 Н раствор?
5. Какой объем 8%-ного раствора аммиака, плотность которого равна 0,97 г/мл, требуется для приготовления 2 л 0,15 Н раствора?
6. Какой объем воды надо прибавить к 10 мл 65%-ного раствора азотной кислоты (плотность равна 1,4 г/мл) для получения 0,2 Н раствора?
7. Сколько грамм карбоната натрия может быть оттитровано 20 мл 0,2 Н раствора соляной кислоты при титровании по фенолфталеину?
8. Сколько грамм соляной кислоты содержится в пробе, если на ее титрование затрачено 25 мл 0,1101 Н раствора гидроксида натрия?
9. Сколько мл воды надо добавить к 1000 мл 0,0999 Н раствора перманганата калия, чтобы получить 0,0800Н раствор?
2.4. Вопросы для контроля
1. Перечислите требования к химическим реакциям, лежащим в основе титриметрических методов анализа.
2. Охарактеризуйте методы объемного анализа по приемам титрования: прямое, обратное, косвенное титрование.
3. Дайте характеристику титриметрическому анализу по типу химических реакций, лежащих в основе титрования.
4. Какие вещества используются в качестве титрантов в кислотно-основном титровании?
5. В соответствии с каким правилом выбирают индикатор для кислотно-основного титрования?
6. Что такое кривая титрования, скачок титрования, точка эквивалентности?
Отчего зависит ход кривой титрования?
7. Почему на кривой титрования карбоната натрия соляной кислотой два скачка титрования?
8. В чем состоит сущность анализа карбоната и бикарбоната, карбоната и гидроксида при совместном присутствии методом фиксирования двух точек эквивалентности?
